医薬品情報
| 総称名 | リオレサール |
|---|---|
| 一般名 | バクロフェン |
| 欧文一般名 | Baclofen |
| 薬効分類名 | 抗痙縮剤 |
| 薬効分類番号 | 1249 |
| ATCコード | M03BX01 |
| KEGG DRUG |
D00241
バクロフェン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リオレサール錠5mg | Lioresal Tablets | サンファーマ | 1249006F1054 | 10.4円/錠 | 劇薬, 処方箋医薬品注) |
| リオレサール錠10mg | Lioresal Tablets | サンファーマ | 1249006F2042 | 16.9円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
下記疾患による痙性麻痺
6. 用法及び用量
<成人>
通常成人には初回量として1日バクロフェン5〜15mgを1〜3回に分け食後経口投与し、以後患者の症状を観察しながら標準用量に達するまで2〜3日毎に1日5〜10mgずつ増量する。
標準用量は1日30mgであるが、患者の本剤に対する反応には個人差があるため、年齢、症状に応じて適宜増減する。
標準用量は1日30mgであるが、患者の本剤に対する反応には個人差があるため、年齢、症状に応じて適宜増減する。
<小児>
小児には初回量として1日バクロフェン5mgを1〜2回に分け食後に経口投与し、以後患者の症状を観察しながら標準用量に達するまで、2〜3日毎に1日5mgずつ増量する。なお、症状、体重に応じて適宜増減する。
標準用量
4〜6才
1日5〜15mgを2〜3回に分けて食後に経口投与する。
7〜11才
1日5〜20mgを2〜3回に分けて食後に経口投与する。
12〜15才
1日5〜25mgを2〜3回に分けて食後に経口投与する。
7. 用法及び用量に関連する注意
7.1 腎機能が低下している患者
7.2 本剤投与中の患者において、バクロフェン髄注(ギャバロン髄注)による治療を行う場合
患者の状態を慎重に観察しながら、髄注による治療開始前又は治療開始後の適切な時期に本剤の減量又は漸次中止を試みること。ただし、急激な減量又は中止を避けること。
8. 重要な基本的注意
8.1 本剤の長期連用中に投与を急に中止すると幻覚、せん妄、錯乱、興奮状態、痙攣発作等が発現したとの報告があるので、投与を中止する場合は、用量を徐々に減量するなど慎重に行うこと。
8.2 眠気等を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作には従事させないように注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 てんかん及びその既往歴のある患者
症状を誘発するおそれがある。[9.7参照]
9.1.2 精神障害のある患者
精神症状が悪化するおそれがある。
9.1.3 消化性潰瘍のある患者
腹痛等の消化器系の副作用が報告されており、症状が悪化するおそれがある。
9.1.4 呼吸不全のある患者
本剤の筋弛緩作用により呼吸抑制が起こるおそれがある。
9.2 腎機能障害患者
9.2.1 透析を必要とするような重篤な腎機能障害を有する患者
9.2.2 腎機能低下のある患者
9.3 肝機能障害患者
症状が悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で胎盤通過が報告されている。また、妊娠中に本剤を投与した患者で、新生児に離脱症状が疑われる全身痙攣があらわれたとの報告がある。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中への移行が報告されている。[16.3.1参照]
9.7 小児等
慎重に投与すること。特にてんかん及びその既往歴のある患者では発作を誘発するおそれがある。[9.1.1参照]
9.8 高齢者
低用量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。生理機能が低下していることが多く、比較的低用量で筋力低下、けん怠感等の症状があらわれることがある。
10. 相互作用
10.2 併用注意
| 血圧降下剤 | 血圧降下作用を増強するおそれがある。 | いずれも血圧降下作用を有するため。 |
| 中枢神経抑制剤 (催眠鎮静剤、抗不安剤、麻酔剤等) アルコール | 中枢神経抑制作用を増強するおそれがある。 | いずれも中枢神経抑制作用を有するため。 |
| オピオイド系鎮痛剤(モルヒネ等) | 低血圧あるいは呼吸困難等の副作用を増強するおそれがある。 | 相互に作用を増強すると考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 意識障害、呼吸抑制(いずれも頻度不明)
11.1.2 依存性(頻度不明)
幻覚・錯乱等が発現したという報告があり、精神依存形成につながるおそれがある。
11.2 その他の副作用
| 5%以上 | 1〜5% | 1%未満 | 頻度不明 | |
| 精神神経系 | 眠気(9.8%) | 頭痛・頭重、知覚異常(しびれ等)、鎮静、抑うつ | 不眠、筋肉痛、情緒不安定、幻覚、意識障害、酩酊感、譫妄、構音障害、舌の運動障害、不随意運動、痙攣発作、嚥下力低下、顔面チック、耳鳴、視調節障害 | 歩行障害、痙縮増悪、眼振 |
| 循環器 | − | − | 血圧低下、下肢うっ血、頻脈 | 徐脈 |
| 肝臓 | − | − | − | 肝障害、AST上昇、ALT上昇 |
| 消化器 | 悪心 | 嘔吐、食欲不振、胃部不快感、下痢、口渇 | 便秘、腹痛、腹部膨満感、流涎、空腹感 | 胸やけ |
| 泌尿器 生殖器 | − | 尿失禁 | 排尿困難、頻尿、勃起消失 | − |
| 皮膚症状 | − | − | 発疹 | 蕁麻疹 |
| 全身症状 | 脱力感 | 筋力低下、ふらつき、めまい | 全身けん怠感 | 低体温、薬剤離脱症候群 |
| その他 | − | − | 浮腫、発汗、胸部圧迫感 | 味覚異常、呼吸困難、血糖値上昇 |
13. 過量投与
13.1 症状
13.2 処置
特定の解毒薬は知られていないので、低血圧、高血圧、痙攣、呼吸又は循環抑制等の症状に対しては対症療法(痙攣に対するジアゼパム静脈内注射等)を行う。
胃洗浄は、特に生命に危険が及ぶような高用量を服用した場合に早期(60分以内)に実施する等、患者の状態に応じて適応を考慮すること。なお、昏睡状態や痙攣のある患者の場合は、挿管してから洗浄を行うこと。中毒量を服用したと思われる場合は、服用後早期であれば、活性炭投与を考慮すること。また、必要な場合は緩下剤(塩類又は糖類下剤)の投与を行うこと。本剤は主として腎から排泄されるため、水分の供給を十分に行い、可能ならば利尿剤を併用すること。腎機能が低下している場合には血液透析等を考慮すること1)。[9.2.1、16.5参照]
胃洗浄は、特に生命に危険が及ぶような高用量を服用した場合に早期(60分以内)に実施する等、患者の状態に応じて適応を考慮すること。なお、昏睡状態や痙攣のある患者の場合は、挿管してから洗浄を行うこと。中毒量を服用したと思われる場合は、服用後早期であれば、活性炭投与を考慮すること。また、必要な場合は緩下剤(塩類又は糖類下剤)の投与を行うこと。本剤は主として腎から排泄されるため、水分の供給を十分に行い、可能ならば利尿剤を併用すること。腎機能が低下している場合には血液透析等を考慮すること1)。[9.2.1、16.5参照]
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
本剤は錐体外路系疾患(パーキンソン症候群、アテトーシス等)の治療には適当でない。
16. 薬物動態
16.1 血中濃度
健康成人に10mg及び5mgを経口投与した場合、血中濃度は3時間後で最高に達し、血中からの消失半減期は3.6〜4.5時間であった2)。
| Tmax(h) | Cmax(ng/mL) | T1/2(h) | |
| 5mg錠 | 3 | 82.8 | 4.5 |
| 10mg錠 | 3 | 121.8 | 3.6 |
バクロフェンの血中濃度
16.2 吸収
バクロフェンは消化管からよく吸収される2)。
16.3 分布
16.4 代謝
ヒトに経口投与した場合、83〜93%が未変化体で4〜8%が代謝物として尿中に排泄され、ヒトの体内での代謝はわずかであった(外国人のデータ)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内一般臨床試験
一般臨床試験において、効果判定を5段階評価(著明改善、中等度改善、軽度改善、不変、悪化)した場合の疾患別痙性麻痺における改善度は次表のとおりである。
| 全般改善度 原因疾患 | 調査例数 | 著明改善 | 中等度改善以上 | 軽度改善以上 |
| 脳血管障害 | 121 | 4(3.3) | 24(19.8) | 82(67.8) |
| 脳性(小児)麻痺 | 134 | 10(7.5) | 34(25.4) | 73(54.5) |
| 痙性脊髄麻痺 | 54 | 2(3.7) | 22(40.7) | 44(81.5) |
| 脊髄血管障害 | 12 | 1(8.3) | 3(25.0) | 9(75.0) |
| 頸部脊椎症 | 34 | 3(8.8) | 8(23.5) | 25(73.5) |
| 後縦靱帯骨化症 | 20 | 0(0) | 4(20.0) | 13(65.0) |
| 多発性硬化症 | 13 | 0(0) | 5(38.5) | 8(61.5) |
| 筋萎縮性側索硬化症 | 7 | 0(0) | 0(0) | 2(28.6) |
| 脊髄小脳変性症 | 4 | 0(0) | 1(25.0) | 1(25.0) |
| 外傷後遺症 | 151 | 10(6.6) | 47(31.1) | 97(64.2) |
| 術後後遺症 | 42 | 4(9.5) | 14(33.3) | 34(81.0) |
| その他の脳性疾患 | 17 | 2(11.8) | 7(41.2) | 10(58.8) |
| その他のミエロパチー | 55 | 0(0) | 10(18.2) | 27(49.1) |
他覚的観察では痙縮及びクローヌスの改善度がやや高く、自覚症状ではこわばり感、つっぱり感及び歩行の改善度がやや高い。
副作用発現率は、成人では580例中223例(38.4%)、小児では140例中30例(21.4%)であった。主な副作用は、成人では眠気54件(9.3%)、脱力感39件(6.7%)、悪心30件(5.2%)等であり、小児では脱力感8件(5.8%)、眠気6件(4.3%)、嘔吐4件(2.9%)等であった。
副作用発現率は、成人では580例中223例(38.4%)、小児では140例中30例(21.4%)であった。主な副作用は、成人では眠気54件(9.3%)、脱力感39件(6.7%)、悪心30件(5.2%)等であり、小児では脱力感8件(5.8%)、眠気6件(4.3%)、嘔吐4件(2.9%)等であった。
17.1.2 国内臨床試験(二重盲検試験、脊髄部位に原因をもつ痙性麻痺患者)
脊髄部位に原因をもつ痙性麻痺患者114例(本剤群59例、塩酸トルベリゾン群55例)を対象に本剤1日30〜45mg注)を4週間経口投与し、二重盲検群間比較試験を実施した。その結果、本剤群の有用度(担当医が試験終了時に5段階で評価したもののうち、有用と判断された割合)は51%あり、本剤の有用性が認められている。
副作用発現率は、59例中26例(44.1%)であった。また、第2、3、4週の主な副作用の発現率はそれぞれ、眠気は10例(17%)、12例(20%)、10例(17%)、脱力感は7例(12%)、9例(15%)、6例(10%)、悪心は5例(9%)、6例(10%)、6例(10%)等であった4)。
副作用発現率は、59例中26例(44.1%)であった。また、第2、3、4週の主な副作用の発現率はそれぞれ、眠気は10例(17%)、12例(20%)、10例(17%)、脱力感は7例(12%)、9例(15%)、6例(10%)、悪心は5例(9%)、6例(10%)、6例(10%)等であった4)。
17.1.3 国内臨床試験(二重盲検試験、脳及び脊髄部位に原因をもつ痙性麻痺患者)
脳及び脊髄部位に原因をもつ痙性麻痺患者194例(本剤群97例、塩酸トルベリゾン群97例)を対象に本剤1日5〜40mg注)を4週間経口投与し、二重盲検群間比較試験を実施した。その結果、最終全般改善度、自覚症状改善度、副作用の出現率、有用度で両剤間に有意差は認められなかったが、神経症状のうちアキレス腱反射及び足クローヌスにおいては、推計学的に優位に優れ(p<0.05)、屈曲痙縮、下肢挙上障害では優れる傾向が認められた(p<0.10)。また、脳及び脊髄痙縮に対する本剤の改善率は、65%及び53%であった。
副作用発現率は、97例中42例(43.3%)であった。また、第1、2、3、4週の主な副作用の発現率はそれぞれ、脱力感は7例(7.2%)、11例(11.3%)、16例(16.5%)、12例(12.4%)、ふらつきは6例(6.2%)、8例(8.2%)、7例(7.2%)、6例(6.2%)、眠気は4例(4.1%)、7例(7.2%)、9例(9.3%)、7例(7.2%)、食欲不振は1例(1.0%)、4例(4.1%)、7例(7.2%)、6例(6.2%)等であった5)。
副作用発現率は、97例中42例(43.3%)であった。また、第1、2、3、4週の主な副作用の発現率はそれぞれ、脱力感は7例(7.2%)、11例(11.3%)、16例(16.5%)、12例(12.4%)、ふらつきは6例(6.2%)、8例(8.2%)、7例(7.2%)、6例(6.2%)、眠気は4例(4.1%)、7例(7.2%)、9例(9.3%)、7例(7.2%)、食欲不振は1例(1.0%)、4例(4.1%)、7例(7.2%)、6例(6.2%)等であった5)。
注)本剤の承認された用法・用量は「通常成人には初回量として1日バクロフェン5〜15mgを1〜3回に分け食後経口投与し、以後患者の症状を観察しながら標準用量に達するまで2〜3日毎に1日5〜10mgずつ増量する。標準用量は1日30mgであるが、患者の本剤に対する反応には個人差があるため、年齢、症状に応じて適宜増減する。」である。
18. 薬効薬理
18.1 作用機序
バクロフェンは神経筋接合部並びに筋紡錘に影響を及ぼさない用量で脊髄の単シナプス及び多シナプス両反射に対し選択的な抑制作用を示し、実験的固縮モデルについての実験では、上丘−下丘間除脳固縮(γ-固縮)及び貧血性除脳固縮(α-固縮)の両固縮に対し用量依存性の抑制作用が認められている。
18.2 行動観察
18.3 脊髄機能に及ぼす影響
18.3.1 単シナプス及び多シナプス反射に及ぼす影響
18.3.2 前根及び後根に及ぼす影響
18.3.3 γ-運動ニューロンに及ぼす影響
18.3.4 Renshaw細胞活性に及ぼす影響
ネコを用いた実験でRenshaw細胞活性増強作用が認められている13)。
18.4 固縮に対する作用
18.5 末梢受容器に対する作用
18.6 その他の作用
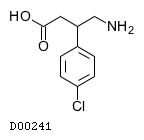
19. 有効成分に関する理化学的知見
19.1. バクロフェン
22. 包装
<リオレサール錠5mg>
100錠[10錠(PTP)×10]
1,000錠[10錠(PTP)×100]
1,000錠[瓶、バラ、乾燥剤入り]
<リオレサール錠10mg>
100錠[10錠(PTP)×10]
23. 主要文献
- 日本チバガイギー株式会社・医薬情報部編集, 日本チバガイギー医薬品過量使用時の症状と処置, 101-106, (1987)
- 高杉紀雄ほか, 日本薬学会講演要旨集(第97回), 237, (1977)
- Eriksson,G.et al., Scand.J.Clin.Lab.Invest., 41 (2), 185-187, (1981) »PubMed
- 津山直一ほか, 新薬と臨床, 26 (5), 805-824, (1977)
- 里山営二郎ほか, 診断と治療, 65 (7), 1328-1336, (1977)
- Fehr,H.U.et al., J.Int.Med.Res., 2, 36-47, (1974)
- 福田英臣ほか, 応用薬理, 13 (5), 611-626, (1977)
- Cutting,D.A.et al., Br.J.Pharmacol., 54 (2), 171-179, (1975) »PubMed
- 福田英臣ほか, 第45回日本薬理学会近畿部会1974年6月,日本薬理学雑誌, 71 (1), (1975)
- Davidoff,R.A.et al., Neurology., 24 (10), 957-963, (1974) »PubMed
- Pierau,F.K.et al., Brain Res., 17 (54), 376-380, (1973)
- Pierau,F.K.et al., Exp.Neurol., 48 (2), 343-351, (1975) »PubMed
- Benecke,R.et al., Neuropharmacology., 13 (10-11), 1067-1075, (1974) »PubMed
- Levy,R.A.et al., J.Pharmacol.Exp.Ther., 202 (2), 437-445, (1977) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
サンファーマ株式会社
くすり相談センター
〒105-0011
東京都港区芝公園1-7-6
電話:0120-22-6880 受付時間:9時〜17時(土、日、祝日、その他当社の休業日を除く)
製品情報問い合わせ先
サンファーマ株式会社
くすり相談センター
〒105-0011
東京都港区芝公園1-7-6
電話:0120-22-6880 受付時間:9時〜17時(土、日、祝日、その他当社の休業日を除く)
26. 製造販売業者等
26.1 製造販売元
サンファーマ株式会社
東京都港区芝公園1-7-6