医薬品情報
| 総称名 | リンデロン |
|---|---|
| 一般名 | ベタメタゾンリン酸エステルナトリウム フラジオマイシン硫酸塩 |
| 欧文一般名 | Betamethasone Sodium Phosphate Fradiomycin Sulfate |
| 製剤名 | ベタメタゾンリン酸エステルナトリウム・フラジオマイシン硫酸塩軟膏 |
| 薬効分類名 | 眼科、耳鼻科用合成副腎皮質ホルモン・抗生物質配合剤 |
| 薬効分類番号 | 1319 1329 |
| ATCコード | S01CA05 S03CA06 |
| KEGG DRUG |
D04246
フラジオマイシン硫酸塩・ベタメタゾンリン酸エステルナトリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年2月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| 眼・耳科用リンデロンA軟膏 | Eye,Ear RINDERON-A Ointment | シオノギファーマ | 1319812M1026 | 67.7円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 ストレプトマイシン、カナマイシン、ゲンタマイシン、フラジオマイシン等のアミノグリコシド系抗生物質又はバシトラシンに対し過敏症の既往歴のある患者
2.3 鼓膜に穿孔のある患者への耳内使用[薬剤が内耳に移行し、内耳障害があらわれるおそれがある。]
4. 効能または効果
<適応菌種>
フラジオマイシン感性菌
<適応症>
[眼科]
外眼部・前眼部の細菌感染を伴う炎症性疾患
[耳鼻科]
外耳の湿疹・皮膚炎、進行性壊疽性鼻炎、耳鼻咽喉科領域における術後処置
5. 効能または効果に関連する注意
本剤の使用に際しては適応症、起炎菌の感受性等を十分考慮すること。
6. 用法及び用量
[眼科用]
通常、適量を1日1〜数回患部に点眼・塗布する。
なお、症状により適宜増減する。
なお、症状により適宜増減する。
[耳鼻科用]
通常、適量を1日1〜数回患部に塗布する。
なお、症状により適宜増減する。
なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 非可逆性の難聴があらわれることがあるので、次の諸点に留意すること。
8.1.1 長期間連用しないこと。
8.1.2 本剤使用中は特に聴力の変動に注意すること。
8.2 使用中に感作されるおそれがあるので、観察を十分に行い、感作されたことを示す兆候があらわれた場合には使用を中止すること。
8.3 連用により、数週後から眼圧亢進、また、緑内障があらわれることがあるので、定期的に眼圧検査を実施すること。[11.1.2参照]
8.4 長期連用を避けること。[11.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 以下の患者には治療上やむを得ないと判断される場合を除き投与しないこと。
(1)角膜上皮剥離又は角膜潰瘍の患者
これらの疾患が増悪するおそれがある。
(2)ウイルス性結膜・角膜疾患、結核性眼疾患、真菌性眼疾患の患者
これらの疾患が増悪するおそれがある。
(3)耳又は鼻に結核性又はウイルス性疾患のある患者
これらの疾患が増悪するおそれがある。
9.1.2 糖尿病の患者
糖尿病が増悪するおそれがある。
9.1.3 耳手術後の患者
手術部位の治癒が遅延するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、長期・頻回使用を避けること。
9.7 小児等
特に2歳未満の場合には慎重に使用すること。小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 難聴(0.1%未満)
非可逆性の難聴があらわれることがある。
11.1.2 緑内障(0.1%未満)
連用により、数週後から眼圧亢進、また、緑内障があらわれることがある。[8.3参照]
11.1.3 角膜ヘルペス、角膜真菌症、眼部の緑膿菌感染症の誘発(いずれも頻度不明)
11.1.4 眼部の穿孔(頻度不明)
角膜ヘルペス、角膜潰瘍又は外傷等に使用した場合には穿孔を生じることがある。
11.1.5 後嚢白内障(0.1%未満)
長期使用により、後嚢白内障があらわれることがある。
11.2 その他の副作用
| 0.1〜5%未満注1 | 0.1%未満注1 | 頻度不明 | |
| 過敏症 | 眼瞼炎、結膜炎 | 刺激感 | 接触性皮膚炎 |
| 耳・鼻 | 局所にフラジオマイシンの耐性菌又は非感性菌による化膿性の感染症 | ||
| 下垂体・副腎皮質系 | 長期使用による下垂体・副腎皮質系機能の抑制 | ||
| その他 | 全身使用の場合と同様な症状注2 | 創傷治癒の遅延 |
14. 適用上の注意
14.1 薬剤交付時の注意
<眼科用>
患者に対し以下の点に注意するよう指導すること。
・薬剤汚染防止のため、塗布するとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜嚢内に塗布し、閉瞼して軟膏が全体に広がった後、開瞼すること。
・軟膏が眼瞼皮膚等についた場合には、すぐにふき取ること。
・他の点眼剤を併用する場合には、本剤を最後に使用すること。その際、少なくとも5分以上間隔をあけること。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
再評価時の臨床試験の成績は表17-1及び表17-2のとおりであった1)。
| 疾患名 | 有効例数/有効性評価対象例数 | 有効率(%) |
| 眼瞼炎 | 46/46 | 100 |
| 結膜炎 | 86/88 | 97.7 |
| 角膜炎 | 24/25 | 96.0 |
| 強膜炎・上強膜炎 | 4/4 | − |
| ブドウ膜炎 | 5/7 | − |
| 術後炎症 | 36/39 | 92.3 |
| 計 | 201/209 | 96.2 |
| 疾患名 | 有効例数/有効性評価対象例数 | 有効率(%) |
| 外耳炎・外耳湿疹 | 33/37 | 89.2 |
| 術後炎症 | 31/35 | 88.6 |
| 咽喉疾患 | 19/20 | 95.0 |
| その他 | 13/13 | 100 |
| 計 | 96/105 | 91.4 |
18. 薬効薬理
18.1 作用機序
18.1.1 ベタメタゾンリン酸エステルナトリウム
ステロイドは細胞質に存在する熱ショック蛋白質、抑制蛋白質と複合体を形成したステロイド受容体に結合後核内に移行し、ステロイド反応性の遺伝子を活性化させ、その薬理作用を発揮すると考えられている。また、血管内皮細胞やリンパ球等の細胞膜の障害を抑制するような膜の安定性に関与する作用や、フォスフォリパーゼA2と呼ばれる細胞膜リン脂質からロイコトリエンやプロスタグランジンなど種々の炎症惹起物質を誘導する重要な酵素の機能を抑える作用も知られている。
その作用機序としては、単量体のステロイドとその受容体が複合体を形成することで、NFκBやAP-1と呼ばれるサイトカイン産生の誘導や細胞接着分子の発現等を調節している細胞内転写因子の機能を抑制することで、2量体の受容体と結合した場合、リポコルチン等の誘導を介して、炎症を制御すると考えられている。免疫抑制作用に関しては、リンパ球に対する直接的な機能抑制、アポトーシスの誘導によると考えられている2)。
その作用機序としては、単量体のステロイドとその受容体が複合体を形成することで、NFκBやAP-1と呼ばれるサイトカイン産生の誘導や細胞接着分子の発現等を調節している細胞内転写因子の機能を抑制することで、2量体の受容体と結合した場合、リポコルチン等の誘導を介して、炎症を制御すると考えられている。免疫抑制作用に関しては、リンパ球に対する直接的な機能抑制、アポトーシスの誘導によると考えられている2)。
18.1.2 フラジオマイシン硫酸塩
細菌の蛋白合成を阻害することにより抗菌作用を発揮し、その作用は殺菌的である。
18.2 薬理作用
18.2.1 ベタメタゾンリン酸エステルナトリウムは合成糖質副腎皮質ホルモンであり、抗炎症作用、抗アレルギー作用を示す。
18.2.2 フラジオマイシン硫酸塩は、試験管内でグラム陽性菌のブドウ球菌属、モラクセラ・ラクナータ(モラー・アクセンフェルト菌)及びヘモフィルス・エジプチウス(コッホ・ウィークス菌)等に抗菌作用を示す。
19. 有効成分に関する理化学的知見
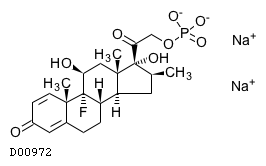
19.1. ベタメタゾンリン酸エステルナトリウム
19.2. フラジオマイシン硫酸塩
| 一般的名称 | フラジオマイシン硫酸塩 |
|---|---|
| 一般的名称(欧名) | Fradiomycin Sulfate |
| 略号 | FRM |
| 化学名 | フラジオマイシンB硫酸塩 2,6-Diamino-2,6-dideoxy-α-D-glucopyranosyl-(1→4)-[2,6-diamino-2,6-dideoxy-β-L-idopyranosyl-(1→3)-β-D-ribofuranosyl-(1→5)]-2-deoxy-D-streptamine trisulfate フラジオマイシンC硫酸塩 2,6-Diamino-2,6-dideoxy-α-D-glucopyranosyl-(1→4)-[2,6-diamino-2,6-dideoxy-α-D-glucopyranosyl-(1→3)-β-D-ribofuranosyl-(1→5)]-2-deoxy-D-streptamine trisulfate |
| 分子式 | C23H46N6O13・3H2SO4 |
| 分子量 | 908.88 |
| 物理化学的性状 | 白色〜淡黄色の粉末である。 水に溶けやすく、エタノール(95)にほとんど溶けない。 吸湿性である。 |
| 理化学知見その他 | 19.2 フラジオマイシン硫酸塩 |
| KEGG DRUG | D01618 |
20. 取扱い上の注意
高温条件下で軟膏基剤中の低融点物質(液体)が滲出すること(Bleeding現象)がある。
22. 包装
10本[5g(チューブ)×10]
23. 主要文献
- 酒井俊一ほか, 耳鼻臨床 ほか, 61, 69-72, (1968), (塩野義製薬集計)
- 片山一朗, アレルギー, 55, 1279-1283, (2006) »DOI
24. 文献請求先及び問い合わせ先
文献請求先
塩野義製薬株式会社
医薬情報センター
〒541-0045
大阪市中央区道修町3丁目1番8号
電話:0120-956-734
FAX:06-6202-1541
製品情報問い合わせ先
塩野義製薬株式会社
医薬情報センター
〒541-0045
大阪市中央区道修町3丁目1番8号
電話:0120-956-734
FAX:06-6202-1541
26. 製造販売業者等
26.1 製造販売元
シオノギファーマ株式会社
大阪府摂津市三島2丁目5番1号
26.2 販売元
塩野義製薬株式会社
大阪市中央区道修町3丁目1番8号