医薬品情報
| 総称名 | アモキサン |
|---|---|
| 一般名 | アモキサピン |
| 欧文一般名 | Amoxapine |
| 製剤名 | アモキサピンカプセル・細粒 |
| 薬効分類名 | うつ病・うつ状態治療剤 |
| 薬効分類番号 | 1179 |
| ATCコード | N06AA17 |
| KEGG DRUG |
D00228
アモキサピン
|
| KEGG DGROUP |
DG01730
非選択的モノアミン再取り込み阻害薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年11月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アモキサン細粒10% | AMOXAN FINE GRANULES | ファイザー | 1179001C1024 | 24.3円/g | 劇薬, 処方箋医薬品注) |
| アモキサンカプセル10mg | AMOXAN CAPSULES | ファイザー | 1179001M1020 | 6.1円/カプセル | 劇薬, 処方箋医薬品注) |
| アモキサンカプセル25mg | AMOXAN CAPSULES | ファイザー | 1179001M2026 | 7.9円/カプセル | 劇薬, 処方箋医薬品注) |
| アモキサンカプセル50mg | AMOXAN CAPSULES | ファイザー | 1179001M3022 | 11.7円/カプセル | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 閉塞隅角緑内障の患者[抗コリン作用により眼圧が上昇し、症状を悪化させることがある。]
2.2 三環系抗うつ剤に対し過敏症の患者
2.3 心筋梗塞の回復初期の患者[循環器系に影響を及ぼすことがあるので、心筋梗塞を増悪させるおそれがある。]
2.4 モノアミン酸化酵素阻害剤(セレギリン塩酸塩、ラサギリンメシル酸塩、サフィナミドメシル酸塩)を投与中又は投与中止後2週間以内の患者[発汗、不穏、全身痙攣、異常高熱、昏睡等があらわれることがある。][10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
6. 用法及び用量
アモキサピンとして、1日25〜75mgを1〜数回に分割経口投与する。効果不十分と判断される場合には1日量150mg、症状が特に重篤な場合には1日300mgまで増量することもある。
8. 重要な基本的注意
8.1 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には、自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
8.2 うつ症状を呈する患者は希死念慮があり、自殺企図のおそれがあるので、このような患者は投与開始早期ならびに投与量を変更する際には患者の状態及び病態の変化を注意深く観察すること。[5.、8.3-8.5、9.1.5、9.1.6、15.1.1参照]
8.3 不安、焦燥、興奮、パニック発作、不眠、易刺激性、敵意、攻撃性、衝動性、アカシジア/精神運動不穏、軽躁、躁病等があらわれることが報告されている。また、因果関係は明らかではないが、これらの症状・行動を来した症例において、基礎疾患の悪化又は自殺念慮、自殺企図、他害行為が報告されている。患者の状態及び病態の変化を注意深く観察するとともに、これらの症状の増悪が観察された場合には、服薬量を増量せず、徐々に減量し、中止するなど適切な処置を行うこと。[5.、8.2、8.4、8.5、9.1.5-9.1.8、15.1.1参照]
8.5 家族等に自殺念慮や自殺企図、興奮、攻撃性、易刺激性等の行動の変化及び基礎疾患悪化があらわれるリスク等について十分説明を行い、医師と緊密に連絡を取り合うよう指導すること。[5.、8.2-8.4、9.1.5-9.1.8、15.1.1参照]
8.6 投与量の急激な減少ないし投与の中止により、情動不安、悪寒、錯乱、頭痛、睡眠障害、倦怠感、嘔気、発汗等の離脱症状があらわれることがある。投与を中止する場合には、徐々に減量するなど慎重に行うこと。
8.7 無顆粒球症、白血球減少等の血液障害があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 排尿困難又は眼内圧亢進等のある患者
抗コリン作用によりこれらの症状を増悪させるおそれがある。
9.1.2 開放隅角緑内障の患者
抗コリン作用により眼圧が上昇し、症状を悪化させることがある。
9.1.3 心不全・心筋梗塞・狭心症・不整脈(発作性頻拍・刺激伝導障害等)等の心疾患のある患者(心筋梗塞の回復初期の患者を除く)又は甲状腺機能亢進症の患者
循環器系に影響を及ぼすことがあるので、これらの症状を増悪させるおそれがある。
9.1.4 てんかん等の痙攣性疾患又はこれらの既往歴のある患者
痙攣を起こすことがある。
9.1.5 躁うつ病患者
9.1.6 自殺念慮又は自殺企図の既往のある患者、自殺念慮のある患者
9.1.7 脳の器質障害又は統合失調症の素因のある患者
9.1.8 衝動性が高い併存障害を有する患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠動物(マウス)の器官形成期に経口投与した実験(10、20、40mg/kg/日)では、40mg/kg/日群で口蓋裂の発生、死亡胎児の増加、胎児体重の減少が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で母乳中への移行がみられている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
低用量から投与を開始するとともに、患者の状態を観察しながら、慎重に投与すること。起立性低血圧、ふらつき、抗コリン作用による口渇、排尿困難、便秘、眼内圧亢進等があらわれやすい。
10. 相互作用
10.1 併用禁忌
| モノアミン酸化酵素(MAO)阻害剤 セレギリン塩酸塩(エフピー) ラサギリンメシル酸塩(アジレクト) サフィナミドメシル酸塩(エクフィナ) [2.4参照] | 発汗、不穏、全身痙攣、異常高熱、昏睡等があらわれることがある。 なお、MAO阻害剤の投与を受けた患者に本剤を投与する場合には、少なくとも2週間の間隔をおき、また、本剤からMAO阻害剤に切り替えるときには、2〜3日間の間隔をおくことが望ましい。 | 詳細は不明であるが、相加・相乗作用によると考えられている。 |
10.2 併用注意
| 抗コリン作働薬 トリヘキシフェニジル塩酸塩等 | 口渇、排尿困難・乏尿、眼内圧亢進、視調節障害、便秘、鼻閉等があらわれることがある。 | 相互に抗コリン作用が増強されるためと考えられている。 |
| アドレナリン作働薬 エピネフリン、ノルエピネフリン等 | 心血管作用(高血圧等)を増強することがある。 | 本剤は交感神経末梢へのノルエピネフリン等の取り込みを抑制し、受容体部位へのエピネフリン作働性を上昇させ、作用を増強させる。 |
| 中枢神経抑制剤 バルビツール酸誘導体等 | 本剤の作用が増強されることがある。 | 相互に中枢神経抑制作用を増強すると考えられている。 |
| 降圧剤 グアネチジン | 降圧剤の作用を減弱することがある。 | 三環系抗うつ剤はアドレナリン作働性ニューロンでのグアネチジンの取り込みを阻害すると考えられている。 |
| シメチジン | 本剤の作用が増強されることがある。 | シメチジンにより本剤の代謝が阻害されると考えられている。 |
| スルファメトキサゾール・トリメトプリム | 本剤の作用が減弱されることがある。 | 機序は明らかでないが、本剤の代謝促進又は、作用部位での両剤の拮抗作用によるものと考えられている。 |
| アルコール | 中枢神経抑制作用が増強されることがある。 | 相互に中枢神経抑制作用を増強すると考えられている。 |
| 選択的セロトニン再取り込み阻害剤(SSRI) | 本剤の作用が増強されることがある。 | SSRIにより本剤の代謝が阻害されると考えられている。 |
| リネゾリド | セロトニン症候群の徴候及び症状(錯乱、せん妄、情緒不安、振戦、潮紅、発汗、超高熱)があらわれるおそれがあるので、十分に注意すること。 これらの徴候や症状が認められた場合には、本剤と併用薬の両方あるいはいずれか一方の投与を中止するなど適切な処置を行うこと。 | リネゾリドは非選択的、可逆的MAO阻害作用を有する。 |
| メチルチオニニウム塩化物水和物(メチレンブルー) | セロトニン症候群があらわれるおそれがある。 | 左記薬剤のMAO阻害作用によりセロトニン作用が増強されると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと1)。
11.1.1 悪性症候群(Syndrome malin)(頻度不明)
無動緘黙、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗等が発現し、それに引き続き発熱がみられる場合は、投与を中止し、体冷却、水分補給等の全身管理とともに適切な処置を行うこと。本症発症時には、白血球の増加や血清CKの上昇がみられることが多く、また、ミオグロビン尿を伴う腎機能の低下がみられることがある。
11.1.2 痙攣(0.32%)、精神錯乱(0.16%)、幻覚(頻度不明)、せん妄(頻度不明)
11.1.3 無顆粒球症(頻度不明)
無顆粒球症、白血球減少等の血液障害があらわれることがある。前駆症状として発熱、咽頭痛、インフルエンザ様症状等があらわれる場合もある。[8.7参照]
11.1.4 麻痺性イレウス(頻度不明)
腸管麻痺(食欲不振、悪心、嘔吐、著しい便秘、腹部の膨満あるいは弛緩及び腸内容物のうっ滞等の症状)を来し、麻痺性イレウスに移行することがあるので、腸管麻痺があらわれた場合には投与を中止すること。なお、この悪心、嘔吐は、本剤の制吐作用により不顕性化することもあるので注意すること。
11.1.5 遅発性ジスキネジア(頻度不明)
長期投与により、遅発性ジスキネジア(口周部等の不随意運動)があらわれることがある。
11.1.6 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、急性汎発性発疹性膿疱症(頻度不明)
11.1.7 肝機能障害(頻度不明)、黄疸(頻度不明)
AST、ALT、γ-GTPの著しい上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 循環器 | 頻脈 | 血圧降下、動悸 | 血圧上昇、不整脈、心ブロック、心発作 | |
| 精神神経系 | 眠気、不眠 | 振戦等のパーキンソン症状、躁転、頭痛・頭重、構音障害、運動失調 | 耳鳴、焦躁・不安、四肢の知覚異常、知覚異常、アカシジア(静坐不能)等の錐体外路症状 | 興奮 |
| 抗コリン作用 | 口渇(16.04%)、便秘 | 排尿困難、視調節障害 | 乏尿、鼻閉、眼内圧亢進 | |
| 過敏症 | 発疹 | 顔・舌部の浮腫、紅斑、そう痒 | ||
| 消化器 | 悪心、食欲不振、下痢 | 嘔吐、胃部不快感、味覚異常、口内炎 | 口内不快感、胃痛・腹痛 | |
| 内分泌系 | 月経異常、高プロラクチン血症、乳汁漏出、女性化乳房 | |||
| その他 | めまい | 倦怠感、発汗 | 脱力感、発熱、性欲減退、頻尿、性欲亢進、顔面や身体の違和感、四肢冷感、頸痛 | 脱毛、性機能障害 |
13. 過量投与
13.1 症状
痙攣(てんかん重積状態を含む)、昏睡、膵炎、QT延長及びアシドーシスがあらわれることがある。また、数日後に横紋筋融解に伴う急性腎尿細管壊死及びミオグロビン尿を合併し急性腎障害があらわれることがある。特に痙攣の発現に注意すること。
14. 適用上の注意
<カプセル>
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外で実施された大うつ病性障害等の精神疾患を有する患者を対象とした、複数の抗うつ剤の短期プラセボ対照臨床試験の検討結果において、24歳以下の患者では、自殺念慮や自殺企図の発現のリスクが抗うつ剤投与群でプラセボ群と比較して高かった。なお、25歳以上の患者における自殺念慮や自殺企図の発現のリスクの上昇は認められず、65歳以上においてはそのリスクが減少した。[5.、8.2-8.5、9.1.5、9.1.6参照]
15.1.2 主に50歳以上を対象に実施された海外の疫学調査において、選択的セロトニン再取り込み阻害剤及び三環系抗うつ剤を含む抗うつ剤を投与された患者で、骨折のリスクが上昇したとの報告がある。
15.2 非臨床試験に基づく情報
動物実験(ラット)で、本剤により内分泌系に対する影響がみられ、雌性動物で、乳腺小葉−腺房の発達が起こるとの報告がある。
16. 薬物動態
16.1 血中濃度
日本人健常成人14例にアモキサピン細粒10%を0.5g又はアモキサピンカプセル25mgを2カプセル、1回経口投与したときのアモキサピン未変化体の血清中濃度は、投与1〜1.5時間後に最高値(アモキサン細粒46.7±16.4ng/mL、アモキサンカプセル43.8±20.8ng/mL)に達し、24時間後にほとんど消失する。また、アモキサピンの体内主要代謝物8-ヒドロキシアモキサピンの血清中濃度は投与1.5〜2.5時間後に最高値(アモキサン細粒37.3±11.9ng/mL、アモキサンカプセル33.0±11.7ng/mL)に達し、24時間後も比較的高い値を示す2)。
16.4 代謝
健常成人26例にアモキサピンカプセル50mg、1カプセルを1回経口投与した実験では血中濃度は、投与1.46時間後に最高値(34.8ng/mL)を示す。アモキサピンは体内において大部分が8-ヒドロキシアモキサピンに代謝され、アモキサピン及び8-ヒドロキシアモキサピンの血中半減期はそれぞれ約8時間及び30時間である3)(外国人データ)。
16.5 排泄
アモキサピン及びその代謝物は主として尿中ヘグルクロン酸抱合体として排泄され、尿中排泄率は48時間で43%である3)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
細粒剤における、国内11施設で実施された、うつ病・うつ状態患者117例を対象とする一般臨床試験での改善率(中等度改善以上)は75.2%(88例//117例)である4)。(承認時の集計)
17.2 製造販売後調査等
カプセル剤における、国内で実施されたうつ病・うつ状態患者3,177例を対象とする一般臨床試験及び市販後の調査における改善率(中等度改善以上)は70.1%(2,228例/3,177例)である4)。(再審査終了時の集計)
18. 薬効薬理
18.1 作用機序
アモキサピンのうつ病・うつ状態に対する作用機序の一つとして、脳神経細胞への遊離カテコールアミンの再取り込みを阻害することにより、シナプスにおけるカテコールアミンの濃度を上昇させることが挙げられている。
18.1.1 セロトニン、ノルアドレナリンの神経終末顆粒への取り込み阻止作用
アモキサピンはラットの中脳、間脳から得た神経終末顆粒へのセロトニン、ノルアドレナリンの取り込みを阻害する5)(in vitro)。
18.1.2 脳内モノアミン(ドーパミン、ノルアドレナリン、セロトニン)に及ぼす作用
アモキサピンはマウスの脳内のドーパミン、ノルアドレナリンの含量を低下させるがセロトニンには影響がない6)(マウス、腹腔内投与)。
18.1.3 抗テトラベナジン作用
アモキサピンはテトラベナジンによる自発運動量の低下、眼瞼下垂を抑制する(マウス、腹腔内投与)。
18.1.4 抗レセルピン作用
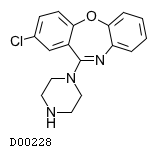
19. 有効成分に関する理化学的知見
19.1. アモキサピン
22. 包装
<アモキサンカプセル10mg>
100カプセル[10カプセル(PTP)×10]
<アモキサンカプセル25mg>
100カプセル[10カプセル(PTP)×10]
1,000カプセル[500カプセル(瓶)×2]
<アモキサンカプセル50mg>
100カプセル[10カプセル(PTP)×10]
<アモキサン細粒10%>
100g[瓶]
23. 主要文献
- 社内資料:アモキサンカプセル・細粒 副作用集計
- 社内資料:アモキサンカプセルとアモキサン細粒の血清中濃度
- 社内資料:アモキサピン:アモキサピンカプセル剤のヒトにおける薬動力学および生物学的利用性の検討
- 社内資料:アモキサンカプセル・細粒 臨床成績集計
- 社内資料:アモキサピンの神経薬理学的特性
- 社内資料:アモキサピンのマウス脳内ノルエピネフリン、ドーパミンおよびセロトニン濃度に及ぼす影響
- 君島 健次郎ほか, 米子医学雑誌, 27 (5,6), 523-536, (1976)
- Chermat R,et al., Arzneim-Forsch,Drug Res., 29 (5), 814-820, (1979) »PubMed
- 社内資料:神経薬理学 アモキサピン及びイミプラミンの効果の比較研究
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
製品情報センター
〒151-8589
東京都渋谷区代々木3-22-7
電話:学術情報ダイヤル 0120-664-467
FAX:03-3379-3053
製品情報問い合わせ先
ファイザー株式会社
製品情報センター
〒151-8589
東京都渋谷区代々木3-22-7
電話:学術情報ダイヤル 0120-664-467
FAX:03-3379-3053
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7