医薬品情報
| 総称名 | チガソン |
|---|---|
| 一般名 | エトレチナート |
| 欧文一般名 | Etretinate |
| 製剤名 | エトレチナートカプセル |
| 薬効分類名 | 角化症治療剤 |
| 薬効分類番号 | 3119 |
| ATCコード | D05BB01 |
| KEGG DRUG |
D00316
エトレチナート
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第2版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| チガソンカプセル10 | TIGASON Capsules | 太陽ファルマ | 3119001M1020 | 467.7円/カプセル | 劇薬, 処方箋医薬品注) |
| チガソンカプセル25 | TIGASON Capsules | 太陽ファルマ | 3119001M2027 | 1022.9円/カプセル | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
○諸治療が無効かつ重症な下記疾患
6. 用法及び用量
通常成人は寛解導入量エトレチナートとして1日40〜50mgを2〜3回に分けて2〜4週間経口投与する。1日最高用量は75mgまでとする。その後、症状に応じて寛解維持量エトレチナートとして1日10〜30mgを1〜3回に分けて経口投与する。
幼・小児では寛解導入量エトレチナートとして1日体重1kgあたり1.0mgを1〜3回に分けて2〜4週間経口投与する。その後、症状に応じて寛解維持量エトレチナートとして1日体重1kgあたり0.6〜0.8mgを1〜3回に分けて経口投与する。
なお、年齢、体重、症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤には催奇形性があり、また副作用の発現頻度が高いので、諸治療が無効な重症の場合にのみ、使用上の注意を考慮して使用すること。
なお、使用に際して患者に以下の副作用についてよく説明すること。
なお、使用に際して患者に以下の副作用についてよく説明すること。
8.2 本剤の使用に際しては、患者又はそれに代わり得る適切な者に次の注意事項についてよく説明し、理解させた後、同意を書面で得てから使用すること。[1.、2.1参照]
8.2.1 妊娠する可能性のある女性への投与に際しては、次の正常な生理周期の2日又は3日目まで投与を開始しないこと。また、本剤の投与開始前2週間以内の妊娠検査を行うなど、妊娠していないことを確認すること。[9.4.1参照]
8.2.2 本剤には催奇形性があるので、妊娠する可能性のある女性で他に代わるべき治療法がない重症な患者にやむを得ず投与する場合には、投与中及び投与中止後少なくとも2年間は避妊させること。[9.4.1参照]
8.2.3 本剤はモルモットを用いた動物実験で、精子形成能に異常を起こすことが報告されているので男性に投与する場合には、投与中及び投与中止後少なくとも6ヵ月間は避妊させること。
8.2.4 本剤には催奇形性があり、また副作用の発現頻度が高いので、投与中及び投与中止後少なくとも2年間は献血を行わないよう指導すること。
8.3 本剤の長期投与を受けた患者で過骨症及び骨端の早期閉鎖を起こすことがある。したがって投与中に関節痛・骨痛等の症状があらわれた場合には速やかに主治医に連絡するよう指示すること。また、本剤の長期投与に際しては、定期的な問診(骨・筋等の痛みや運動障害)、X線検査、Al-P、Ca、P、Mg等の臨床生化学的検査を行うことが望ましい。なお、骨の成長が終了していない25歳以下の患者には、治療上の有益性が危険性を上回ると判断された場合にのみ観察(定期的なX線検査、Al-P、Ca、P、Mg等の臨床生化学的検査)を十分に行いながら慎重に投与すること。[9.1.1、9.7.2参照]
8.5 本剤の高中性脂肪血症の患者への投与は、脂質代謝障害の危険性が高いので、その素因のある患者には血中トリグリセライドの検査を行うこと。[9.1.2参照]
8.6 本剤の投与により脱毛が起こることがある。
8.7 本剤は臨床試験で落屑、口唇炎の副作用発現率が高いので十分な経過観察を行い、投与量の増減又は投与の継続を慎重に判断すること。口唇炎の対症療法には、ワセリンやコルチコイド外用剤が用いられている。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.2 糖尿病患者、肥満者、アルコール中毒症患者、脂質代謝異常患者など高中性脂肪血症の素因がある患者
脂質代謝異常が起こるおそれがある。[8.5参照]
9.2 腎機能障害患者
9.2.1 腎障害のある患者
投与しないこと。本剤の作用が増強するおそれがある。[2.4参照]
9.3 肝機能障害患者
9.4 生殖能を有する者
9.5 妊婦
9.6 授乳婦
授乳を避けさせること。動物実験(ラット)で、乳汁中へ移行することが報告されている。
9.7 小児等
9.7.1 低出生体重児、新生児、乳児を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
10. 相互作用
10.1 併用禁忌
| ビタミンA製剤 (チョコラA 等) [2.5参照] | ビタミンAの正常血中濃度には影響を及ぼさないが、ビタミンA過剰症と類似した副作用症状があらわれることがある。 | 本剤はビタミンA様作用を示すため、ビタミンA様作用が増強される。 |
10.2 併用注意
| フェニトイン | フェニトインの血中濃度が上昇し、フェニトインの作用が増強するおそれがある。 | フェニトインの蛋白結合能を低下させることがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 中毒性表皮壊死症(Toxic Epidermal Necrolysis:TEN)、多形紅斑、血管炎(いずれも頻度不明)
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 皮膚 | 落屑(63.5%)、皮膚菲薄化(28.7%)、そう痒(33.4%)、脱毛(14.4%)、爪囲炎、発汗 | 爪脆弱化、皮下出血、発疹、紅斑、色素沈着、亀裂 | ざ瘡、水疱、皮膚乾燥 | 毛髪異常(縮れ、変色等) |
| 粘膜 | 口唇炎(80.7%)、口内乾燥(61.5%)、鼻腔乾燥(6.3%)、口角炎 | 口腔内びらん | 口内炎、咽頭痛、舌痛 | |
| 肝臓 | AST、ALT、Al-P、LDHの上昇 | 黄疸 | ||
| 骨・関節 | 関節痛 | 骨異常(過骨症、骨端の早期閉鎖、骨痛等) | ||
| 脂質代謝 | トリグリセライド値の上昇 | 血清コレステロール値の上昇 | ||
| 腎臓 | 頻尿、BUN上昇 | クレアチニン値上昇 | ||
| 血液 | 貧血、白血球減少、白血球増多 | |||
| 眼 | 結膜炎 | 眼瞼腫脹(乾燥、そう痒) | 眼脂、眼痛、眼精疲労、目のかすみ | 夜間視力低下 |
| 消化器 | 嘔気、嘔吐 | 腹痛、下痢、食欲不振 | ||
| 精神神経系 | 頭痛・頭重 | めまい、しびれ感、不眠 | 頭蓋内圧亢進(初期症状:うっ血乳頭、頭痛、悪心、嘔吐、視覚異常) | |
| その他 | ほてり、倦怠感(脱力感) | 悪寒、発熱、体重減少、浮腫、中耳炎(耳漏)、耳鳴、味覚異常、耐糖能異常 | 肉芽腫、筋肉痛 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 メトトレキサートとの併用により、肝炎の危険性を上昇させたとの報告がある。
15.1.2 牛乳又は高脂肪食により、本剤の吸収が増加するとの報告がある。[16.2.1参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子5例にエトレチナートとして25mgを単回経口投与したとき、未変化体及び活性代謝物(脱エチル体)の血清中濃度は図1のとおりであった。また、薬物動態パラメータは以下の表のとおりであった1)。
図1 単回投与後の血清中濃度
| 成分\パラメータ | Cmax(ng/mL) | tmax(hr) | t1/2(hr) |
| エトレチナート | 50±25 | 4±1 | 2±1 |
| 活性代謝物(脱エチル体) | 85±25 | 6±2 | 4±1 |
16.1.2 連続投与
チガソンの長期投与(4〜234週)を受けた197例の患者におけるエトレチナートの排泄半減期は約100日と考えられた。単回経口投与時に比べ、このような長い排泄半減期を示す理由としては、長期投与中に脂肪組織(主に皮下脂肪)に取り込まれたエトレチナートが徐々に血中へ流出してくることが考えられた2)。(外国人データ)
16.2 吸収
16.2.1 食事の影響
16.3 分布
患者8例にエトレチナートとして1日50mgを4週間連続経口投与したとき、投与中及び投与中止後7週目までの皮下組織、血清、真皮、表皮における未変化体と活性代謝物の合計濃度は図2のとおりであった5)。(外国人データ)
図2 4週間連続経口投与後の未変化体と活性代謝物の合計濃度
16.5 排泄
健康成人男子5例にエトレチナートとして1日25mgを4日間連続経口投与したとき、投与開始後7日目までに糞便中に未変化体は投与量の約49%、活性代謝物は数%が認められたが、尿中にはいずれも認められなかった1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内一般臨床試験
承認時までに実施された683例を対象とした一般臨床試験における有効率は以下のとおりであった。
(1)皮膚科領域
| 疾患名 | 例数 | 有効率(%)(有効以上) | |
| 乾癬群 | 尋常性乾癬 | 186 | 73.1 |
| 膿疱性乾癬 | 28 | 92.9 | |
| 乾癬性紅皮症 | 27 | 96.3 | |
| 乾癬性関節炎 | 6 | 100.0 | |
| 魚鱗癬群 | 尋常性魚鱗癬 | 16 | 75.0 |
| 水疱型先天性魚鱗癬様紅皮症 | 16 | 75.0 | |
| 非水疱型先天性魚鱗癬様紅皮症 | 26 | 96.2 | |
| 掌蹠角化症 | 28 | 82.1 | |
| ダリエー病 | 35 | 88.6 | |
| 掌蹠膿疱症 | 46 | 67.4 | |
| 毛孔性紅色粃糠疹 | 37 | 70.3 | |
| 紅斑性角化症 | 10 | 70.0 | |
(2)口腔外科領域
| 疾患名 | 例数 | 有効率(%)(有効以上) |
| 口腔白板症 | 60 | 60.0 |
| 口腔乳頭腫 | 10 | 80.0 |
| 口腔扁平苔癬 | 74 | 71.6 |
17.1.2 国内二重盲検比較試験
重症の乾癬(尋常性乾癬、膿疱性乾癬、乾癬性紅皮症、乾癬性関節炎)を対象とし、プラセボを対照薬としたクロスオーバー法による二重盲検試験結果は以下のとおりであった6)。
| 治療 | 薬剤 | 例数 | 軽快率(%)(軽快以上) |
| 第1治療 | エトレチナート | 30 | 60.0 |
| プラセボ | 31 | 3.2 | |
| 第2治療 | エトレチナート | 28 | 78.6 |
| プラセボ | 30 | 30.0 |
主な副作用は、口唇炎39例67.2%(39/58)口腔内乾燥41.4%、落屑43.1%、口渇24.1%などであった。
18. 薬効薬理
18.1 作用機序
本剤は皮膚角化異常症及び口腔粘膜の過角化病変に対し、対症療法として奏効する。その詳細な作用機序は明らかではないが、落屑(角層細胞の接着力の低下)とともに正常な上皮の再形成(増殖及び分化)に関与するものと考えられる7)。
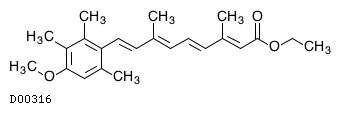
19. 有効成分に関する理化学的知見
19.1. エトレチナート
20. 取扱い上の注意
アルミピロー包装開封後は遮光し、吸湿に注意すること。
22. 包装
<チガソンカプセル10>
100カプセル[10カプセル(PTP)×10]
<チガソンカプセル25>
100カプセル[10カプセル(PTP)×10]
23. 主要文献
- 安原 一,他, 臨床薬理, 13, 243-252, (1982) »DOI
- Paravicini,U.,et al., Retinoid Therapy., 11, (1984), (MTP Press Limited,Lancaster.)
- Digiovanna,J.J.,et al., J.Invest.Dermatol., 82, 636-640, (1984) »PubMed
- Colburn,W.A.,et al., J.Clin.Pharmacol., 25, 583-589, (1985) »PubMed
- Rollman,O.,et al., Br.J.Dermatol., 109, 439-447, (1983) »PubMed
- Etretinate臨床研究班, 臨床評価, 11, 489-509, (1983)
- 北島康雄, 日本皮膚科学会雑誌, 91, 1415-1419, (1981)
24. 文献請求先及び問い合わせ先
文献請求先
製品情報問い合わせ先
26. 製造販売業者等
26.1 製造販売元
太陽ファルマ株式会社
〒100-0005
東京都千代田区丸の内1-6-5