医薬品情報
| 総称名 | アタラックス |
|---|---|
| 一般名 | ヒドロキシジン塩酸塩 |
| 欧文一般名 | Hydroxyzine Hydrochloride |
| 製剤名 | ヒドロキシジン塩酸塩注射液 |
| 薬効分類名 | 抗アレルギー性緩和精神安定剤 |
| 薬効分類番号 | 1179 |
| ATCコード | N05BB01 |
| KEGG DRUG |
D00672
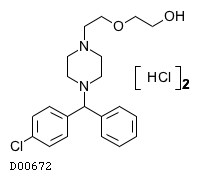
ヒドロキシジン塩酸塩
|
| KEGG DGROUP |
DG00912
ヒドロキシジン
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2020年12月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 12.臨床検査結果に及ぼす影響 13.過量投与 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アタラックス−P注射液(25mg/ml) | Atarax-P Parenteral Solution(25mg/ml) | ファイザー | 1179401A1026 | 59円/管 | 処方箋医薬品注) |
| アタラックス−P注射液(50mg/ml) | Atarax-P Parenteral Solution(50mg/ml) | ファイザー | 1179401A2022 | 61円/管 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
6. 用法及び用量
静脈内注射
ヒドロキシジン塩酸塩として、通常成人1回25〜50mgを必要に応じ4〜6時間毎に静脈内注射するか又は点滴静注する。ただし、1回の静注量は100mgを超えてはならず、25mg/分以上の速度で注入しないこと。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
筋肉内注射
ヒドロキシジン塩酸塩として、通常成人1回50〜100mgを必要に応じ4〜6時間毎に筋肉内注射する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
8.1 眠気を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械類の操作には従事させないよう注意すること。
8.2 末梢の壊死を起こすおそれがあるので、動脈内には絶対投与しないこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 てんかん等の痙攣性疾患、又はこれらの既往歴のある患者
痙攣閾値を低下させることがある。
9.1.2 QT延長のある患者(先天性QT延長症候群等)、著明な徐脈や低カリウム血症等がある患者
9.1.3 下記の患者
9.2 腎機能障害患者
中等度又は重度の腎障害のある患者で血中濃度半減期が延長したとの報告がある。[16.6.1参照]
9.3 肝機能障害患者
血中濃度半減期が延長したとの報告がある。[16.6.2参照]
9.5 妊婦
9.6 授乳婦
授乳を避けさせること。本剤がヒト母乳中に移行するかどうかは知られていないが、授乳中の新生児に中枢神経抑制、緊張低下があらわれたとの報告がある。
9.7 小児等
低出生体重児、新生児に使用する場合には十分注意すること。外国において、ベンジルアルコールの静脈内大量投与(99〜234mg/kg)により、中毒症状(あえぎ呼吸、アシドーシス、痙攣等)が低出生体重児に発現したとの報告がある。本剤は添加剤としてベンジルアルコールを含有している。
9.8 高齢者
減量するなど注意すること。一般に高齢者では生理機能が低下している。[16.6.3参照]
10. 相互作用
相互作用序文
本剤は、in vitro試験において、主としてCYP3A4/CYP3A5及びアルコール脱水素酵素で代謝されることが報告されているため、これらの薬物代謝酵素を阻害する薬剤と併用した場合、本剤の血中濃度が上昇するおそれがある。[16.4.2参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP3A5
薬物代謝酵素用語
アルコール脱水素酵素
10.2 併用注意
| バルビツール酸誘導体・麻酔剤・麻薬系鎮痛剤等の中枢神経抑制剤、アルコール、モノアミン酸化酵素(MAO)阻害剤 | 相互に作用を増強するおそれがある3)ので減量するなど慎重に投与すること。 | 両剤ともに中枢神経抑制作用を有するため、併用により作用が増強されるおそれがある。 |
| ベタヒスチン、抗コリンエステラーゼ剤(ネオスチグミン臭化物等) | これらの薬剤の作用を減弱させるおそれがある6)。 | 本剤はこれらの薬剤の作用と拮抗することがある。 |
| シメチジン | シメチジンとの併用により、本剤の血中濃度が上昇したとの報告がある7)。 | シメチジンは本剤の肝臓での主な代謝酵素であるCYP1A2、CYP2C19、CYP2D6、CYP3A4、CYP3A5を阻害し、本剤の代謝、排泄を遅延させる。 |
| 不整脈を引き起こすおそれのある薬剤(シベンゾリンコハク酸塩等) | 併用により心室性不整脈等の副作用があらわれたとの報告がある。 | ともに心血管系の副作用を起こすおそれがある。 |
| QT延長を起こすことが知られている薬剤 [9.1.2、11.1.2参照] | QT延長、心室頻拍(torsade de pointesを含む)を起こすおそれがある。 | 併用によりQT延長作用が増強されるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)
蕁麻疹、胸部不快感、喉頭浮腫、呼吸困難、顔面蒼白、血圧低下等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.3 肝機能障害(頻度不明)、黄疸(頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.4 注射部位の壊死(頻度不明)、皮膚潰瘍(頻度不明)
11.1.5 急性汎発性発疹性膿疱症(頻度不明)
11.2 その他の副作用
| 1%以上a) | 1%未満a) | 頻度不明 | |
| 精神・神経系 | 眠気 | 不安、めまい | 倦怠感、不随意運動、振戦、痙攣、頭痛、幻覚、興奮、錯乱、不眠、傾眠 |
| 消化器 | 口渇 | 嘔気・嘔吐 | 食欲不振b)、胃部不快感b)、便秘 |
| 循環器 | 血圧降下、頻脈 | ||
| 過敏症 | 発疹、紅斑、多形滲出性紅斑、浮腫性紅斑、紅皮症、そう痒、蕁麻疹 | ||
| 注射部位 | 疼痛 | 腫脹、硬結、静脈炎、しびれ、知覚異常、筋萎縮、筋拘縮 | |
| その他 | 霧視、尿閉、発熱 |
12. 臨床検査結果に及ぼす影響
本剤はアレルゲン反応を抑制するため、アレルゲン皮内反応検査又は気道過敏性試験を実施する少なくとも5日前より本剤の投与を中止することが望ましい。
13. 過量投与
13.1 症状
過度の鎮静、また、まれに振戦、痙攣、低血圧、意識レベルの低下、嘔気・嘔吐等があらわれることがある。
13.2 処置
エピネフリンは昇圧作用を逆転させるおそれがあるので投与しないことが望ましい。
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 静脈内注射時
(1)投与速度
注射方法等に十分注意し25mg/分未満の注射速度でできるだけ遅くすること。皮内又は皮下に薬液が漏出し、静脈炎、一過性の溶血等を起こすおそれがある。
(2)注射方法
本剤を静注する場合は、点滴静注により行うのが望ましい。また本剤を稀釈せず点滴静注の側管より直接注入することは避けること。
14.1.2 筋肉内注射時
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
ヒドロキシジン塩酸塩100mgを成人患者に筋注投与すると、血中濃度は投与後30分で約90ng/mL、2時間で約110ng/mL、以後漸減し、24時間では約40ng/mLとなり、最高血中濃度到達時間は約2時間であった8)(ガスクロマトグラフィー)(外国人データ)。
16.2 吸収
注射部位で吸収される。
16.3 分布
16.3.1 血液−脳関門通過性
16.3.2 胎児への移行性
16.4 代謝
16.4.1 代謝経路
ヒドロキシジンは肝で代謝される。
16.4.2 代謝に関与する酵素
主としてCYP3A4/CYP3A5及びアルコール脱水素酵素で代謝される。[10.参照]
16.4.3 代謝物の活性の有無
ヒトの主要代謝物として、中枢抑制作用がなく抗ヒスタミン作用をもつ活性物質セチリジンがあるが、代謝過程等の詳細については明らかでない12)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
ヒドロキシジンを腎機能障害患者に投与し、体内薬物動態を検討した報告はない。但し、以下の結果より、腎機能障害患者ではヒドロキシジンの活性代謝産物であるセチリジンの投与時に、セチリジンのt1/2を延長させること等が報告されているので、腎機能障害患者への投与は、ヒドロキシジンの作用が延長する可能性がある。
セチリジン10mgを、健康成人(Normal,Group I)、腎機能障害患者(Mild,Group II、Moderate,Group III)に投与し、体内動態を検討した結果、健康成人に比較し、腎機能障害患者では、分布容積Vd/Fには、差がみられないが、t1/2は延長し、総クリアランスTBC/Fは低値となった13)(外国人データ)。[9.2参照]
| Normal,Group I(n=5) | Mild,Group II(n=5) | Moderate,Group III(n=5) | |
| Tmax(hr) | 0.9±0.2 | 1.1±0.2 | 2.2±1.1 |
| Cmax(ng/mL) | 313±45 | 356±64 | 357±172 |
| AUC(mg・hr/L) | 2.7±0.4 | 6.9±1.8 | 10.7±2.4 |
| t1/2(hr) | 7.4±3.0 | 19.2±3.3 | 20.9±4.4 |
| TBC/F(mL/hr/kg) | 47±7 | 17±4 | 15±4 |
| Vd/F(L/kg) | 0.50±0.07 | 0.46±0.1 | 0.54±0.21 |
| 腎クリアランス(mL/min) | 40.5±10.1 | 7.1±3.6 | 2.8±1.5 |
| クレアチニンクリアランス(mL/min) | 122±16 | 44±11 | 19±10 |
16.6.2 肝機能障害患者
ヒドロキシジン塩酸塩0.7mg/kg(シロップ液)を原発性胆汁性肝硬変の患者8人に単回投与した結果、t1/2の平均値は36.6±13.1hrであり、健康成人のt1/2 20.0±4.1hrに比較して延長した。また、ヒドロキシジンの活性代謝産物であるセチリジンのt1/2も同患者群では健康成人のt1/2 11.4±3.1hrと比較し25.0±8.2hrに延長した14)(外国人データ)。[9.3参照]
| 健康成人(n=7) | 肝機能障害患者(n=8) | ||
| 年齢(yr) | 29.3±9.4 | 53.4±11.2 | |
| ヒドロキシジン | Cmax(ng/mL) | 72.5±11.1 | 116.5±60.6 |
| Tmax(hr) | 2.1±0.4 | 2.3±0.7 | |
| t1/2(hr) | 20.0±4.1 | 36.6±13.1 | |
| クリアランス(mL/min/kg) | 9.8±3.2 | 8.7±7.5 | |
| Vd(L/kg) | 16.0±3.0 | 22.7±13.3 | |
| セチリジン | Cmax(ng/mL) | 373.8±157.6 | 500.4±302.0 |
| Tmax(hr) | 3.8±0.9 | 4.8±2.8 | |
| t1/2(hr) | 11.4±3.1 | 25.0±8.2 | |
16.6.3 高齢者
18. 薬効薬理
18.1 作用機序
18.1.1 中枢抑制作用
ヒドロキシジンは、視床、視床下部、大脳辺縁系などに作用し、中枢抑制作用を示すものと考えられている17)。
18.1.2 制吐作用
ヒドロキシジンは、アポモルヒネ及びベラトルムアルカロイドによるイヌ嘔吐に対し抑制作用を示す。
18.2 薬効を裏付ける試験
19. 有効成分に関する理化学的知見
19.1. ヒドロキシジン塩酸塩
22. 包装
<アタラックス-P注射液(25mg/ml)>
10アンプル
<アタラックス-P注射液(50mg/ml)>
50アンプル
23. 主要文献
- Zuidema,J., Pharm Weekbl Sci., 7 (4), 134-140, (1985) »PubMed
- Moore,M.R.et al., Clin Biochem., 22 (3), 181-188, (1989) »PubMed
- Parfitt,K., Martindale The Complete Drug Reference 32nd ed., 397-401, (1999), (Pharmaceutical Press.)
- Briggs,G.G.et al., Drugs in Pregnancy and Lactation 10th ed., 2015, 675-677, (Lippincott Williams & Wilkins.)
- Prenner,B.M., Am J Dis Child., 131 (5), 529-530, (1977) »PubMed
- Sweetman,C., Martindale The Complete Drug Reference 34th ed., 1492-1494, (2004), (Pharmaceutical Press.)
- Salo,O.P.et al., Acta Derm Venereol., 66 (4), 349-350, (1986) »PubMed
- Stambaugh,J.E.Jr.et al., Cancer Invest., 1 (2), 111-117, (1983) »PubMed
- Close,J.A.et al., Int Congr Ser., 145, 144-155, (1968)
- Pong,S.F.et al., J Pharm Sci., 63 (10), 1527-1532, (1974) »PubMed
- 長内 国臣ほか, 分娩と麻酔, 21, 13-18, (1967)
- Gengo,F.M.et al., Clin Pharmacol Ther., 42 (3), 265-272, (1987) »PubMed
- Matzke,G.R.et al., Ann Allergy., 59 (6 Pt 2), 25-30, (1987) »PubMed
- Simons,F.E.R.et al., J Clin Pharmacol., 29 (9), 809-815, (1989) »PubMed
- Simons,F.E.R.et al., J Allergy Clin Immunol., 73 (1 Pt 1), 69-75, (1984) »PubMed
- Simons,K.J.et al., Clin Pharmacol Ther., 45 (1), 9-14, (1989) »PubMed
- 渡辺 繁紀ほか, 日本薬理学雑誌, 70 (1), 19-37, (1974) »DOI
- Morren,H.G.et al., Psychopharmacological Agents Gordon,M.ed.Vol.4., 251-285, (1964), (Academic Press.)
- Levis,S.et al., Arch Int Pharmacodyn Ther., 109 (1-2), 127-142, (1957) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
製品情報センター
〒151-8589
東京都渋谷区代々木3-22-7
電話:学術情報ダイヤル 0120-664-467
FAX:03-3379-3053
製品情報問い合わせ先
ファイザー株式会社
製品情報センター
〒151-8589
東京都渋谷区代々木3-22-7
電話:学術情報ダイヤル 0120-664-467
FAX:03-3379-3053
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7