医薬品情報
| 総称名 | サノレックス |
|---|---|
| 一般名 | マジンドール |
| 欧文一般名 | Mazindol |
| 製剤名 | マジンドール錠 |
| 薬効分類名 | 食欲抑制剤 |
| 薬効分類番号 | 1190 |
| ATCコード | A08AA05 |
| KEGG DRUG |
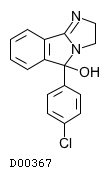
D00367
マジンドール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年8月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| サノレックス錠0.5mg | Sanorex Tablets | 富士フイルム富山化学 | 1190008F1020 | 165.8円/錠 | 劇薬, 向精神薬(第三種向精神薬), 習慣性医薬品注1), 処方箋医薬品注2) |
1. 警告
1.1 本剤の主要な薬理学的特性はアンフェタミン類と類似しており、本剤を投与する際は、依存性について留意すること。また、海外においては食欲抑制剤の多くで数週間以内に薬物耐性がみられるとの報告がある。[11.1.1参照]
1.2 本剤の適用にあたっては、使用上の注意に留意し、用法及び用量、効能又は効果を厳守すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 閉塞隅角緑内障の患者[眼圧が上昇するおそれがある。]
2.3 重症の心障害のある患者[症状が悪化するおそれがある。]
2.4 重症の膵障害のある患者[インスリン分泌抑制作用を有する。]
2.6 重症高血圧症の患者[カテコラミンの昇圧作用を増強する。]
2.7 脳血管障害のある患者[症状が悪化するおそれがある。]
2.8 不安・抑うつ・異常興奮状態の患者及び統合失調症等の精神障害のある患者[症状が悪化するおそれがある。]
2.9 薬物・アルコール乱用歴のある患者[一般に依存性、乱用が起こりやすいと考えられる。]
2.10 MAO阻害剤(セレギリン塩酸塩、ラサギリンメシル酸塩及びサフィナミドメシル酸塩)投与中又は投与中止後2週間以内の患者[10.1参照]
2.11 妊婦又は妊娠している可能性のある女性[9.5参照]
2.12 小児[9.7参照]
4. 効能または効果
あらかじめ適用した食事療法及び運動療法の効果が不十分な高度肥満症(肥満度が+70%以上又はBMIが35以上)における食事療法及び運動療法の補助
5. 効能または効果に関連する注意
5.1 肥満症治療の基本である食事療法及び運動療法をあらかじめ適用し、その効果が不十分な高度肥満症患者にのみ、本剤の使用を考慮すること。
5.2 本剤は肥満度が+70%以上又はBMIが35以上の高度肥満症であることを確認した上で適用を考慮すること。
肥満度(%)=(実体重−標準体重)/標準体重×100
BMI(Body Mass Index)=体重(kg)/身長(m)2
5.3 内分泌性肥満、遺伝性肥満、視床下部性肥満等の症候性(二次性)肥満患者においては、原疾患の治療を優先させること。
6. 用法及び用量
本剤は肥満度が+70%以上又はBMIが35以上の高度肥満症患者に対して、食事療法及び運動療法の補助療法として用いる。
通常、成人には、マジンドールとして0.5mg(1錠)を1日1回昼食前に経口投与する。1日最高投与量はマジンドールとして1.5mg(3錠)までとし、2〜3回に分けて食前に経口投与するが、できる限り最小有効量を用いること。
投与期間はできる限り短期間とし、3ヵ月を限度とする。なお、1ヵ月以内に効果のみられない場合は投与を中止すること。
7. 用法及び用量に関連する注意
7.1 本剤投与中に肺高血圧症があらわれたとの報告があり、また、海外で、食欲抑制剤の長期投与により肺高血圧症の発症の危険性が増加するとの報告があるので、本剤を3ヵ月を超えて投与しないこと。[11.1.2参照]
7.2 本剤は、睡眠障害を引き起こすことがあるので夕刻の投与は避けること。
8. 重要な基本的注意
8.1 急激な減量による心血管系の合併症のリスクを避けるため本剤投与中は体重の推移に注意すること。
8.2 食事量、体重の推移、食生活等に留意の上、常に投与継続の可否、投与量について注意すること。
8.3 本剤投与中の患者には、自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 糖尿病の患者
インスリン、経口糖尿病剤の必要量が変化することがある。[10.2参照]
9.1.2 精神病の既往歴のある患者
症状が悪化するおそれがある。
9.1.3 てんかん又はその既往歴のある患者
本剤の副作用で痙攣が報告されており、発作を誘発するおそれがある。
9.1.4 開放隅角緑内障の患者
眼圧が上昇するおそれがある。
9.2 腎機能障害患者
9.2.1 重症の腎障害のある患者
投与しないこと。排泄が遅延するおそれがある。[2.5参照]
9.3 肝機能障害患者
9.3.1 重症の肝障害のある患者
投与しないこと。代謝又は排泄が遅延するおそれがある。[2.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(ラット)で母獣に毒性のあらわれる大量投与により胎児毒性(体重増加の抑制、出生率の低下等)が報告されている。[2.11参照]
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
投与しないこと。小児等を対象とした臨床試験は実施していない。[2.12参照]
9.8 高齢者
市販後調査で収集した安全性解析対象症例において、高齢者における副作用発現症例率は、65歳未満の症例に比べて高い傾向が認められている。
10. 相互作用
10.1 併用禁忌
| MAO阻害剤 セレギリン塩酸塩 (エフピー) ラサギリンメシル酸塩 (アジレクト) サフィナミドメシル酸塩 (エクフィナ) [2.10参照] | 高血圧クリーゼを起こすことがあるので、MAO阻害剤投与中又はMAO阻害剤投与中止後2週間は、本剤を投与しないこと。 | 本剤は、交感神経刺激作用を有し、MAO阻害剤の作用を増強すると考えられる。 |
10.2 併用注意
| 昇圧アミン アドレナリン ノルアドレナリン等 | 昇圧アミンの作用を増強することがあるので、観察を十分に行うこと。 | 本剤は神経終末におけるカテコラミンの再吸収を抑制するため、昇圧アミンの作用を増強する。 |
| グアネチジン系薬剤 グアネチジン ベタニジン ラウオルフィア製剤 レセルピン等 クロニジン メチルドパ | 降圧効果を減弱することがある。 | 本剤は、交感神経刺激作用を有するため、グアネチジン系薬剤、ラウオルフィア製剤、クロニジン、メチルドパの交感神経遮断作用に拮抗する。 |
| インスリン 経口糖尿病剤 [9.1.1参照] | インスリン、経口糖尿病剤の必要量が変化することがある。 | インスリン分泌抑制作用が認められること、また肥満の改善により、インスリン、経口糖尿病剤の必要量が変化するため。 |
| アルコール(飲酒) | めまい、眠気等の副作用が増強されるおそれがある。 | 併用により、中枢神経系の刺激が増強されるため。 |
| ハロゲン系吸入麻酔剤 ハロタン等 | 不整脈等を引き起こすおそれがある。 | 本剤の交感神経刺激の効果により、ハロゲン系吸入麻酔剤の心筋の感受性を高めるため。 |
| 中枢神経刺激剤 アマンタジン等 | 幻覚、睡眠障害等の副作用が増強されるおそれがあるので、用量に注意すること。 | いずれも中枢神経刺激作用を有するため。 |
| 甲状腺ホルモン | 本剤の中枢神経刺激作用を増強するおそれがある。 | 甲状腺ホルモンが、カテコラミンのレセプターの感受性を増大すると考えられているため。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 依存性(頻度不明)
本剤の主要な薬理学的特性はアンフェタミン類と類似しており、サルでの静脈内薬物自己摂取試験においては摂取頻度の増加がみられ、精神依存の形成が認められている。
イヌでの22ヵ月間経口投与による慢性毒性試験においては幻覚様異常行動がみられている。
この点に関し、ヒトにおける長期投与による依存性・精神症状の発現は明確ではないが、本剤を投与する際は、依存性について留意すること。アンフェタミンをはじめとする中枢興奮剤は耐性及び精神依存を形成することが知られている。[1.1参照]
イヌでの22ヵ月間経口投与による慢性毒性試験においては幻覚様異常行動がみられている。
この点に関し、ヒトにおける長期投与による依存性・精神症状の発現は明確ではないが、本剤を投与する際は、依存性について留意すること。アンフェタミンをはじめとする中枢興奮剤は耐性及び精神依存を形成することが知られている。[1.1参照]
11.1.2 肺高血圧症(頻度不明)
労作性呼吸困難、胸痛、失神等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。[7.1参照]
11.2 その他の副作用
| 5%以上注) | 0.1%〜5%未満注) | 0.1%未満注) | 頻度不明 | |
| 精神神経系 | 口渇感 | 睡眠障害、頭痛、脱力感、めまい、けん怠感、いらいら感、眠気、ふらつき | − | 神経過敏、激越、抑うつ、精神障害、振戦、幻覚、知覚異常、不安、痙攣 |
| 消化器 | 便秘 | 悪心・嘔吐、胃部不快感、腹部膨満感、腹痛、下痢 | − | − |
| 循環器 | − | 動悸 | − | 頻脈、胸痛、血圧上昇、脳卒中、狭心症、心筋梗塞、不整脈、心不全、心停止、顔面潮紅 |
| 過敏症 | − | 発疹 | − | そう痒感 |
| 肝臓 | − | AST、ALTの上昇 | − | − |
| 泌尿器 | − | 排尿困難 | 頻尿 | − |
| その他 | − | 口中苦味感、発汗、性欲減退、脱毛、さむけ | 咽頭不快感、月経異常 | − |
13. 過量投与
13.1 症状
悪心、嘔吐、頭痛、頻脈、不整脈、呼吸困難、排尿障害、興奮、痙攣発作、昏睡
13.2 処置
興奮及び痙攣発作が認められる場合には、短時間作用型バルビツール酸誘導体又はベンゾジアゼピン系薬剤を投与する。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
健康成人にマジンドール2mgを1回経口投与注)し、マジンドール未変化体の血漿中濃度を検討した。最高血漿中濃度は投与2時間後に得られ、その値は約2.81ng/mLであった。また、血漿中半減期は約9時間であった。
健康成人にマジンドール2mgを経口投与注)後の平均血漿中濃度の推移(n=12、mean±S.E.)
16.5 排泄
健康成人にマジンドール2mgを1回経口投与注)し、マジンドール未変化体の尿中排泄量を検討した。尿中排泄は投与後72時間でほぼ終了し、未変化体の総排泄量は投与量の約4.5%であった。
注)本剤の用法及び用量は、通常、1日1回0.5mgで、1日最高投与量は1.5mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
18.2 摂食行動に対する作用
18.3 消化吸収に対する作用
18.4 グルコース利用促進
骨格筋等へのグルコースの取り込み促進が認められ、組織におけるグルコース利用の増加が示唆されている(ラット)20)。
18.5 熱産生促進
18.6 肥満時の代謝変動に対する作用
19. 有効成分に関する理化学的知見
19.1. マジンドール
22. 包装
100錠[10錠(PTP)×10]
23. 主要文献
- 熊原雄一ほか, 臨床評価, 13 (2), 419-459, (1985)
- 熊原雄一ほか, 臨床評価, 13 (2), 461-515, (1985)
- 鬼原 彰, 医学と薬学, 13 (3), 607-615, (1985)
- 阿部祐五ほか, 臨牀と研究, 62 (8), 2709-2716, (1985)
- 井上修二, 医学と薬学, 13 (4), 837-845, (1985)
- 谷口 中ほか, 医学と薬学, 13 (5), 1209-1213, (1985)
- 藤岡滋典ほか, 基礎と臨床, 19 (9), 4767-4773, (1985)
- 生山祥一郎ほか, Prog.Med., 5 (4), 1242-1252, (1985)
- Minami,T.et al., Brain Res.Bull., 15 (1), 29-31, (1985) »PubMed
- Sikdar,S.K.et al., Brain Res.Bull., 15 (1), 33-38, (1985) »PubMed
- Engstrom,R.G,et al., Arch.Int.Pharmacodyn., 214 (2), 308-321, (1975) »PubMed
- Heikkila,R.E., Life Sci., 28 (17), 1867-1873, (1981) »PubMed
- Shimizu,N.et al., Physiol.Behav., 49 (1), 131-134, (1991) »PubMed
- 永井克也ほか, 日薬理誌, 83 (2), 133-145, (1984) »PubMed
- 藤本一眞ほか, 日薬理誌, 83 (5), 425-432, (1984) »PubMed
- 井上修二ほか, 日薬理誌, 83 (5), 441-449, (1984) »PubMed
- 宇佐美勝ほか, 日薬理誌, 85 (4), 297-303, (1985) »PubMed
- 白石武昌, 日薬理誌, 83 (2), 159-172, (1984) »PubMed
- 大南宏治ほか, 日薬理誌, 83 (2), 123-132, (1984) »PubMed
- Nagai,K.et al., Eur.J.Pharmacol., 260 (1), 29-37, (1994) »PubMed
- Wyllie,M.G.et al., Int.J.Obes., 8 (Suppl.1), 85-92, (1984)
- 吉田俊秀ほか, 第15回日本肥満学会記録, 111-113, (1994)
24. 文献請求先及び問い合わせ先
文献請求先
富士フイルム富山化学株式会社
製品情報センター
〒104-0031
東京都中央区京橋2-14-1 兼松ビル
電話:0120-502-620
製品情報問い合わせ先
富士フイルム富山化学株式会社
製品情報センター
〒104-0031
東京都中央区京橋2-14-1 兼松ビル
電話:0120-502-620
25. 保険給付上の注意
本剤は厚生労働省告示第97号(平成20年3月19日付)に基づき、投薬期間は1回14日間分を限度とされている。
26. 製造販売業者等
26.1 製造販売元
富士フイルム富山化学株式会社
〒104-0031
東京都中央区京橋2-14-1 兼松ビル