医薬品情報
| 総称名 | オペプリム |
|---|---|
| 一般名 | ミトタン |
| 欧文一般名 | mitotane |
| 製剤名 | ミトタンカプセル |
| 薬効分類名 | 副腎癌化学療法剤 副腎皮質ホルモン合成阻害剤 |
| 薬効分類番号 | 2499 |
| ATCコード | L01XX23 |
| KEGG DRUG |
D00420
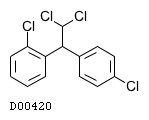
ミトタン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年5月 改訂(第5版)

|
1.警告 2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オペプリム | Opeprim | ヤクルト本社 | 2499006M1026 | 709.3円/カプセル | 劇薬, 処方箋医薬品注) |
1. 警告
ショック時や重篤な外傷を受けた時には、一時的に投与を中止すること。[2.1参照]
2. 禁忌
次の患者には投与しないこと
2.1 重篤な外傷のある患者[副腎抑制を起こすおそれがある。][1.参照]
2.2 スピロノラクトン、ペントバルビタール、ドラビリン、エンシトレルビルフマル酸、レナカパビルを投与中の患者[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
<手術適応とならないクッシング症候群>
下垂体性ACTH過剰分泌によるクッシング症候群(クッシング病)の患者には、下垂体腺腫摘出及び下垂体放射線照射等の方法も考慮すること。
6. 用法及び用量
通常成人1回1カプセル〜2カプセル1日3回経口投与から開始し、有効量まで漸増し、以後、症状、血中・尿中ステロイド濃度、副作用等により適宜増減する。
8. 重要な基本的注意
8.1 投与量が確定するまで治療は入院中に開始すること。
8.3 眩暈、嗜眠等があらわれることがあるので、自動車の運転等危険を伴う機械を操作する際には十分に注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 本剤の成分に対し過敏症の既往歴のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。
9.1.2 無月経の症状を呈している患者
本剤の作用により月経が再開することがある。[9.4参照]
9.3 肝機能障害患者
9.3.1 副腎皮質からの転移腫瘍以外の肝疾患のある患者
代謝が妨げられて蓄積するおそれがある。[11.1.7参照]
9.4 生殖能を有する者
妊娠する可能性のある女性には、本剤投与中及び投与終了後十分な期間適切な避妊をするよう指導すること。[9.1.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。生殖発生毒性試験は実施していない。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。小児において、5〜6ヵ月後に中枢神経症状が発現し、急激な血漿中濃度の上昇を来していたとの報告がある1)。
9.8 高齢者
減量するなど注意すること。一般に高齢者では生理機能が低下している。
10. 相互作用
10.1 併用禁忌
10.2 併用注意
| エプレレノン エサキセレノン | 本剤の作用が阻害されるおそれがある。 | 本剤の薬効をこれらの薬剤の類薬(スピロノラクトン)が阻害するとの報告がある。 |
| トリロスタン | 副腎皮質機能抑制作用が増強するおそれがある。 | トリロスタンは副腎皮質ステロイドホルモン生合成阻害作用を有する。 |
| CYP3A4で代謝を受ける薬剤 ミダゾラム アムロジピン クラリスロマイシン等 | 併用薬剤の血中濃度が低下し、作用が減弱するおそれがある。 | 本剤は肝チトクロームP-450(CYP3A4)を誘導するため、CYP3A4で代謝を受ける薬剤の血中濃度に影響を与える可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 胃潰瘍(頻度不明)、胃腸出血(頻度不明)
11.1.2 紅皮症(頻度不明)
11.1.3 認知症(頻度不明)、妄想(頻度不明)
11.1.4 副腎不全(頻度不明)
本剤の投与により副腎不全が起こることがある。このような場合は、副腎ステロイド補充を行うこと。
11.1.5 低血糖(頻度不明)
11.1.6 腎障害(尿細管障害)(頻度不明)
11.1.7 肝機能障害(頻度不明)、黄疸(頻度不明)
AST、ALT、γ-GTP、ALPの著しい上昇等を伴う肝機能障害、黄疸があらわれることがある。[9.3.1参照]
11.2 その他の副作用
| 10%以上 | 10%未満 | 頻度不明 | |
| 消化器 | 食欲不振、嘔気、嘔吐、下痢 | 便秘、口渇 | 口内異常感、腹痛 |
| 皮膚 | 発疹 | 脱毛、そう痒 | 色素沈着、皮膚乾燥 |
| 中枢神経系 | 嗜眠 | 頭痛、眩暈 | 歩行不安定、脳波異常、言語障害、振戦、不穏、不安、健忘、神経過敏、神経症、しびれ |
| 内分泌 | 女性型乳房 | 帯下増加、性器出血、ACTH高値 | |
| 肝臓 | AST上昇、ALT上昇、ALP上昇、γ-GTP上昇 | ||
| 代謝・栄養 | 総コレステロール上昇 | 低尿酸血症、低ナトリウム血症、低カリウム血症 | |
| 血液 | 白血球減少 | 貧血、血小板増加、眼底出血 | |
| 腎臓 | 浮腫、乏尿、血漿レニン活性上昇 | ||
| 循環器 | 高血圧、動悸、QT延長 | ||
| その他 | 味覚異常、関節痛、筋肉痛 | 全身倦怠感、耳鳴、腰痛、発熱、のぼせ、脱力感 |
13. 過量投与
16. 薬物動態
16.1 血中濃度
16.3 分布
主に脂肪組織内に蓄積され、次いで副腎に多く蓄積される8)(外国人データ)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内一般臨床試験
本剤投与が必要とされた全国35施設46例における臨床成績は以下のとおりであった9)。効果は、ステロイドに対する効果、抗腫瘍効果、有用性の3つに分けて評価した。
46例中31例(約67%)でステロイド減少効果が認められた。腫瘍の大きさが測定された副腎癌18例中7例(38.9%)で抗腫瘍効果が認められた。
46例中36例(78.3%)で副作用が認められた。主な副作用注1)注2)は、食欲不振28/47例(59.6%)、嘔気26/47例(55.3%)、総コレステロール上昇19/39例(48.7%)、γ-GTP上昇6/27例(22.2%)、嗜眠8/47例(17.0%)、発疹8/47例(17.0%)、ALP上昇7/42例(16.7%)、AST上昇7/45例(15.6%)、ALT上昇7/45例(15.6%)、嘔吐7/47例(14.9%)、下痢7/47例(14.9%)、LAP上昇3/25例(12.0%)であった。
各担当医師による「++、+、−」の3段階の判定では、下表のとおり47例中31例(約66%)で有用性が認められた。
46例中31例(約67%)でステロイド減少効果が認められた。腫瘍の大きさが測定された副腎癌18例中7例(38.9%)で抗腫瘍効果が認められた。
46例中36例(78.3%)で副作用が認められた。主な副作用注1)注2)は、食欲不振28/47例(59.6%)、嘔気26/47例(55.3%)、総コレステロール上昇19/39例(48.7%)、γ-GTP上昇6/27例(22.2%)、嗜眠8/47例(17.0%)、発疹8/47例(17.0%)、ALP上昇7/42例(16.7%)、AST上昇7/45例(15.6%)、ALT上昇7/45例(15.6%)、嘔吐7/47例(14.9%)、下痢7/47例(14.9%)、LAP上昇3/25例(12.0%)であった。
各担当医師による「++、+、−」の3段階の判定では、下表のとおり47例中31例(約66%)で有用性が認められた。
| 疾患名\ | 症例数 | 有用性 | ||||
| ++ | + | − | 不明 | |||
| クッシング症候群 | クッシング病 | 16 | 8 | 5 | 0 | 3 |
| 副腎腺腫 | 5 | 1 | 1 | 0 | 3 | |
| 副腎癌 | 16 | 2 | 4 | 3 | 7 | |
| その他注3) | 3 | 2 | 1 | 0 | 0 | |
| その他の副腎癌 | 6注1) | 2 | 5 | 0 | 0 | |
| 合計 | 46 | 15 | 16 | 3 | 13 | |
注1)1例については、2期間、2施設において研究されたので、2つのデータとして扱った。
注2)自覚的副作用については47例、臨床検査上の副作用については検査症例数に基づき発現頻度を算出した。
注3)結節性副腎異形成(疑)2例、異所性ACTH産生腫瘍1例。
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. ミトタン
22. 包装
100カプセル[瓶、バラ、乾燥剤入り]
23. 主要文献
- Goto T,et al., Clin Pediatr Endocrinol., 17, 71-74, (2008) »PubMed
- Wortsman J,et al., JAMA., 238, 2527, (1977) »PubMed
- Straw JA,et al., Proc Soc Exp Biol Med., 118, 391-394, (1965) »PubMed
- Baudin E,et al., Cancer., 92, 1385-1392, (2001) »PubMed
- 社内資料:薬力学的研究
- 社内資料:血漿中濃度と累積投与量の関係に関する資料
- Moolenaar AJ,et al., Cancer Chem Pharm., 7, 51-54, (1981)
- Moy RH, J Lab Clin Med., 58, 296-304, (1961) »PubMed
- 木野内喬 他, ホルモンと臨床, 30, 841-851, (1982) »PubMed
- Kaminsky N,et al., J Natl Cancer Inst., 29, 127-159, (1962) »PubMed
- 小島元子 他, 日本内分泌学会雑誌, 60, 852-871, (1984) »DOI
- Hart MM,et al., Steroids., 17, 559-574, (1971) »PubMed
- 小島元子 他, 日本内分泌学会雑誌, 58, 407, (1982)
- 小島元子 他, ホルモンと臨床, 29, 1499-1505, (1981)
- 長沼 廣 他, 日本内分泌学会雑誌, 58, 405, (1982)
- Touitou Y,et al., J Steroid Biochem., 9, 1217-1224, (1978) »PubMed
- Bledsoe T,et al., J Clin Endo., 24, 1303-1311, (1964)
24. 文献請求先及び問い合わせ先
文献請求先
株式会社ヤクルト本社
くすり相談窓口
〒105-8660
東京都港区海岸1-10-30
電話:0120-589601
FAX:03-6747-8027
製品情報問い合わせ先
株式会社ヤクルト本社
くすり相談窓口
〒105-8660
東京都港区海岸1-10-30
電話:0120-589601
FAX:03-6747-8027
26. 製造販売業者等
26.1 製造販売元
株式会社ヤクルト本社
東京都港区海岸1-10-30