医薬品情報
| 総称名 | メタライト |
|---|---|
| 一般名 | トリエンチン塩酸塩 |
| 欧文一般名 | trientine hydrochloride trientine |
| 製剤名 | 塩酸トリエンチン製剤 |
| 薬効分類名 | ウィルソン病(D-ペニシラミンに不耐性である場合)治療剤 |
| 薬効分類番号 | 3929 |
| ATCコード | A16AX12 |
| KEGG DRUG |
D00736
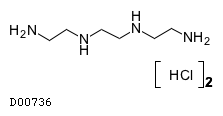
トリエンチン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第1版)

|
4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| メタライト250カプセル | METALITE 250 CAPSULES | ツムラ | 3929005M1029 | 293.3円/カプセル | 劇薬, 処方箋医薬品 |
4. 効能または効果
ウィルソン病(D-ペニシラミンに不耐性である場合)
6. 用法及び用量
通常、成人1日6カプセル(トリエンチン塩酸塩として1,500mg)を食前空腹時に2〜4回に分割経口投与する。
なお、患者の年齢、症状及び本剤に対する反応等に応じて、1日量4〜10カプセル(トリエンチン塩酸塩として1,000〜2,500mg)の範囲で増減する。
なお、患者の年齢、症状及び本剤に対する反応等に応じて、1日量4〜10カプセル(トリエンチン塩酸塩として1,000〜2,500mg)の範囲で増減する。
7. 用法及び用量に関連する注意
7.1 本剤は、食前1時間あるいは食後2時間以上の空腹時に服用し、他剤の服用あるいは食物の摂取から1時間以上の間隔をあけること。
7.2 臨床症状の効果が十分でない場合、あるいは血清中の遊離銅濃度が20μg/dLを超える状態が続く場合には、投与量を増量すること。
8. 重要な基本的注意
本剤を長期間投与する場合は、3〜12ヵ月毎に血清中の遊離銅濃度(総血清銅とセルロプラスミン銅の差)及び尿中銅排泄量の測定を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 重篤な合併症(心臓疾患、悪性腫瘍、腎疾患、糖尿病、血液障害、脳血管障害等)のある患者
使用経験が無い。
9.1.2 薬物アレルギーの患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験で催奇形性作用が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験で乳汁中に移行することが報告されている。
9.7 小児等
低出生体重児、新生児、乳児、幼児又は小児を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| 経口鉄剤 | 本剤の作用が減弱するおそれがある。経口鉄剤の投与を受けた患者に本剤を投与する場合には、2時間以上の間隔をあけることが望ましい。 | 本剤が鉄剤中の鉄と結合し、本剤と銅との結合を阻害する。 |
| 他剤・食物(軽食等) | 本剤の作用が減弱するおそれがある。 | 本剤の吸収が妨げられるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 全身性エリテマトーデス(SLE)(頻度不明)
11.1.2 間質性肺炎(頻度不明)
間質性肺炎等の肺病変が動物実験で報告されているので、発熱、咳嗽、呼吸困難等の呼吸器症状があらわれた場合には、投与を中止し、副腎皮質ホルモン剤を投与するなど適切な処置を行うこと。
頻度は承認時の臨床成績及び承認後における特別調査に基づいている。
11.2 その他の副作用
| 0.1〜5%未満 | |
| 過敏症 | 発疹 |
| 精神神経系 | 頭痛、振戦等 |
| 消化器 | 嘔気、胸やけ、胃不快感等 |
| 血液 | 白血球減少、貧血(鉄欠乏性貧血、鉄芽球性貧血等) |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 本剤の服用に際しては、カプセルを開けたり、かんだりせず、多めの水で服用するよう注意すること。
14.1.2 接触性皮膚炎を生じる可能性があるので、カプセルの内容物に曝された部位は速やかに水で洗浄すること。
16. 薬物動態
16.1 血中濃度
ウィルソン病患者に経口投与したところ、血清中のトリエンチン未変化体は投与後2〜3時間で最高濃度に達した後、半減期2.08時間で血清から消失した。また、最高濃度到達時間における血清中には、遊離型のトリエンチンは検出されなかった1)。
16.5 排泄
ウィルソン病患者に経口投与したところ、投与後24時間までの未変化体及び総代謝物の尿中排泄率は、それぞれ投与量の2.4%及び20.9%であった1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
48例を対象とした臨床試験において、46例を対象にした体内銅排泄作用確認試験では、投与前日に対する投与1〜3日目の尿中銅排泄量の増加率は平均658.5%であった。また、41例を対象にした長期投与試験では、12例は総合評価を判定不能としたが、29例では以下の結果を得た2)。
| 有用性\投与期間 | 24週以上 | 12週以上 |
| 極めて有用 | 61.9%(13/21) | 62.5%(5/8) |
| かなり有用以上 | 95.2%(20/21) | 87.5%(7/8) |
| やや有用以上 | 100.0%(21/21) | 100.0%(8/8) |
18. 薬効薬理
19. 有効成分に関する理化学的知見
19.1. トリエンチン塩酸塩
22. 包装
100カプセル(ビン)
23. 主要文献
- 小林道也ほか, TDM研究, 10 (2), 166-171, (1993)
- 有馬正高ほか, 基礎と臨床, 26 (3), 1093-1107, (1992)
- 太田裕一郎ほか:株式会社ツムラ社内資料
- Sone,H.et al., Hepatology., 23 (4), 764-770, (1996) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
株式会社ツムラ
お客様相談窓口
〒107-8521
東京都港区赤坂2-17-11
電話:0120-329-970
FAX:03-5574-6610
製品情報問い合わせ先
株式会社ツムラ
お客様相談窓口
〒107-8521
東京都港区赤坂2-17-11
電話:0120-329-970
FAX:03-5574-6610
26. 製造販売業者等
26.1 製造販売元
株式会社ツムラ
東京都港区赤坂2-17-11