医薬品情報
| 総称名 | ダイドロネル |
|---|---|
| 一般名 | エチドロン酸二ナトリウム |
| 欧文一般名 | Etidronate Disodium |
| 薬効分類名 | 骨代謝改善剤 |
| 薬効分類番号 | 3999 |
| ATCコード | M05BA01 |
| KEGG DRUG |
D00314
エチドロン酸二ナトリウム
|
| KEGG DGROUP |
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年1月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ダイドロネル錠200 | Didronel Tablets | 住友ファーマ | 3999010F1025 | 238.5円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<骨粗鬆症>
5.1 本剤の適用にあたっては、日本骨代謝学会の診断基準等を参考に骨粗鬆症と確定診断された患者を対象とすること。
<骨ページェット病>
5.2 本剤の適用にあたっては、日本骨粗鬆症学会の「骨Paget病の診断と治療ガイドライン」等を参考に骨ページェット病と確定診断された患者を対象とすること。
6. 用法及び用量
<効能共通>
本剤の吸収をよくするため、服薬前後2時間は食物の摂取を避けること。
<骨粗鬆症>
通常、成人には、エチドロン酸二ナトリウムとして200mgを1日1回、食間に経口投与する。投与期間は2週間とする。再投与までの期間は10〜12週間として、これを1クールとして周期的間歇投与を行う。
なお、重症の場合(骨塩量の減少の程度が強い患者あるいは骨粗鬆症による安静時自発痛および日常生活の運動時痛が非常に強い患者)には400mgを1日1回、食間に経口投与することができる。投与期間は2週間とする。再投与までの期間は10〜12週間として、これを1クールとして周期的間歇投与を行う。
なお、年齢、症状により適宜増減できるが、1日400mgを超えないこと。
なお、重症の場合(骨塩量の減少の程度が強い患者あるいは骨粗鬆症による安静時自発痛および日常生活の運動時痛が非常に強い患者)には400mgを1日1回、食間に経口投与することができる。投与期間は2週間とする。再投与までの期間は10〜12週間として、これを1クールとして周期的間歇投与を行う。
なお、年齢、症状により適宜増減できるが、1日400mgを超えないこと。
<下記状態における初期及び進行期の異所性骨化の抑制
脊髄損傷後、股関節形成術後>
脊髄損傷後、股関節形成術後>
通常、成人には、エチドロン酸二ナトリウムとして800〜1000mgを1日1回、食間に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
<骨ページェット病>
通常、成人には、エチドロン酸二ナトリウムとして200mgを1日1回、食間に経口投与する。
なお、年齢、症状により適宜増減できるが、1日1000mgを超えないこと。
なお、年齢、症状により適宜増減できるが、1日1000mgを超えないこと。
7. 用法及び用量に関連する注意
<骨粗鬆症>
7.1 本剤は骨の代謝回転を抑制し、骨形成の過程で類骨の石灰化遅延を起こすことがある。この作用は投与量と投与期間に依存しているので、用法(周期的間歇投与:2週間投与・10〜12週間休薬)及び用量を遵守するとともに、患者に用法・用量を遵守するよう指導すること。
7.2 400mg投与にあたっては以下の点を十分考慮すること。
・骨塩量の減少の程度が強い患者(例えばDXA法(QDR)で0.650g/cm2未満を目安とする)であること。
・骨粗鬆症による安静時自発痛および日常生活の運動時痛が非常に強い患者であること。
7.3 1日400mgを投与する場合は、200mg投与に比べ腹部不快感等の消化器系副作用があらわれやすいので、慎重に投与すること。
<下記状態における初期及び進行期の異所性骨化の抑制
脊髄損傷後、股関節形成術後>
脊髄損傷後、股関節形成術後>
7.4 通常用量(800〜1000mg/日:15〜20mg/kg相当)の場合、投与期間は3ヵ月を超えないこと。
<骨ページェット病>
7.5 本剤は骨の代謝回転を抑制し、骨形成の過程で類骨の石灰化遅延を起こすことがある。この作用は、投与量と投与期間に依存しているので、次のことを守ること。
・通常用量(200mg/日:2.5〜5mg/kg相当)の場合、投与期間は6ヵ月を超えないこと。
・また200mg/日の投与量を超える場合、投与期間は3ヵ月を超えないこと。
7.6 再治療は少なくとも3ヵ月の休薬期間をおき、生化学所見、症状あるいはその他の所見で、症状の進行が明らかな場合にのみ行うこと。
8. 重要な基本的注意
<効能共通>
8.1 ビスホスホネート系薬剤による治療を受けている患者において、顎骨壊死・顎骨骨髄炎があらわれることがある。報告された症例の多くが抜歯等の顎骨に対する侵襲的な歯科処置や局所感染に関連して発現している。リスク因子としては、悪性腫瘍、化学療法、血管新生阻害薬、コルチコステロイド治療、放射線療法、口腔の不衛生、歯科処置の既往等が知られている。
本剤の投与開始前は口腔内の管理状態を確認し、必要に応じて、患者に対し適切な歯科検査を受け、侵襲的な歯科処置をできる限り済ませておくよう指導すること。本剤投与中に侵襲的な歯科処置が必要になった場合には本剤の休薬等を考慮すること。
また、口腔内を清潔に保つこと、定期的な歯科検査を受けること、歯科受診時に本剤の使用を歯科医師に告知して侵襲的な歯科処置はできる限り避けることなどを患者に十分説明し、異常が認められた場合には、直ちに歯科・口腔外科を受診するように指導すること。[11.1.4参照]
本剤の投与開始前は口腔内の管理状態を確認し、必要に応じて、患者に対し適切な歯科検査を受け、侵襲的な歯科処置をできる限り済ませておくよう指導すること。本剤投与中に侵襲的な歯科処置が必要になった場合には本剤の休薬等を考慮すること。
また、口腔内を清潔に保つこと、定期的な歯科検査を受けること、歯科受診時に本剤の使用を歯科医師に告知して侵襲的な歯科処置はできる限り避けることなどを患者に十分説明し、異常が認められた場合には、直ちに歯科・口腔外科を受診するように指導すること。[11.1.4参照]
8.2 ビスホスホネート系薬剤を使用している患者において、外耳道骨壊死が発現したとの報告がある。これらの報告では、耳の感染や外傷に関連して発現した症例も認められることから、外耳炎、耳漏、耳痛等の症状が続く場合には、耳鼻咽喉科を受診するよう指導すること。[11.1.5参照]
8.3 ビスホスホネート系薬剤を長期使用している患者において、非外傷性又は軽微な外力による大腿骨転子下、近位大腿骨骨幹部、近位尺骨骨幹部等の非定型骨折が発現したとの報告がある。これらの報告では、完全骨折が起こる数週間から数ヵ月前に大腿部、鼠径部、前腕部等において前駆痛が認められている報告もあることから、このような症状が認められた場合には、X線検査等を行い、適切な処置を行うこと。また、両側性の骨折が生じる可能性があることから、片側で非定型骨折が起きた場合には、反対側の部位の症状等を確認し、X線検査を行うなど、慎重に観察すること。X線検査時には骨皮質の肥厚等、特徴的な画像所見がみられており、そのような場合には適切な処置を行うこと。[11.1.6参照]
<骨粗鬆症>
8.4 患者には適切な栄養状態、特にカルシウムとビタミンDの適切な摂取を保持するように指導すること。
<下記状態における初期及び進行期の異所性骨化の抑制
脊髄損傷後、股関節形成術後>
脊髄損傷後、股関節形成術後>
8.5 本剤は骨化の初期に近い程効果が期待できるので、投与に際しては、次の点を考慮すること。
・脊髄損傷の場合
異所性骨化の初期と思われる局所の炎症所見(腫脹・熱感・疼痛)を認めた時点で投与を開始することが望ましい。
・股関節形成術の場合
手術直後から投与を開始することが望ましい。
8.6 脊髄損傷患者で脊椎を骨移植で固定する術式の場合、本剤投与中に移植骨の癒合が遅延した例があるので、固定を優先する方が患者にとって望ましいと考えられる場合には、投与を避けること。
8.7 本剤を投与中に長管骨骨折が発生した場合は、化骨の癒合がみられるまで投与を中止することが望ましい。
<骨ページェット病>
8.8 本剤を投与中に長管骨骨折が発生した場合は、化骨の癒合がみられるまで投与を中止することが望ましい。
8.9 患者には適切な栄養状態、特にカルシウムとビタミンDの適切な摂取を保持するように指導すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 消化性潰瘍又はその既往歴のある患者、腸炎の患者
本剤の主な副作用は消化器系であるため、症状が悪化することがある。[11.1.1参照]
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
(1)投与しないこと。排泄が阻害されるおそれがある。[2.1参照]
(2)国内の医療情報データベースを用いた疫学調査において、骨粗鬆症の治療にビスホスホネート系薬剤を使用した腎機能障害患者のうち、特に、高度な腎機能障害患者(eGFRが30mL/min/1.73m2未満)で、腎機能が正常の患者と比較して低カルシウム血症(補正血清カルシウム値が8mg/dL未満)のリスクが増加したとの報告がある1)。
9.2.2 腎障害のある患者(重篤な腎障害のある患者を除く)
排泄が阻害されるおそれがある。
9.4 生殖能を有する者
妊娠する可能性のある女性へは、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ビスホスホネート系薬剤は骨基質に取り込まれた後に全身循環へ徐々に放出される。全身循環への放出量はビスホスホネート系薬剤の投与量・期間に相関する。ビスホスホネート系薬剤の中止から妊娠までの期間と危険性との関連は明らかではない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。ラット(SD系)における器官形成期投与試験において、高用量で胎児の骨格異常の発生が報告されている。[2.3参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
動物実験で母乳中へ移行することが報告されている。
9.7 小児等
投与しないこと。小児等を対象とした臨床試験は実施していない。小児における骨成長に影響を与える可能性があり、また、小児において10〜20mg/kg/日の長期投与により、くる病様症状があらわれたとの報告がある。[2.4参照]
9.8 高齢者
減量するなど注意すること。一般に高齢者では生理機能が低下している。
10. 相互作用
10.2 併用注意
| 食物、特に牛乳や乳製品のような高カルシウム食 | 同時(服薬前後2時間)に併用(摂取)しないこと。 | 同時に併用(摂取)すると本剤の吸収に影響を与えるおそれがある。本剤はカルシウム等と錯体を作ること、また動物実験で非絶食投与により、吸収が著しく低下することが確認されている。 |
| カルシウム、鉄、マグネシウム、アルミニウムのような金属を多く含むミネラル入りビタミン剤又は制酸剤等 | 同時(服薬前後2時間)に併用(摂取)しないこと。 | 同時に併用(摂取)すると本剤の吸収に影響を与えるおそれがある。本剤はカルシウム等と錯体を作ること、また動物実験で非絶食投与により、吸収が著しく低下することが確認されている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 消化性潰瘍(頻度不明)
異常(胃痛、嘔吐、吐血・下血等)が認められた場合には投与を中止すること。[9.1.1参照]
11.1.2 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTP、ALP、ビリルビンの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.3 汎血球減少、無顆粒球症(いずれも頻度不明)
11.1.4 顎骨壊死・顎骨骨髄炎(頻度不明)[8.1参照]
11.1.5 外耳道骨壊死(頻度不明)[8.2参照]
11.1.6 大腿骨転子下、近位大腿骨骨幹部、近位尺骨骨幹部等の非定型骨折(頻度不明)[8.3参照]
11.2 その他の副作用
| 2%以上 | 0.1〜2%未満 | 0.1%未満 | 頻度不明 | |
| 消化器 | 腹部不快感 | 下痢・軟便、嘔気、嘔吐、腹痛、食欲不振、消化不良(胃もたれ感、胸やけ等)、便秘、口内炎(舌あれ、口臭等) | 胃炎 | 口渇 |
| 過敏症 | 発疹 | そう痒 | じん麻疹、血管浮腫 | |
| 肝臓 | AST、ALT、ALP、LDH、γ-GTP、ビリルビンの上昇 | |||
| 泌尿器 | BUN、クレアチニンの上昇、頻尿、排尿困難 | |||
| 血液 | 貧血(赤血球減少、ヘモグロビン減少等)、白血球減少 | |||
| 精神神経系 | 頭痛 | めまい・ふらつき、不眠、振戦、知覚減退(しびれ) | ||
| 眼 | 眼症状(かすみ、充血等)、乳頭浮腫 | |||
| 筋・骨格系 | 骨痛 | 関節痛、筋肉痛 | ||
| その他 | 血中無機リンの上昇 | 発熱、咽喉灼熱感 | ほてり(顔面紅潮、熱感等)、倦怠感、浮腫、耳鳴、胸痛、心悸亢進(動悸)、脱毛、多汗 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
<骨粗鬆症>
15.1.1 血中無機リンの上昇がみられることがあるが、臨床上とくに有害な作用は認められず、投与中止により正常に復する。
<下記状態における初期及び進行期の異所性骨化の抑制
脊髄損傷後、股関節形成術後>
脊髄損傷後、股関節形成術後>
15.1.2 血中無機リンの上昇がみられることがあるが、臨床上とくに有害な作用は認められず、投与中止により正常に復する。
15.1.3 本剤との因果関係は明らかではないが、AST、ALT等の上昇を伴わないALPの上昇があらわれることがある。
<骨ページェット病>
15.1.4 血中無機リンの上昇がみられることがあるが、臨床上とくに有害な作用は認められず、投与中止により正常に復する。正常上限を超える高値の場合は、本剤の過剰投与の可能性があるので注意すること。
15.1.5 大量投与又は長期間投与により骨痛、骨折の発生率が増加したとの報告がある。
15.2 非臨床試験に基づく情報
動物実験(イヌ)において、高用量を長期間投与したとき、類骨の石灰化遅延に随伴した骨髄の異常が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人6例に1200mg(20mg/kg)を1回経口投与した場合注)、最高血清中濃度は1時間後(2.2μg/mL)にみられ、その後低下し(半減期約2時間)投与後24時間では0.03μg/mLであった。
16.1.2 反復投与
健康成人6例に1200mgを1日1回、7日間連続投与した場合注)、1、3、5、7回目投与後1時間の血清中濃度は約1μg/mLで推移し、蓄積傾向は認められなかった。
16.2 吸収
健康成人に1200mg(20mg/kg)を1回経口投与した場合注)、吸収量は約6%と推定された。
16.3 分布
マウス、ラット、イヌに14C標識体を1回経口投与した場合、組織中14C濃度はマウス、ラット、イヌともに骨及び腎臓で高かった。投与後24時間には組織中濃度は低下したが、骨には高濃度の残存が認められた。また、ラットに14日間連続投与した場合、体内分布パターンは1回投与後と大差なかったが、骨中14C濃度の上昇が認められた。骨からの14C消失半減期はラットで12日であった。
16.5 排泄
健康成人に1200mg(20mg/kg)を1回経口投与した場合注)、投与後24時間までに投与量の3.1%が未変化体として尿中に排泄された。
注)本剤の1日用量は、通常、骨粗鬆症では200mg、異所性骨化の抑制では800〜1000mg、骨ページェット病では200mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<骨粗鬆症>
17.1.1 国内第III相試験
骨粗鬆症患者を対象とした二重盲検比較試験において、本剤200又は400mg/日を48週間周期的間歇投与した。脊椎圧迫骨折数、骨塩量等を指標とした有効性と安全性を総合的に判断した有用率(有用性あり以上)は、本剤200mg投与群で37.1%(49/132例)、本剤400mg投与群で42.5%(57/134例)であった。副作用発現頻度は、200mg群で6.0%(8/133例)及び400mg群で10.4%(14/135例)であった。主な副作用は胃部不快感であり、200mg群では2.3%(3/133例)、400mg群では3.7%(5/135例)に発現した2)。
17.1.2 製造販売後臨床試験(二重盲検比較試験)
骨粗鬆症患者に対し、本剤200mg/日を3年間周期的間歇投与した試験において、本剤投与群89例の骨折頻度(総椎体圧迫骨折数/総観察人・年)は0.068で、対照薬に対する優越性は検証されなかった。本剤投与群における副作用発現頻度は28.4%(27/95例)であり、主な副作用として胃不快感及び消化不良がそれぞれ4.2%(4/95例)に発現した。
17.1.3 製造販売後臨床試験
重症骨粗鬆症患者に対し、本剤400mg/日を3年間周期的間歇投与した試験において、44例の骨折頻度は0.008であった。副作用発現頻度は45.5%(25/55例)であり、主な副作用は悪心及び胃不快感がそれぞれ7.3%(4/55例)、下痢及び腹部膨満がそれぞれ5.5%(3/55例)であった。
<脊髄損傷後における初期及び進行期の異所性骨化の抑制>
17.1.4 国内第III相試験
脊髄損傷後の異所性骨化患者80例を対象としたプラセボ対照二重盲検比較試験において、本剤1000mg又はプラセボを1日1回食間に12週間投与した。本剤投与群はプラセボ投与群に比べ、炎症所見を呈した症例における異所性骨化の発生を有意に抑制し、解析対象症例における関節可動域制限を有意に改善した。本剤投与群における副作用発現頻度は7.5%(3/40例)であり、1例に軽度の胃痛が、2例に軽度の胃部不快感が発現した3)。
<股関節形成術後における初期及び進行期の異所性骨化の抑制>
17.1.5 国内一般臨床試験
複数の試験において股関節形成術後の異所性骨化患者に本剤400〜1200mg/日を1〜31週間投与した注)。X線所見、安全性等を総合的に判断した有用率は63.1%(極めて有用+かなり有用、53/84例)であった。副作用発現頻度は、13.3%(12/90例)であった。
注)異所性骨化の抑制の場合、本剤の1日用量は、通常、800〜1000mgである。
<骨ページェット病>
17.1.6 国内第II相試験
骨ページェット病患者に本剤1.6〜16.0mg/kgを1日1回食間に12〜99週間投与した注)。生化学的パラメータ、骨シンチグラフィー等を指標とした全般改善度は74.2%(著明改善+中等度改善、23/31例)であった。副作用発現頻度は15.6%(5/32例)であり、軽度の下痢が3例に、軟便及び胃部不快感がそれぞれ1例に発現した。
注)骨ページェット病の場合、本剤の1日用量は、200〜1000mgである。
18. 薬効薬理
18.1 作用機序
18.2 骨代謝回転改善作用
<効能共通>
ラットにおいて45Caの動態、ハイドロキシプロリンの尿中排泄等を指標として骨代謝回転を検討した結果、低用量(4mg/kg)では骨吸収を抑制し、高用量(40mg/kg)では骨吸収の抑制と骨石灰化を抑制することが確認されている5)。
18.3 骨吸収抑制作用
<骨粗鬆症、骨ページェット病>
18.4 骨粗鬆症モデルでの作用
<骨粗鬆症>
18.5 骨梁の連続性に対する作用
18.6 ハイドロキシアパタイトに対する作用
18.7 組織石灰化抑制作用
19. 有効成分に関する理化学的知見
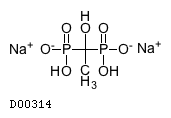
19.1. エチドロン酸二ナトリウム
22. 包装
70錠[14錠(PTP)×5]
23. 主要文献
- MID-NETを用いた調査結果の概要(MID-NETを用いたビスホスホネート製剤の腎機能障害患者における低カルシウム血症のリスク評価に関するデータベース調査), (https://www.pmda.go.jp/files/000249186.pdf)
- 藤田拓男ほか, 臨床評価, 21, 261-302, (1993)
- 小野啓郎ほか, 臨床評価, 16, 581-615, (1988)
- Jung A.,et al., Calc.Tiss.Res., 11, 269-280, (1973) »PubMed
- Gasser A.B.,et al., Clin.Sci., 43, 31-45, (1972) »PubMed
- Carano A.,et al., J.Clin.Invest., 85, 456-461, (1990) »PubMed
- Katsumata T.,et al., J.Bone Miner.Res., 10, 921-931, (1995) »PubMed
- 勝又 隆ほか, 骨粗鬆症研究の進歩, 6, 74-76, (1991)
- Boyce R.W.,et al., Bone., 16, 209-213, (1995) »PubMed
- Robertson W.G., Calc.Tiss.Res., 11, 311-322, (1973) »PubMed
- Strates,B.S.,et al., Biochim.Biophys.Acta., 244, 121-124, (1971) »PubMed
- Francis,M.D.,et al., Calc.Tiss.Res., 9, 109-121, (1972) »PubMed
- Francis,M.D.,et al., Science., 165, 1264-1266, (1969) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
製品情報問い合わせ先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
26. 製造販売業者等
26.1 製造販売元
住友ファーマ株式会社
大阪市中央区道修町2-6-8