医薬品情報
| 総称名 | フィルデシン |
|---|---|
| 一般名 | ビンデシン硫酸塩 |
| 欧文一般名 | Vindesine Sulfate |
| 製剤名 | 注射用ビンデシン硫酸塩 |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 薬効分類番号 | 4240 |
| ATCコード | L01CA03 |
| KEGG DRUG |
D01769
ビンデシン硫酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年4月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| 注射用フィルデシン1mg | FILDESIN for Injection | 日医工 | 4240402D1021 | 3758円/瓶 | 劇薬, 処方箋医薬品注) |
| 注射用フィルデシン3mg | FILDESIN for Injection | 日医工 | 4240402D2028 | 10928円/瓶 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し重篤な過敏症の既往歴のある患者
2.2 髄腔内[14.2.2参照]
4. 効能または効果
6. 用法及び用量
<急性白血病、悪性リンパ腫>
ビンデシン硫酸塩として、通常成人1回3mg(0.06mg/kg)、小児1回0.07〜0.1mg/kgを1週間間隔で静脈内に注射する。
なお、年齢、症状により、適宜増減する。
なお、年齢、症状により、適宜増減する。
<肺癌、食道癌>
ビンデシン硫酸塩として、通常成人1回3〜4.5mg(0.06〜0.09mg/kg)を1週間間隔で静脈内に注射する。
なお、年齢、症状により、適宜増減する。
なお、年齢、症状により、適宜増減する。
8. 重要な基本的注意
8.1 骨髄抑制、末梢神経障害等の重篤な副作用が起こることがあるので、頻回に臨床検査(血液検査、肝機能・腎機能検査等)を行うなど、患者の状態を十分に観察すること。また、使用が長期間にわたると副作用が強くあらわれ、遷延性に推移することがあるので、投与は慎重に行うこと。[9.1.1、9.1.3、11.1.1、11.1.7参照]
8.2 感染症・出血傾向の発現又は増悪に十分注意すること。[9.1.2参照]
8.3 本剤は血液脳関門を十分に通過しないと考えられるので、白血病性中枢神経障害の合併が認められる症例に使用する場合には、他の療法を併用するなど適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄抑制のある患者
9.1.2 感染症を合併している患者
骨髄抑制作用により、感染症が増悪するおそれがある。[8.2参照]
9.1.3 神経・筋疾患の既往歴のある患者
9.1.4 虚血性心疾患のある患者
心筋虚血症状が強くあらわれることがある。[11.1.5参照]
9.1.5 水痘患者
致命的な全身障害があらわれることがある。
9.2 腎機能障害患者
腎障害が増悪するおそれがある。
9.3 肝機能障害患者
本剤の排泄が遅延し、血中濃度の上昇に伴い、副作用発現の可能性が高くなる。
9.4 生殖能を有する者
小児及び生殖可能な年齢の患者に投与する場合には、性腺に対する影響を考慮すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。動物試験(ラット)で催奇形作用が報告されている。
9.6 授乳婦
授乳しないことが望ましい。動物試験(ラット)で乳汁中への移行が報告されている。[16.3.3参照]
9.7 小児等
小児等に投与する場合には、副作用の発現に特に注意すること。
9.8 高齢者
用量並びに投与間隔に留意すること。生理機能が低下していることが多く、副作用があらわれやすい。
10. 相互作用
10.2 併用注意
| 他の抗悪性腫瘍剤 | 骨髄抑制等の副作用が増強することがある。 | 共に骨髄抑制作用を有する。 |
| 他の抗悪性腫瘍剤 | 心筋梗塞、脳梗塞等が発現したとの報告がある。 | 機序は不明 |
| 放射線照射 | 骨髄抑制等の副作用が増強することがある。 | 共に骨髄抑制作用を有する。 |
| マイトマイシンC [11.2参照] | 息切れ及び気管支痙攣が発現しやすいとの報告がある1)。 | 機序は不明 |
| アゾール系抗真菌剤 イトラコナゾール 等 | 本剤の筋神経系の副作用が増強するとの報告がある。 | 本剤の代謝は肝代謝酵素CYP3Aが関与しているとの報告がある。アゾール系抗真菌剤は肝代謝酵素CYP3Aを阻害するため、併用により本剤の代謝を抑制する可能性がある。 |
| フェニトイン | フェニトインの血中濃度が低下し、痙攣が増悪するとの報告があるので、フェニトインの投与量を調節することが望ましい。 | 機序は不明 類薬のビンブラスチンでは、フェニトインの吸収の減少又は代謝が亢進するとの報告がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制
11.1.2 抗利尿ホルモン不適合分泌症候群(SIADH)(0.1%)
低ナトリウム血症、低浸透圧血症、尿中ナトリウム排泄量の増加、高張尿、意識障害等を伴う抗利尿ホルモン不適合分泌症候群(SIADH)があらわれることがある。このような症状があらわれた場合には水分摂取の制限等適切な処置を行うこと。
11.1.3 麻痺性イレウス(頻度不明)、消化管出血(0.1%)
腸管麻痺(食欲不振、悪心・嘔吐、著しい便秘、腹痛、腹部の膨満あるいは弛緩及び腸内容物のうっ滞等の症状)を来し、麻痺性イレウスに移行することがある。腸管麻痺があらわれた場合には投与を中止し、腸管減圧法等の適切な処置を行うこと。また、消化管出血があらわれることがある。
11.1.4 間質性肺炎(0.1%)
11.1.5 心筋虚血(頻度不明)
心筋梗塞、狭心症があらわれることがある。[9.1.4参照]
11.1.6 脳梗塞(頻度不明)
11.1.7 神経麻痺(頻度不明)、痙攣(0.1%)、聴覚異常(0.1%)、筋力低下(起立障害、歩行障害、階段昇降障害、手指連動障害等)(頻度不明)、知覚異常(14.7%)、末梢神経障害(4.3%)[8.1、9.1.3参照]
11.1.8 アナフィラキシー(頻度不明)
蕁麻疹、呼吸困難、血管浮腫等があらわれることがある。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 消化器 | 食欲不振(13.9%)、悪心・嘔吐(11.2%) | 腹痛、下痢、味覚低下 | 味覚異常等 | 口内炎、便秘 |
| 肝臓 | AST上昇(14.7%)、ALT上昇(23.9%)、Al-P上昇(13.3%)等 | 黄疸 | ||
| 腎臓 | 蛋白尿 | BUN上昇、クレアチニン上昇等 | ||
| 過敏症 | 発疹等 | |||
| 皮膚 | 脱毛(25.6%)等 | |||
| 精神神経系 | 倦怠感、脱力感、複視、眩暈、抑うつ、振戦、失神、頭痛等 | |||
| 神経・筋症状 | しびれ感(13.0%) | 深部腱反射減弱、疼痛、筋痛、顎痛、排尿障害、尿閉等 | 知覚低下 | |
| 呼吸器注) | 息切れ、気管支痙攣 | |||
| 循環器 | 狭心症発作様の症状(胸部痛、息切れ、発汗亢進)、不整脈、心電図異常等 | |||
| その他 | 悪寒、発熱、静脈炎等 |
13. 過量投与
13.1 症状
重篤あるいは致死的な結果をもたらすとの報告がある2)。
13.2 処置
支持療法として次の処置を考慮する。
・SIADH(抗利尿ホルモン不適合分泌症候群)の予防(水分摂取の制限及びヘンレ係蹄及び遠位尿細管の機能に作用する利尿剤の投与)
・抗痙攣剤の投与
・イレウスを予防するための浣腸及び下剤の使用(症例によっては腸管減圧を行う)
・循環器機能のモニタリング
・末梢血液検査を毎日行い、必要であれば輸血を行う。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 保存剤を含有していないため、注射液調製後は数時間以内に使用すること。
14.1.2 眼には接触させないこと。眼に入った場合は、直ちに水で洗浄すること。眼に入った場合、激しい刺激や角膜潰瘍が起こることがある。
14.2 薬剤投与時の注意
15. その他の注意
15.1 臨床使用に基づく情報
本剤と他の抗悪性腫瘍剤や放射線療法を併用した患者に、二次性悪性腫瘍(急性白血病、骨髄異形成症候群(MDS)等)が発生したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
16.3 分布
16.3.1 ラットにビンデシン硫酸塩を静脈内投与後、急速に広範囲の組織に分布し、腎臓、肺臓、肝臓、副腎等多くの組織で血漿中よりはるかに高い濃度を示した。中枢神経への移行はわずかであった。組織からの消失は全般に緩徐であり、胸腺、精巣、脾臓、骨髄等では特に緩慢であった6)。
16.3.2 ラットにおける妊娠13日目の胎児及び羊水の濃度はそれぞれ母体血漿中濃度の3〜4%と極めて低かった6)。
16.4 代謝
16.4.1 本剤の代謝に肝代謝酵素CYP3Aが関与することが報告されている8)(in vitro)。
16.4.2 ラットの血漿、胆汁、尿、肝臓及び肺臓について、薄層クロマトグラフ法により検索したが、未変化体のほかに明らかなスポットを認めず、ビンデシン硫酸塩の大部分は未変化体として分布、排泄されるものと考えられる7)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
承認時における各科領域の臨床試験での有効性評価対象例は791例であり、腫瘍別奏効率は下表のとおりであった10)11)。
| 腫瘍名 | 単独投与例 | 併用投与例 | |||
| 寛解例数又は奏効例数/有効性評価対象例数 | 奏効率(%) | 寛解例数又は奏効例数/有効性評価対象例数 | 奏効率(%) | ||
| 急性白血病 | 急性リンパ性白血病 | 14/37 | 37.8 | 91/128 | 71.1 |
| 急性非リンパ性白血病 | 0/6 | − | 49/80 | 61.3 | |
| 慢性骨髄性白血病急性転化 | 5/17 | 29.4 | 33/59 | 55.9 | |
| 悪性リンパ腫 | ホジキン病 | 5/9 | − | 34/41 | 82.9 |
| 非ホジキンリンパ腫 | 19/40 | 47.5 | 108/150 | 72.0 | |
| その他 | 0/1 | − | 3/7 | − | |
| 肺癌 | 小細胞癌 | 3/21 | 14.3 | 8/16 | 50.0 |
| 扁平上皮癌 | 3/20 | 15.0 | 3/12 | 25.0 | |
| 腺癌 | 8/52 | 15.4 | 6/39 | 15.4 | |
| 大細胞癌 | 1/9 | − | 0/7 | − | |
| その他 | 0/2 | − | 0/1 | − | |
| 食道癌 | 6/37 | 16.2 | − | − | |
18. 薬効薬理
18.1 作用機序
細胞毒性発現に関する作用機序の詳細はまだ明らかではないが、微小管あるいはその構成蛋白であるチュブリンに関連したものであると考えられている。
18.2 抗腫瘍作用
18.2.1 実験腫瘍に対する効果(マウス)
P388白血病、ヒト由来T-ALL、B-ALL等に対してすぐれた抗腫瘍作用を示した。
18.2.2 細胞学的効果
細胞の有糸分裂の中期に作用して細胞分裂を中期停止させ、細胞周期のG2+M期に細胞を蓄積させた(in vitro)。
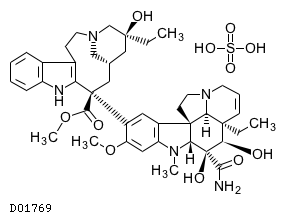
19. 有効成分に関する理化学的知見
19.1. ビンデシン硫酸塩
22. 包装
<注射用フィルデシン1mg>
1バイアル
<注射用フィルデシン3mg>
1バイアル
23. 主要文献
- Luedke D.,et al., Cancer., 55 (3), 542-545, (1985) »PubMed
- Fiorentino M.V.,et al., Cancer Treat.Rep., 66 (5), 1247-1248, (1982) »PubMed
- Robbins G.,et al., Br.Med.J., 291, 1094, (1985)
- 社内資料:血漿中Vindesine濃度のRadioimmunoassay, (1983)
- 社内資料:悪性腫瘍患者における薬動力学的検討, (1983)
- 社内資料:ラットにおける分布,排泄及び代謝, (1983)
- 社内資料:ラットの妊娠母獣組織内及び胎仔における分布、乳汁移行並びに代謝, (1984)
- Zhou X.J.,et al., Biochem.Pharmacol., 45 (4), 853-861, (1993) »PubMed
- Owellen R.J.,et al., Cancer Res., 37, 2603-2607, (1977) »PubMed
- 木村禧代二 他, 癌と化学療法, 10 (12), 2509-2515 ほか, (1983) »PubMed
- Iizuka T.,et al., Jpn.J.Clin.Oncol., 19 (4), 380-383, (1989)
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工株式会社
富山市総曲輪1丁目6番21