医薬品情報
| 総称名 | ナゼア |
|---|---|
| 一般名 | ラモセトロン塩酸塩 |
| 欧文一般名 | Ramosetron Hydrochloride |
| 製剤名 | ラモセトロン塩酸塩口腔内崩壊錠 |
| 薬効分類名 | 5-HT3受容体拮抗型制吐剤 |
| 薬効分類番号 | 2391 |
| KEGG DRUG |
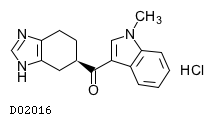
D02016
ラモセトロン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2020年12月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ナゼアOD錠0.1mg | Nasea OD Tablets 0.1mg | LTLファーマ | 2391004F1024 | 640.5円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
抗悪性腫瘍剤(シスプラチン等)投与に伴う消化器症状(悪心、嘔吐)
5. 効能または効果に関連する注意
5.1 本剤は強い悪心、嘔吐が生じる抗悪性腫瘍剤(シスプラチン等)の投与の場合に限り使用すること。
5.2 主として、本剤は強い悪心、嘔吐が生じる抗悪性腫瘍剤(シスプラチン等)を投与する際に、その悪心、嘔吐を未然に防ぐために使用し、注射剤は悪心、嘔吐が発現している患者への制吐療法として使用すること。
5.3 抗悪性腫瘍剤投与後、本剤の効果が不十分で悪心、嘔吐が発現した場合には、他の制吐療法(注射剤の投与等)を考慮すること。
6. 用法及び用量
通常、成人にはラモセトロン塩酸塩として0.1mgを1日1回経口投与する。なお、年齢、症状により適宜増減する。
7. 用法及び用量に関連する注意
7.1 本剤は、抗悪性腫瘍剤の投与1時間前に投与する。
7.2 癌化学療法の各クールにおいて、本剤の投与期間は5日間以内とする。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラットにおいて乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。副作用が発現した場合には、投与を中止するなど適切な処置を行うこと。一般に生理機能が低下している。
10. 相互作用
相互作用序文
本剤は、主として肝臓の薬物代謝酵素CYP1A2及びCYP2D6により代謝される。[16.4参照]
薬物代謝酵素用語
CYP1A2
薬物代謝酵素用語
CYP2D6
10.2 併用注意
| フルボキサミン | 本剤の血中濃度が上昇し、副作用が増強されるおそれがある。 | フルボキサミンのCYP1A2阻害作用により本剤の血中濃度が上昇する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(気分不良、胸内苦悶感、呼吸困難、喘鳴、顔面潮紅、発赤、そう痒感、チアノーゼ、血圧低下等)を起こすことがある。
11.1.2 てんかん様発作(頻度不明)
11.2 その他の副作用
| 1〜5%未満 | 0.1〜1%未満 | 0.1%未満 | |
| 過敏症 | 皮疹 | ||
| 精神神経系 | 頭痛・頭重 | 眠気 | |
| 消化器 | 便秘 | ||
| 腎臓 | BUN上昇 | ||
| 肝臓 | 肝機能異常(AST(GOT)上昇、ALT(GPT)上昇、LDH上昇、ビリルビン上昇) | ||
| その他 | 発熱 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤はPTP包装より取り出す際、縁の欠け又は傷つく可能性があるが、品質には問題はない。欠けが生じた場合は全量服薬させること。PTP包装からの取り出しは、爪を立てずに指の腹で押し出すことが望ましい。
14.1.3 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
14.2 薬剤調製時の注意
14.2.1 本剤は通常の錠剤に比べやわらかく自動分包機使用不適。
16. 薬物動態
16.1 血中濃度
健康成人に0.4〜1.6mg経口投与したときの血漿中未変化体濃度は投与後約2時間にCmaxを示し、以後半減期は約5時間であった。Cmax及びAUCは投与量に比例し、体内動態は線形性を示した1)。
健康成人に反復投与したとき、体内動態の変化はなく、蓄積性は認められなかった1)。
静脈内投与時の血漿中濃度2)をもとに有効利用率を求めたところ50%以上であった。
健康成人に反復投与したとき、体内動態の変化はなく、蓄積性は認められなかった1)。
静脈内投与時の血漿中濃度2)をもとに有効利用率を求めたところ50%以上であった。
| 投与量 | Tmax(h) | Cmax(ng/mL) | t1/2(h) | AUC(ng・h/mL) | 有効利用率(%) |
| 0.4mg | 2.17 | 1.37 | 5.52 | 11.58 | 53.0 |
| 0.8mg | 2.50 | 2.77 | 5.35 | 25.77 | 59.0 |
| 1.6mg | 2.67 | 5.63 | 4.93 | 48.05 | 55.0 |
(注)本剤の承認された1日用量は、0.1mgである。
16.4 代謝
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
シスプラチン等の抗悪性腫瘍剤投与により発現する悪心、嘔吐を対象として、シスプラチン投与の1時間前に本剤を投与する二重盲検比較試験及び一般臨床試験を国内延べ90施設、284例を対象として行った。臨床成績の概要は以下のとおりである5)6)7)8)9)。
なお、シスプラチン等の抗悪性腫瘍剤投与により発現する悪心、嘔吐を対象とした二重盲検比較試験7)において、本剤の有用性が確認されている。
なお、シスプラチン等の抗悪性腫瘍剤投与により発現する悪心、嘔吐を対象とした二重盲検比較試験7)において、本剤の有用性が確認されている。
| 投与量 | シスプラチン等の抗悪性腫瘍剤投与により発現する悪心、嘔吐に対して単回経口投与を行ったときの有効率 | シスプラチン等の抗悪性腫瘍剤投与により発現する悪心、嘔吐に対して5日間連日投与を行ったときの有効率 |
| 0.1mg | 77.9% (106/136例) | 80.0% (12/15例) |
18. 薬効薬理
18.1 作用機序
シスプラチン等の抗悪性腫瘍剤は消化管の腸クロム親和性細胞からセロトニンを遊離させる。このセロトニンが消化管粘膜内求心性迷走神経終末に存在する5-HT3受容体に結合し、その刺激が嘔吐中枢を経て嘔吐を誘発させる。ラモセトロン塩酸塩はこの5-HT3受容体を遮断することにより制吐作用を発現するものと考えられる。
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. ラモセトロン塩酸塩
20. 取扱い上の注意
20.1 開封後は湿気を避けて遮光して保存すること。
22. 包装
10錠(1錠×10)
23. 主要文献
- 中島光好 他, 臨床と研究, 72 (11), 2912, (1995)
- 中島光好 他, 臨床と研究, 71 (9), 2461, (1994)
- 社内報告書(健康成人・薬物動態)(D199603030-02.00,1996), (1996)
- 社内報告書(ヒト肝ミクロソーム・代謝)(DIR050011)
- 野田起一郎 他, 新薬と臨床, 45 (3), 482, (1996)
- 野田起一郎 他, 新薬と臨床, 45 (7), 1309, (1996)
- 野田起一郎 他, 新薬と臨床, 45 (8), 1445, (1996)
- 武谷雄二 他, 産科と婦人科, 63 (9), 1297, (1996)
- 武谷雄二 他, 産婦人科の世界, 48 (8), 749, (1996)
- Miyata,K.et al., J.Pharmacol.Exp.Ther., 259 (1), 15, (1991) »PubMed
- Miyata,K.et al., J.Pharmacol.Exp.Ther., 259 (2), 815, (1991) »PubMed
- 藤原 明 他, 薬理と臨床, 6 (7), 1209, (1996)
- 藤原 明, 薬理と臨床, 6 (7), 1215, (1996)
24. 文献請求先及び問い合わせ先
文献請求先
LTLファーマ株式会社
コールセンター
〒160-0023
東京都新宿区西新宿6丁目10番1号
電話:フリーダイヤル 0120-303-711
製品情報問い合わせ先
LTLファーマ株式会社
コールセンター
〒160-0023
東京都新宿区西新宿6丁目10番1号
電話:フリーダイヤル 0120-303-711
26. 製造販売業者等
26.1 製造販売元
LTLファーマ株式会社
東京都新宿区西新宿6丁目10番1号