医薬品情報
| 総称名 | トルソプト |
|---|---|
| 一般名 | ドルゾラミド塩酸塩 |
| 欧文一般名 | Dorzolamide Hydrochloride |
| 薬効分類名 | 点眼用炭酸脱水酵素阻害剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01EC03 |
| KEGG DRUG |
D00653
ドルゾラミド塩酸塩
|
| KEGG DGROUP |
DG03201
眼圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年4月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| トルソプト点眼液0.5% | TRUSOPT ophthalmic solution | 参天製薬 | 1319738Q1024 | 120.3円/mL | 処方箋医薬品注) |
| トルソプト点眼液1% | TRUSOPT ophthalmic solution | 参天製薬 | 1319738Q2020 | 155.1円/mL | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 重篤な腎障害のある患者[9.2.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤投与前には他剤での治療を実施すること。
5.2 他剤による治療において効果不十分の場合、あるいは、副作用等で他剤の使用が継続不可能な場合に本剤の使用を検討すること。
6. 用法及び用量
通常、0.5%製剤を1回1滴、1日3回点眼する。
なお、十分な効果が得られない場合は、1%製剤を用いて1回1滴、1日3回点眼する。
なお、十分な効果が得られない場合は、1%製剤を用いて1回1滴、1日3回点眼する。
8. 重要な基本的注意
8.1 全身的に吸収される可能性があり、スルホンアミド系薬剤の全身投与時と同様の副作用があらわれることがあるので注意すること。特に、重篤な副作用もしくは過敏症状があらわれた場合には投与を中止すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 眼内手術の既往等のある患者
角膜内皮細胞数の減少により角膜浮腫の発現が増加する可能性がある。
9.1.2 急性閉塞隅角緑内障の患者
本剤を用いる場合には、薬物療法以外に手術療法などを考慮すること。
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
投与しないこと。本剤は主に腎より排泄されるため、体内に蓄積するおそれがある。[2.2参照]
9.3 肝機能障害患者
肝機能障害患者を対象とした臨床試験は実施していない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ウサギ、経口)において、母動物に代謝性アシドーシスを生じる用量を投与したとき、胎児の中軸骨格奇形が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
相互作用序文
本剤は、主としてCYP2C9、2C19及び3A4によって代謝される。[16.4参照]
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
CYP2C19
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| 炭酸脱水酵素阻害剤(全身投与): アセタゾラミド | 炭酸脱水酵素阻害剤の全身的な作用が増強される可能性がある。 | 作用が相加的にあらわれる可能性がある。 |
| アスピリン (大量) | 本剤を大量のアスピリンと併用すると、双方又は一方の薬剤の副作用が増強される可能性がある。 | アスピリンは炭酸脱水酵素阻害剤の血漿蛋白結合と腎からの排泄を抑制し、炭酸脱水酵素阻害剤は血液のpHを低下させ、サリチル酸の血漿から組織への移行を高める可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 皮膚粘膜眼症候群(Stevens-Johnson症候群)、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(いずれも頻度不明)
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 眼 | しみる・流涙・疼痛・異物感・そう痒感等の眼刺激症状(24.4%) | 結膜充血、点眼直後にみられる眼のかすみ、眼瞼炎 | 結膜炎、結膜浮腫、羞明、白色の結膜下沈着物 | 角膜炎・角膜びらん等の角膜障害 |
| その他 | 頭痛、悪心、苦味 | 四肢のしびれ、浮動性めまい |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・ベンザルコニウム塩化物はソフトコンタクトレンズに吸着されることがあるので、ソフトコンタクトレンズを装用している場合には、点眼前にレンズを外し、点眼後少なくとも5〜10分間の間隔をあけて再装用すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜のう内に点眼し、1〜5分間閉瞼して涙のう部を圧迫させた後、開瞼すること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
15. その他の注意
15.1 臨床使用に基づく情報
本剤投与により高度の流涙を伴う眼刺激症状が発現した場合には、薬剤が洗い流され、所期の効果が得られないことがある。
16. 薬物動態
16.1 血中濃度
・健康成人男性(8例)に2.5%ドルゾラミド点眼液を1回1滴、1日3回、7日間点眼したときの全血中濃度は、試験第8日目に最高血中ドルゾラミド濃度1,028ng/mLに達し、それ以降の消失は非常に緩やかで消失半減期は約5ヵ月であった。ドルゾラミドは血漿中には認められず、全投与量の18%が全血中に存在したことから、赤血球中炭酸脱水酵素と結合していることが示されたが、赤血球機能には影響を及ぼさなかった1)2)。代謝物であるN-脱エチル体は試験第21日目から全血中に検出されたが、定量下限(10ng/mL)付近であった3)。
・開放隅角緑内障及び高眼圧症患者(26例)に2%ドルゾラミド点眼液を8時間毎に両眼に1滴ずつ4週間反復点眼したとき、全血中ドルゾラミド濃度は15日目の朝の投与後3時間で2,142ng/mL、28日目の朝の投与前で2,395ng/mL及び28日目の朝の投与後3時間で2,491ng/mLであり、N-脱エチル体はドルゾラミドより低い濃度であった4)(外国人データ)。
16.3 分布
・有色ウサギにドルゾラミド塩酸塩を点眼したとき、角膜から吸収され、角膜、虹彩・毛様体、硝子体、網膜・脈絡膜及び水晶体に高い分布が示された5)。また、投与後赤血球中の炭酸脱水酵素との結合が認められた。
・有色及び白色ウサギに2%ドルゾラミドを点眼し、眼組織中濃度を比較した。有色ウサギの虹彩・毛様体中濃度は白色ウサギに比べて顕著に高く、点眼後4時間では4.4倍に達したが、点眼後4時間以降は減少し点眼後24時間の虹彩・毛様体中濃度は4時間の約1/7であった6)。
・有色ウサギに0.5%ドルゾラミド塩酸塩を両眼に単回あるいは1日2回、11日間反復点眼した。反復投与後1時間の虹彩・毛様体、硝子体及び網膜・脈絡膜中濃度は単回投与の2〜4倍に、水晶体中濃度は15倍に増加した7)。
・ドルゾラミド濃度0.1μg/mL及び1.0μg/mLでのヒト血漿タンパク結合率はそれぞれ30.1%及び27.8%であった8)(in vitro)。
・ヒト赤血球においてドルゾラミドの結合部位は高親和性及び低親和性の2種類の存在が示唆された。ドルゾラミドのヒト炭酸脱水酵素II及び炭酸脱水酵素Iに対する解離定数(Kd値)は、それぞれ0.0006μmol/L及び2.43μmol/Lであった9)(in vitro)。
16.4 代謝
・ドルゾラミド(44.8μg/mL)をヒト肝スライスと37℃で4時間インキュベートしたところ、大部分が未変化体のままであり、代謝物としてはN-脱エチル体のみ検出された11)(in vitro)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
原発開放隅角緑内障又は高眼圧症患者245例(有効性解析対象225例)を対象に、本剤(1日3回)又は0.25%チモロール点眼液(1日2回)を12週間点眼した結果、中等度改善以上を示したものは、本剤群では75.2%(85/113例)、チモロ−ル群では80.4%(90/112例)であり、両群間に有意差は認められなかった。
副作用は、本剤群121例中8例(6.6%)に認められ、主な副作用は点眼時しみる5.8%(7/121例)であった12)。
副作用は、本剤群121例中8例(6.6%)に認められ、主な副作用は点眼時しみる5.8%(7/121例)であった12)。
18. 薬効薬理
18.1 作用機序
炭酸脱水酵素は眼を含む多くの組織に存在し、生体内での二酸化炭素の水和、炭酸の脱水の可逆的反応(CO2+H2O⇔H2CO3)をあずかる酵素である。ドルゾラミドは毛様体に存在するこの酵素を特異的に阻害し、炭酸水素イオンの形成を遅延させ、ナトリウムの液輸送を低下させることにより、房水産生を抑制し、眼圧下降作用を示すと考えられる13)。
18.2 眼圧下降作用
カニクイザルにおけるアルゴンレーザー処置高眼圧及び白色ウサギにおけるα-キモトリプシン惹起高眼圧並びに遺伝的高眼圧有色ウサギに対し、ドルゾラミド塩酸塩の点眼は有意に眼圧上昇を抑制することが認められている5)。
18.3 炭酸脱水酵素阻害作用
・ドルゾラミドはヒト赤血球中の炭酸脱水酵素IIに対し、アセタゾラミドの約5倍、メタゾラミドの約10倍の阻害活性を示した。
・白色及び有色ウサギを用いた試験において、虹彩・毛様体に対しては、0.1%溶液の1回1滴(50μL)の点眼により、投与後1時間において炭酸脱水酵素の活性を完全に阻害した14)。
18.4 血管拡張作用
ブタを用いた実験において、ドルゾラミド塩酸塩500mgの静脈投与による網膜血管拡張作用が認められている15)。
18.5 眼血流への作用
正常眼圧緑内障患者に、1%ドルゾラミド塩酸塩点眼液を1日3回、2週間点眼した結果、網膜中心動脈の最低血流速度の上昇が認められた16)。
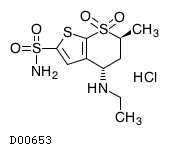
19. 有効成分に関する理化学的知見
19.1. ドルゾラミド塩酸塩
22. 包装
<トルソプト点眼液0.5%>
プラスチック点眼容器 5mL×10本
<トルソプト点眼液1%>
プラスチック点眼容器 5mL×10本
23. 主要文献
- 北澤克明他, 臨床医薬, 9, 1309-1325, (1993)
- Strahlman, E. et al., Am. J. Ophthalmol., 122, 183-194, (1996) »PubMed
- 社内資料:2.5% ドルゾラミド点眼液を健康成人男性に反復点眼したときの薬物動態〔66525〕
- 社内資料:2%ドルゾラミド点眼液を高眼圧の患者に反復点眼したときの薬物動態〔66526〕
- Sugrue, M. F., J. Ocul. Pharmacol. Ther., 12, 363-376, (1996) »PubMed
- 社内資料:有色及び白色ウサギに2%ドルゾラミドを単回点眼したときの眼組織分布〔66542〕
- 社内資料:有色ウサギに0.5%ドルゾラミドを反復点眼したときの眼組織分布〔66543〕
- 原健一他, 薬物動態, 10, 1-17, (1995) »DOI
- Hasegawa, T., et al., Drug Metab. Dispos., 22, 377-382, (1994) »PubMed
- Wong, B. K. et al., ISSX Proceedings, 8, 140-140, (1995)
- 社内資料:ヒト肝スライスによるドルゾラミドのin vitro代謝〔66524〕
- 北澤克明, 日本眼科紀要, 45, 1023-1033, (1994)
- Vanlandingham, B. D., Ophthalmology., 105, 1537-1540, (1998) »PubMed
- Sugrue, M. F. et al., Curr. Eye Res., 9, 607-615, (1990) »PubMed
- Pedersen, D. B. et al., Graefes Arch. Clin. Exp. Ophthalmol., 243, 163-168, (2005) »PubMed
- 江見和雄, あたらしい眼科, 18, 255-257, (2001)
24. 文献請求先及び問い合わせ先
文献請求先
参天製薬株式会社
製品情報センター 受付時間 9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
製品情報問い合わせ先
参天製薬株式会社
製品情報センター 受付時間 9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
26. 製造販売業者等
26.1 製造販売元
参天製薬株式会社
大阪市北区大深町4-20