医薬品情報
| 総称名 | ベロテック |
|---|---|
| 一般名 | フェノテロール臭化水素酸塩 |
| 欧文一般名 | Fenoterol Hydrobromide Fenoterol |
| 製剤名 | フェノテロール臭化水素酸塩製剤 |
| 薬効分類名 | 気管支拡張剤 |
| 薬効分類番号 | 2252 |
| ATCコード | R03AC04 R03CC04 |
| KEGG DRUG |
D01428
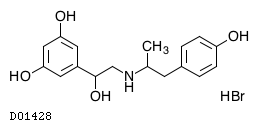
フェノテロール臭化水素酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年2月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ベロテックエロゾル100 | Berotec Metered Aerosol 100 | 日本ベーリンガーインゲルハイム | 2252704G2020 | 354.6円/瓶 | 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 カテコールアミン(エピネフリン、イソプロテレノール等)を投与中の患者[10.1参照]
2.2 本剤に対して過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤は喘息発作に対する対症療法剤であるので、本剤の使用は発作発現時に限ること。
5.2 本剤の投与は、他のβ2刺激薬吸入剤が無効な場合に限ること。[1.2参照]
6. 用法及び用量
通常1回2吸入(フェノテロール臭化水素酸塩として0.2mg)する。成人には2〜5分間たって効果が不十分な場合はさらに1〜2吸入する。
7. 用法及び用量に関連する注意
1回2吸入を原則とするが、1回1吸入からはじめ、効果を確認しながら使用すること。なお、吸入後2〜5分を待っても十分な効果がみられない場合には、2吸入を限度として追加吸入できるが、それ以上の追加吸入を行うときは、少なくとも6時間の間隔をおき、1日4回までとすること。[8.1参照]
8. 重要な基本的注意
8.1 過度に使用を続けた場合、不整脈、場合により心停止を起こすおそれがあり、特に発作発現時の吸入投与の場合には、使用が過度になりやすいので十分に注意すること。また、患者に対し、本剤の過度の使用による危険性があることを理解させ、7.の注意及びその他必要と考えられる注意を与えること。[7.参照]
8.2 投与にあたっては、過度の使用を防止するために、用法用量を正しく指導し、経過観察を十分に行うこと。用法用量どおり正しく使用しても効果が認められない場合には、気道炎症の増悪が疑われ、本剤の効果が認められないままに過度の使用になる可能性があるので、本剤の投与を中止し、他の適切な治療法に切り替えること。[1.1参照]
8.3 発作が重篤で吸入投与の効果が不十分な場合には、可及的速やかに医療機関を受診し治療を受けるよう注意を与えること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 甲状腺機能亢進症の患者
症状を悪化させるおそれがある。
9.1.2 高血圧症の患者
血圧が上昇することがある。
9.1.3 心疾患のある患者
動悸、不整脈等があらわれることがある。
9.1.4 糖尿病の患者
症状を悪化させるおそれがある。
9.1.5 低酸素血症の患者
血清カリウム値をモニターすることが望ましい。低酸素血症は血清カリウム値の低下が心リズムに及ぼす作用を増強することがある。[11.1.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合のみ投与すること。動物実験(ラット)で胎児骨格異常の出現頻度の増加が認められている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ウサギ)で母乳中へ移行することが報告されている2)。
9.7 小児等
9.7.1 他のβ2刺激薬吸入剤が無効な場合で、入院中など、医師の厳重な管理・監督下で本剤を投与する場合を除き、投与しないこと。[1.3参照]
9.7.2 小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
10. 相互作用
10.1 併用禁忌
| カテコールアミン(エピネフリン、イソプロテレノール等) エピネフリン製剤(エピネフリン、ボスミン注、ノルエピネフリン) イソプロテレノール製剤(アスプール液、メジヘラー・イソ) [2.1参照] | 不整脈、場合によっては心停止を起こすおそれがある。 | エピネフリン、イソプロテレノール等のカテコールアミン併用により、アドレナリン作動性神経刺激の増大が起きる。 そのため不整脈を起こすことが考えられる。 |
10.2 併用注意
| キサンチン誘導体 テオフィリン アミノフィリン ステロイド剤 ベタメタゾン プレドニゾロン コハク酸ヒドロコルチゾンナトリウム 利尿剤 フロセミド [11.1.1参照] | 血清カリウム値の低下作用を増強することがある。 血清カリウム値のモニターを行う。 | キサンチン誘導体はアドレナリン作動性神経刺激を増大させるため、血清カリウム値の低下を増強することが考えられる。 ステロイド剤及び利尿剤は尿細管でのカリウム排泄促進作用があるため、血清カリウム値の低下が増強することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 重篤な血清カリウム値の低下(頻度不明)
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 循環器 | 動悸 | 頻脈 | |
| 精神神経系 | 振戦、頭痛 | ||
| 消化器 | 嘔気 | ||
| 呼吸器 | 咽喉刺激感、咳嗽 | ||
| 過敏症 | 発疹、そう痒症、蕁麻疹 | ||
| その他 | 倦怠感 |
12. 臨床検査結果に及ぼす影響
本剤はアレルゲンによる皮膚反応に抑制的に作用する場合があるので、注意すること。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 吸入前
本剤の効果を十分に発揮するため、痰がからんでいるようなときは、使用前にできるだけ出しておくこと。
14.1.2 使用方法
本剤の効果を十分にあらわすためには正しい使い方をすることが大切である。初めてエロゾルを使用する場合には、鏡の前で試みるのが望ましい。
この装置は指でおさえ圧を加えることにより何回も使用でき、一定量が噴霧された後、自動的にもとの状態にもどるようになっている。なお、容器の底を上にして圧を加えないと薬剤が噴霧されないので、この点注意すること。容器1ボンベ(10mL)で約200回吸入できるが、内容物が外から見えないので、時々容器を振って中に液があるか否かを確かめておく必要がある。
次の順序で使用する。
(1)キャップをはずす。
なお、初めて使用する場合及び前回使用から3日間(72時間)使用していない場合には、2回噴霧し、正しく噴霧されるか確かめる。ただし、このとき顔に向け噴霧しないこと。
なお、初めて使用する場合及び前回使用から3日間(72時間)使用していない場合には、2回噴霧し、正しく噴霧されるか確かめる。ただし、このとき顔に向け噴霧しないこと。
(2)息をはき出す。
(3)容器を持ち、吸入口を歯で軽くくわえる。このとき、容器の底は上を向く。
(4)できるだけ深く息を吸い込みながら、容器の底を1回垂直に強く押す。数秒間息をとめ、その後、口からアダプターをはずしゆっくり息をはき出す。
(5)2吸入する場合は(2)〜(4)の手順を繰り返す。
(6)使用後はキャップをつける。
(7)吸入終了後はうがいをする。
16. 薬物動態
16.1 血中濃度
16.2 吸収
慢性閉塞性肺疾患患者に本剤0.2mg又は0.4mg注)を単回吸入投与した場合のバイオアベイラビリティは9〜12%であった4)(外国人データ)。
16.3 分布
健康成人の血清蛋白に対する結合率は、本剤2.5μg/mLで約45%であった5)(外国人データ)。
16.4 代謝
健康成人に経口投与した場合、代謝は速やかで、主代謝産物は硫酸抱合体である6)(外国人データ)。
16.5 排泄
48時間で尿中に約19%、糞中に約63%が排泄される3)(外国人データ)。
注)本剤の承認用量は1回0.2mg吸入。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
気管支喘息、慢性気管支炎、肺気腫、じん肺症患者を対象とした臨床試験において、本剤1回0.2mgあるいは0.4mg注)吸入の単回投与あるいは4週間投与における有効率(有効以上)は、効果判定のなされた症例で67.0%(126/188例)であった。
本剤0.2mgあるいは0.4mg注)投与群での副作用発現頻度は7.0%(14/199例)で、主な副作用は心悸亢進5.0%(10/199例)、手指の振戦2.0%(4/199例)、頭痛1.5%(3/199例)であった。
本剤0.2mgあるいは0.4mg注)投与群での副作用発現頻度は7.0%(14/199例)で、主な副作用は心悸亢進5.0%(10/199例)、手指の振戦2.0%(4/199例)、頭痛1.5%(3/199例)であった。
17.1.2 国内第III相試験
気管支喘息患者59例を対象とし、本剤1回0.4mg注)あるいはイソプロテレノール1回0.2mgを単回吸入した二重盲検比較試験の結果、肺機能検査値(FEV1)は本剤投与後に有意に増加し、イソプロテレノールと比較して有意な改善を認めた。
本剤投与群での副作用発現頻度は27.1%(16/59例)で、副作用は心悸亢進20.3%(12/59例)、手指の振戦13.6%(8/59例)、倦怠感1.7%(1/59例)であった。
本剤投与群での副作用発現頻度は27.1%(16/59例)で、副作用は心悸亢進20.3%(12/59例)、手指の振戦13.6%(8/59例)、倦怠感1.7%(1/59例)であった。
注)本剤の承認用量は1回0.2mg吸入。
18. 薬効薬理
18.1 作用機序
本剤の主作用は、β2アドレナリン受容体刺激による気管支平滑筋弛緩作用(気管支拡張作用)である。
18.2 気管支拡張作用
18.3 β2アドレナリン受容体への選択性
18.4 抗アレルギー作用
18.5 実験的喘息防御作用
18.6 気道線毛運動亢進作用
19. 有効成分に関する理化学的知見
19.1. フェノテロール臭化水素酸塩
20. 取扱い上の注意
20.1 まれにゴミがつまり噴射しない場合があるので、その場合は、よく消毒した針でステム孔(突起の根元)を掃除すること。また、アダプターの噴射孔にゴミがつまり噴射しない場合には、アダプターを水でよく洗い、乾燥してから用いること。
20.2 使用後火中に投じないこと。
20.3 地方自治体により定められたボンベの廃棄処理法にしたがうこと。
22. 包装
1ボンベ(10mL)×5
23. 主要文献
- 社内資料:生殖発生毒性試験
- Meissner J et al., Arzneimitelforsch, 24, 1213, (1974)
- Seyberth H W et al., Verh Dtsch Ges Inn Med., 79, 888-891, (1973)
- Schmidt E W et al., Respiration, 62, 190, (1995)
- 吸収、分布、代謝、排泄に関する資料(社内資料)
- Buchelt L et al., Medical Proceedings Mediese Bydraes., 18, 15, (1972)
- 柳川孝生ほか, 応用薬理, 20, 415, (1980)
- 滝島任ほか, 臨牀と研究, 53, 197, (1976)
- Giles R E et al., J Pharmacol Exp Ther, 186, 472, (1973)
- Riedel-Dibbern E et al., Int J Clin Pharmacol, (Suppl 4), 129, (1972)
- Hughes J M et al., Eur J Pharmacol, 95, 239, (1983)
- 富田有祐ほか, 臨床薬理, 12, 49, (1981)
- 西間三馨ほか, 小児科臨床, 37, 1911, (1984)
- Benjamin C., Medical Proceedings Mediese Bydraes, 18, 35, (1972)
- Woitowitz H J et al., Respiration, 29, 549, (1972)
- 永倉俊和ほか, アレルギー, 30, 335, (1981) »DOI
- Iravani J et al., Int J Clin Pharmacol Beiheft, 4, 20, (1972)
- Felix R et al., Prax Pneumol, 32, 777, (1978)
24. 文献請求先及び問い合わせ先
文献請求先
日本ベーリンガーインゲルハイム株式会社
DIセンター
〒141-6017
東京都品川区大崎2丁目1番1号
ThinkPark Tower
ThinkPark Tower
電話:0120-189-779 (受付時間)9:00〜18:00 (土・日・祝日・弊社休業日を除く)
製品情報問い合わせ先
日本ベーリンガーインゲルハイム株式会社
DIセンター
〒141-6017
東京都品川区大崎2丁目1番1号
ThinkPark Tower
ThinkPark Tower
電話:0120-189-779 (受付時間)9:00〜18:00 (土・日・祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元(輸入販売元)
日本ベーリンガーインゲルハイム株式会社
東京都品川区大崎2丁目1番1号