医薬品情報
| 総称名 | サンリズム |
|---|---|
| 一般名 | ピルシカイニド塩酸塩水和物 |
| 欧文一般名 | Pilsicainide Hydrochloride Hydrate |
| 製剤名 | ピルシカイニド塩酸塩水和物注 |
| 薬効分類名 | 不整脈治療剤 |
| 薬効分類番号 | 2129 |
| KEGG DRUG |
D01554
ピルシカイニド塩酸塩水和物
|
| KEGG DGROUP |
DG01653
抗不整脈薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年8月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| サンリズム注射液50 | SUNRYTHM INJECTION | 第一三共 | 2129408A1020 | 490円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 うっ血性心不全のある患者[不整脈(心室頻拍、心室細動等)の誘発又は増悪、陰性変力作用による心不全の悪化を来すおそれが高い。]
2.2 高度の房室ブロック、高度の洞房ブロックのある患者[刺激伝導抑制作用により、これらの障害を更に悪化させるおそれがある。][9.1.3参照]
4. 効能または効果
緊急治療を要する頻脈性不整脈(上室性及び心室性)
6. 用法及び用量
<期外収縮>
通常、成人には1回0.075mL/kg(ピルシカイニド塩酸塩水和物として0.75mg/kg)を必要に応じて日本薬局方生理食塩液又は5%ブドウ糖注射液などで希釈し、血圧ならびに心電図監視下に10分間で徐々に静注する。なお、年齢、症状に応じて適宜減量する。
<頻拍>
通常、成人には1回0.1mL/kg(ピルシカイニド塩酸塩水和物として1.0mg/kg)を必要に応じて日本薬局方生理食塩液又は5%ブドウ糖注射液などで希釈し、血圧ならびに心電図監視下に10分間で徐々に静注する。なお、年齢、症状に応じて適宜減量する。
7. 用法及び用量に関連する注意
7.1 本剤を急速に静注した場合には、血中濃度が急激に上昇するので、本剤の投与に際しては投与時間を厳守すること。
7.2 本剤の投与により効果を認めたものの、その後再発した場合には、初回用量がピルシカイニド塩酸塩水和物としての最大用量0.75mg/kg(期外収縮)あるいは1.0mg/kg(頻拍)の半量以下の場合を除き、再投与は行わないこと。なお、再投与する際は1日総投与量としてピルシカイニド塩酸塩水和物の1回最大用量を超えないこと。
8. 重要な基本的注意
8.1 本剤の投与に際しては、必ず心電図、脈拍、血圧等の連続監視を行うこと。PQの延長、QRS幅の増大、QTの延長、徐脈、血圧低下等の異常所見が認められた場合には、直ちに投与を中止すること。
8.2 発作性頻拍では投与中に不整脈が消失した場合は、患者の状態を観察しながら投与を終了すること。
8.3 本剤が有効であり、かつ経口投与が可能となった後は速やかに経口投与に切り替えること。
8.4 本剤の効果の発現が認められない場合は、他の治療方法に切り替えること。
8.5 本剤投与後に他の抗不整脈薬の追加投与が必要な場合には、作用が増強する可能性があるので十分注意して投与すること。本剤投与後、心電図に変化が認められる間は特に注意して投与すること。[10.2参照]
8.6 本剤でBrugada症候群に特徴的な心電図変化(右脚ブロック及び右側胸部誘導(V1〜V3)のST上昇)の顕在化、又はそれに伴う心室細動、心室頻拍、心室性期外収縮を発現させたとの報告があるので注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 基礎心疾患(心筋梗塞、弁膜症、心筋症等)のある患者
心不全を来すおそれのある患者では、心室頻拍、心室細動等が発現するおそれが高い。
9.1.2 心不全の既往のある患者
心不全を来すおそれがある。
9.1.3 刺激伝導障害(房室ブロック、洞房ブロック、脚ブロック等)のある患者(高度の房室ブロック、高度の洞房ブロックのある患者を除く)
刺激伝導抑制作用により、これらの障害を更に悪化させるおそれがある。[2.2参照]
9.1.4 著明な洞性徐脈のある患者
高度の徐脈、洞停止を来すおそれがある。
9.1.5 血清カリウム低下のある患者
催不整脈作用が発現するおそれがある。
9.1.6 遺伝性果糖不耐症の患者
本剤の添加剤D-ソルビトールが体内で代謝されて生成した果糖が正常に代謝されず、低血糖、肝不全、腎不全等が誘発されるおそれがある。
9.1.7 他の抗不整脈薬を併用している患者
慎重に観察しながら投与すること。[10.2参照]
9.1.8 恒久的ペースメーカー使用中あるいは一時的ペーシング中の患者
異常が認められた場合には直ちに投与を中止すること。本剤は心臓ペーシング閾値を上昇させる可能性がある。
9.2 腎機能障害患者
本剤は腎臓からの排泄により体内から消失する薬剤であり、血中濃度が高くなりやすく、また高い血中濃度が持続するおそれがある。[16.6.1参照]
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
AST、ALT、LDH等の上昇が報告されている。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で胎児に移行することが報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
肝・腎機能が低下していることが多く、また体重が少ない傾向があるなど副作用が発現しやすい。
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 心室細動(頻度不明)、心室頻拍(Torsade de pointesを含む)(頻度不明)、洞停止(頻度不明)、完全房室ブロック(頻度不明)、失神(頻度不明)、心不全(頻度不明)
ショック、心停止に至る場合もあるので、心電図の連続監視等を行うこと。
11.1.2 急性腎障害(頻度不明)
ショック等による急性腎障害があらわれることがある。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 循環器 | QRS幅の増大、徐脈、心室性期外収縮、胸部不快感、胸痛、血圧低下 | 上室性期外収縮、QT延長、上室性頻拍、房室ブロック、心房粗動 |
| 消化器 | 口渇、悪心 | 嘔吐 |
| 精神神経系 | ふわふわ感 | |
| 血液 | 白血球数減少、白血球数増加、好酸球増加、リンパ球減少、リンパ球増加 | |
| 肝臓 | AST上昇、ALT上昇、LDH上昇 | |
| 過敏症 | 発疹 | |
| 腎臓 | BUN上昇、尿蛋白陽性 | クレアチニン上昇 |
| その他 | 全身倦怠感、CK上昇 |
13. 過量投与
13.1 症状
過量投与又は高度の腎機能障害により、本剤の血中濃度が上昇した場合、刺激伝導障害(著明なQRS幅の増大等)、心停止、心不全、心室細動、心室頻拍(Torsade de pointesを含む)、洞停止、徐脈、ショック、失神、血圧低下等の循環器障害、構語障害等の精神・神経障害を引き起こすことがある。
13.2 処置
直ちに本剤の投与を中止し、体外ペーシングや直流除細動を考慮する等適切な対症療法を行うこと。なお、本剤の血液透析による除去率は最大約30%と報告されている。
16. 薬物動態
16.1 血中濃度
健康成人男性18例にピルシカイニド塩酸塩水和物0.25、0.50及び0.75mg/kg注1)を10分間かけて単回静脈内投与した場合、血漿中濃度の推移は次のとおりであった1)。
ピルシカイニド塩酸塩水和物単回静脈内投与時の血漿中濃度の推移
| 投与量(mg/kg) | 例数 | Cmax(μg/mL) | t1/2α(min) | t1/2β(hr) | AUC(μg・hr/mL) |
| 0.25 | 6注2) | 0.28±0.06 | 1.99±0.68 | 4.34±1.98 | 0.73±0.33 |
| 0.50 | 6 | 0.65±0.28 | 3.95±1.54 | 5.74±0.85 | 1.71±0.27 |
| 0.75 | 6 | 1.10±0.30 | 1.82±1.01 | 4.37±0.48 | 2.88±0.36 |
ヒトの1.0mg/kg投与時(10分間かけて投与)の血漿中濃度は1.74±0.85μg/mLであり、ラットにおける1.0mg/kg反復投与時(無毒性量)のラット血漿中濃度3.12±0.60μg/mLのほぼ1/2であった。
16.3 分布
16.4 代謝
健康成人ではピルシカイニド塩酸塩水和物は代謝されにくい。経口投与時に検出された代謝物2-ヒドロキシメチル体の生成に関与するヒト肝チトクロームP450分子種を検討したところ、CYP2D6により上記代謝物の生成が僅かに認められた5)。
16.5 排泄
健康成人男性にピルシカイニド塩酸塩水和物0.125、0.25、0.50及び0.75mg/kg注1)を単回静脈内投与した場合に、いずれの投与量においても24時間以内に90%以上が未変化体として尿中に排泄された1)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
ピルシカイニド塩酸塩水和物は腎排泄型の薬剤であり、経口剤においては腎機能障害患者、腎機能が低下している高齢者では内因性クレアチニンクリアランス(CLcr)の低下に伴い半減期が延長した6)。[9.2参照]
| 腎機能CLcr(mL/min) | 例数 | Tmax(hr) | Cmax(μg/mL) | t1/2(hr) | Vd(L/kg) | CLtot(mL/min) |
| CLcr≧80 | 6 | 3.1±0.6 | 0.41±0.08 | 3.4±0.2 | 1.48±0.19 | 280.0±37.5 |
| 80>CLcr≧50 | 10 | 2.7±0.8 | 0.46±0.03 | 5.7±0.3 | 1.46±0.11 | 182.8±11.8 |
| 50>CLcr≧20 | 8 | 3.1±0.8 | 0.51±0.05 | 9.3±1.1 | 1.70±0.15 | 123.4±19.3 |
| 20>CLcr | 8 | 3.8±0.7 | 0.63±0.05 | 23.7±2.0 | 1.46±0.11 | 38.8±4.6 |
注1)本剤の承認用量は1回0.75mg/kg又は1.0mg/kgである。
注2)Cmaxのみ6例で、他の薬物動態パラメータは5例で解析した。
17. 臨床成績
17.1 有効性及び安全性に関する試験
心室性期外収縮、上室性期外収縮、発作性上室性頻拍、発作性心房細動・粗動、発作性心室頻拍を対象とした臨床試験の概要は次表のとおりである。
| 疾患名 | 対象症例 | 全般改善度 | |
| 著明改善 | 中等度改善以上 | ||
| 心室性期外収縮 | 184 | 100(54.3%) | 127(69.0%) |
| 上室性期外収縮 | 1 | 1 | 1 |
| 発作性上室性頻拍 | 130 | 94(72.3%) | 95(73.1%) |
| 発作性心房細動・粗動 | 120 | 37(30.8%) | 50(41.7%) |
| 発作性心室頻拍 | 10 | 9(90.0%) | 9(90.0%) |
臨床試験のうち、心室性期外収縮、発作性上室性頻拍、発作性心房細動・粗動の各不整脈を対象とした二重盲検比較試験において、本剤の有用性が確認された。
17.1.1 国内第III相試験
心室性期外収縮を対象とした二重盲検比較試験において、本剤0.75mg/kg投与群とジソピラミド1.5mg/kg投与群での全般改善度における改善率(中等度改善以上)はそれぞれ76.6%(59/77例)、70.8%(51/72例)であった。本剤投与群における副作用発現率は3.9%(3/77例)であった7)。
17.1.2 国内第III相試験
発作性上室性頻拍を対象とした二重盲検比較試験において、本剤1.0mg/kg投与群とプラセボ群での全般改善度における改善率(中等度改善以上)はそれぞれ89.3%(25/28例)、20.0%(5/25例)であった。本剤投与群における副作用発現率は3.6%(1/28例)であった8)。
17.1.3 国内第III相試験
発作性心房細動・粗動を対象とした二重盲検比較試験において、本剤1.0mg/kg投与群とプラセボ群での全般改善度における改善率(中等度改善以上)はそれぞれ45.0%(18/40例)、2.9%(1/34例)であった。本剤投与群における副作用発現率は4.9%(2/41例)であった9)。
18. 薬効薬理
18.1 作用機序
本剤は、Vaughan Williamsらの分類のクラスIcに属する不整脈治療剤で、Naチャンネル抑制作用により抗不整脈作用を示す。Sicilian Gambitの提唱する薬剤分類(日本版)において、本剤はNaチャンネルを選択的に抑制し、K、Caチャンネル並びにα、β及びムスカリン受容体などには影響を与えないものとして位置づけられる。
18.2 臨床電気生理学的作用
18.3 心機能に対する作用
18.4 実験的不整脈に対する作用
18.4.3 イヌの冠動脈閉塞中及び再灌流中に発生する心室性不整脈を抑制した16)。
18.5 電気生理学的作用
18.5.1 最大脱分極速度に対する作用
モルモット乳頭筋において、静止膜電位にほとんど影響を与えることなく、最大脱分極速度(Vmax)を用量依存的に抑制した17)。
18.5.2 活動電位持続時間及び有効不応期に対する作用
モルモット乳頭筋の活動電位持続時間(APD)及び有効不応期(ERP)に影響を与えなかった17)。
18.5.3 心室細動の発生閾値に対する作用
イヌにおいて電気刺激による心室細動の発生閾値を上昇させた16)。
18.5.4 遅延後脱分極及び誘発自動能に対する作用
イヌのプルキンエ線維においてアセチルストロファンチジンで誘発される遅延後脱分極及び誘発自動能を抑制した18)。
18.5.5 アセチルコリンで惹起されるKチャンネル電流に対する作用
モルモットの単一心房筋細胞においてアセチルコリンで惹起されるKチャンネル電流に対する抑制作用はフレカイニド、ジソピラミド、キニジンと比べて弱かった19)。
18.5.6 心電図に対する作用
イヌにおいて心電図のPQの延長及びQRS幅の増大作用を有するがQTcの延長作用はジソピラミドと比べて弱かった14)。
18.6 活性代謝物の抗不整脈作用
イヌ冠動脈二段結紮不整脈に対する2-ヒドロキシメチル体の抗不整脈作用強度はピルシカイニド塩酸塩水和物の1/8であった14)。
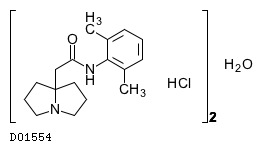
19. 有効成分に関する理化学的知見
19.1. ピルシカイニド塩酸塩水和物
22. 包装
5mL 10アンプル
23. 主要文献
- 中島光好ほか, 臨床医薬, 14 (1), 47-61, (1998)
- 林 敏郎ほか, 基礎と臨床, 23 (6), 2197-2229, (1989)
- 小森谷和美ほか, 応用薬理, 65 (5/6), 89-95, (2003)
- 社内資料:ヒト血漿蛋白結合率(2000年1月18日承認、申請資料概要へ.2.3.3)
- 藤谷朝通ほか, 薬物動態, 12 (S), 255, (1997)
- 高畠利一ほか, 薬理と治療, 17 (7), 3195-3205, (1989)
- 加藤和三ほか, 臨床医薬, 14 (4), 719-745, (1998), (1999年改訂)
- 加藤和三ほか, 臨床医薬, 14 (4), 747-768, (1998), (1999年改訂)
- 加藤和三ほか, 臨床医薬, 14 (4), 769-790, (1998), (1999年改訂)
- 新 博次ほか, 臨床医薬, 14 (1), 63-74, (1998)
- 庄田守男ほか, 臨床医薬, 14 (1), 75-88, (1998)
- 日高寿範ほか, 応用薬理, 37 (4), 359-372, (1989)
- Aisaka K,et al., Arzneimittelforschung, 35(II) (8), 1239-1245, (1985)
- 日高寿範ほか, 日本薬理学雑誌, 115 (5), 295-308, (2000) »DOI
- 日高寿範ほか, 基礎と臨床, 26 (13), 4927-4931, (1992)
- 日高寿範ほか, 応用薬理, 36 (6), 439-447, (1988)
- Hattori Y,et al., J Cardiovasc Pharmacol., 8 (5), 998-1002, (1986) »PubMed
- Inomata N,et al., Eur J Pharmacol., 145 (3), 313-322, (1988) »PubMed
- Inomata N,et al., Br J Pharmacol., 104 (4), 1007-1011, (1991) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
製品情報問い合わせ先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
26. 製造販売業者等
26.1 製造販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1