医薬品情報
| 総称名 | リレンザ |
|---|---|
| 一般名 | ザナミビル水和物 |
| 欧文一般名 | Zanamivir Hydrate |
| 製剤名 | ザナミビル水和物ドライパウダーインヘラー |
| 薬効分類名 | 抗インフルエンザウイルス剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AH01 |
| KEGG DRUG |
D01937
ザナミビル水和物
|
| KEGG DGROUP |
DG03029
抗インフルエンザウイルス薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リレンザ | RELENZA | グラクソ・スミスクライン | 6250702G1028 | 113.6円/ブリスター | 処方箋医薬品注) |
1. 警告
1.1 本剤を治療に用いる場合は、本剤の必要性を慎重に検討すること。
1.2 インフルエンザウイルス感染症の予防の基本はワクチンによる予防であり、本剤の予防使用はワクチンによる予防に置き換わるものではない。
2. 禁忌
次の患者には投与しないこと
本剤の成分に対して過敏症の既往歴のある患者
4. 効能または効果
A型又はB型インフルエンザウイルス感染症の治療及びその予防
5. 効能または効果に関連する注意
<効能共通>
5.1 本剤はC型インフルエンザウイルス感染症には効果がない。
5.2 本剤は細菌感染症には効果がない。[8.2参照]
<治療>
5.3 抗ウイルス薬の投与が全てのA型又はB型インフルエンザウイルス感染症の治療には必須ではないことを踏まえ、本剤の使用の必要性を慎重に検討すること。
5.4 インフルエンザ様症状の発現から2日以内に投与を開始すること。
<予防>
5.5 原則として、インフルエンザウイルス感染症を発症している患者の同居家族又は共同生活者である下記の者を対象とする。
・高齢者(65歳以上)
・慢性心疾患患者
・代謝性疾患患者(糖尿病等)
・腎機能障害患者
6. 用法及び用量
<治療に用いる場合>
通常、成人及び小児には、ザナミビルとして1回10mg(5mgブリスターを2ブリスター)を、1日2回、5日間、専用の吸入器を用いて吸入する。
<予防に用いる場合>
通常、成人及び小児には、ザナミビルとして1回10mg(5mgブリスターを2ブリスター)を、1日1回、10日間、専用の吸入器を用いて吸入する。
7. 用法及び用量に関連する注意
<治療>
7.1 発症後、可能な限り速やかに投与を開始することが望ましい(症状発現から48時間経過後に投与を開始した患者における有効性を裏付けるデータは得られていない)。
<予防>
7.2 次の点に注意して使用すること。
・インフルエンザウイルス感染症患者に接触後1.5日以内に投与を開始すること(接触後36時間経過後に投与を開始した患者における有効性を裏付けるデータは得られていない)。
・インフルエンザウイルス感染症に対する予防効果は、本剤を連続して使用している期間のみ持続する。
8. 重要な基本的注意
8.1 抗インフルエンザウイルス薬の服用の有無又は種類にかかわらず、インフルエンザ罹患時には、異常行動を発現した例が報告されている。異常行動による転落等の万が一の事故を防止するための予防的な対応として、[1]異常行動の発現のおそれがあること、[2]自宅において療養を行う場合、少なくとも発熱から2日間、保護者等は転落等の事故に対する防止対策を講じること、について患者・家族に対し説明を行うこと。なお、転落等の事故に至るおそれのある重度の異常行動については、就学以降の小児・未成年者の男性で報告が多いこと、発熱から2日間以内に発現することが多いこと、が知られている。[11.1.4参照]
8.2 細菌感染症がインフルエンザウイルス感染症に合併したり、インフルエンザ様症状と混同されることがある。細菌感染症の場合には、抗菌剤を投与するなど適切な処置を行うこと。[5.2参照]
8.3 本剤投与後に失神やショック症状があらわれたとの報告がある。この失神やショック症状はインフルエンザウイルス感染症に伴う発熱、脱水等の全身状態の悪化に加え、本剤を強く吸入したこと、または長く息を止めたことが誘因となった可能性がある。患者には使用説明書に記載されている吸入法を十分に理解させ、くつろいだ状態(例えば座位等)で吸入するよう指導すること。また、このような症状があらわれた場合には、患者に仰臥位をとらせ安静に保つとともに、補液を行うなど適切な処置を行うこと。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 乳製品に対して過敏症の既往歴のある患者
本剤は、夾雑物として乳蛋白を含む乳糖水和物を使用しており、アナフィラキシーがあらわれたとの報告がある。
9.1.2 免疫低下状態の患者
患者の状態を十分に観察しながら投与すること。
9.1.3 気管支喘息及び慢性閉塞性肺疾患等の慢性呼吸器疾患のある患者
気管支攣縮や呼吸機能の低下があらわれた場合、本剤の投与を中止し、適切な処置を行うこと。インフルエンザウイルス感染症により気道過敏性が亢進することがあり、本剤投与後に気管支攣縮や呼吸機能の低下がみられたという報告がある(呼吸器疾患の既往歴がない患者においても同様な報告がある)。
軽度又は中等度の喘息患者(ただし、急性のインフルエンザ症状を有さない症例)を対象とした海外の臨床薬理試験において、13例中1例に気管支攣縮が認められた。
また、本剤を投与する場合には本剤投与後に気管支攣縮が起こる可能性があることを患者に説明することとし、必要時に使用できるよう短時間作用発現型気管支拡張剤を患者に所持させること。
なお、慢性呼吸器疾患の治療に用いる吸入薬(短時間作用発現型気管支拡張剤等)を併用する場合には、本剤を投与する前に使用するよう指導すること。
軽度又は中等度の喘息患者(ただし、急性のインフルエンザ症状を有さない症例)を対象とした海外の臨床薬理試験において、13例中1例に気管支攣縮が認められた。
また、本剤を投与する場合には本剤投与後に気管支攣縮が起こる可能性があることを患者に説明することとし、必要時に使用できるよう短時間作用発現型気管支拡張剤を患者に所持させること。
なお、慢性呼吸器疾患の治療に用いる吸入薬(短時間作用発現型気管支拡張剤等)を併用する場合には、本剤を投与する前に使用するよう指導すること。
9.2 腎機能障害患者
透析を必要とするような腎機能障害患者を対象とした臨床試験は実施していない。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット、ウサギ)で胎盤通過性が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
9.7.1 小児に対しては、本剤を適切に吸入投与できると判断された場合にのみ投与すること。[14.1.1参照]
9.7.2 低出生体重児、新生児、乳児又は4歳以下の幼児を対象とした臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(血圧低下、呼吸困難、咽頭・喉頭浮腫等)が起こることがある。[8.3参照]
11.1.2 気管支攣縮、呼吸困難(いずれも頻度不明)
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(いずれも頻度不明)
11.1.4 異常行動(0.06%)
因果関係は不明であるものの、インフルエンザ罹患時には、転落等に至るおそれのある異常行動(急に走り出す、徘徊する等)があらわれることがある。[8.1参照]
11.2 その他の副作用
| 0.1%〜1% | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | 顔面浮腫、蕁麻疹 | |
| 精神神経系 | 頭痛、手指のしびれ感、不眠症 | 血管迷走神経反応 | |
| 消化器 | 下痢、悪心・嘔吐 | 咽喉乾燥、口渇、口内炎、舌あれ、食欲不振、胃部不快感 | |
| 呼吸器 | 嗄声、咽喉刺激感、鼻道刺激感、喘鳴、鼻出血、鼻漏、痰 | ||
| 感覚器 | 嗅覚障害、耳鳴 | ||
| 循環器 | 動悸 | ||
| 全身症状 | 発汗、発熱、頚部痛、背部痛、低体温 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 吸入前
(1)本剤は添付の専用吸入器(ディスクヘラー)を用いて、口腔内への吸入投与にのみ使用すること。ネブライザーもしくは機械式人工呼吸器には使用しないこと。本剤(吸入用散剤)を溶解し、ネブライザーもしくは機械式人工呼吸器を介してインフルエンザ入院患者に投与し、添加物である乳糖による医療機器の閉塞のために患者が死亡したとの報告がある。
(2)患者又は保護者には添付の専用吸入器及び使用説明書を渡し、使用方法を指導すること。[9.7.1参照]
(3)ザナミビル水和物は吸湿性が高いので、ブリスターは吸入の直前に穴をあけること。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人に10mgを単回吸入投与した時の血漿中濃度推移及び薬物動態パラメータを以下に示した。
| Cmax(ng/mL) | Tmax(hr) | AUC0-24(ng・hr/mL) | T1/2(hr) | |
| 日本人(12例) | 29.77±9.74 | 1.67±0.83 | 166.78±39.07 | 2.56±0.56 |
| 外国人(12例) | 28.96±17.47 | 1.25±0.50 | 149.48±79.10 | 2.48±0.28 |
16.1.2 反復投与
健康成人に20mgを1日2回6日間反復吸入投与注)した時、健康成人(外国人)に10mgを1日4回6日間注)反復投与した時、蓄積性は認められなかった。
16.2 吸収
経口投与時の絶対的生物学的利用率(消化管からの吸収)は2%であり、残りは糞中に排泄されるものと考えられる1)(外国人データ)。
16.3 分布
In vitroでの血漿蛋白結合率は14%以下であった2)。
16.4 代謝
本薬がCYPの各分子種の代謝能に影響を与えないことがin vitro試験で確認されている2)。
16.5 排泄
16.5.1 成人吸入投与
健康成人に10mgを単回吸入投与した時、投与後24時間までの未変化体の尿中排泄率は投与量の9.63%(日本人)、及び7.08%(外国人)であった。
16.5.2 小児吸入投与
小児に10mgを単回吸入投与した時、投与後8時間までの未変化体の尿中排泄率は約5%であった(外国人データを含む)。
16.5.3 静脈内投与
健康成人に50mg〜600mgを単回静脈内投与注)した時、投与後24時間までの未変化体の尿中排泄率は投与量の約85〜95%で、ほとんど代謝を受けず、主に腎を介して尿中に排泄された1)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
健康成人に比較して、重度の腎機能障害患者(CLcr:25mL/min未満)でT1/2が約5倍延長し、AUC0-∞は約7倍増加した。この重度腎機能障害患者に通常用量(1回10mg、1日2回)を5日間吸入投与した時に推定されるAUCは、健康成人に600mgを1日2回5日間静脈内投与注)し忍容性を認めた時のAUC(73110ng・hr/mL)の約40分の1であった(外国人データ)。このことから、海外では投与量の調整を行う必要はないとされているが、腎機能障害患者を対象とした国内臨床試験は行われていない。[9.2参照]
16.6.2 肝機能障害患者
本薬は肝で代謝されない。なお、肝機能障害患者における本剤の薬物動態は検討されていない。
16.6.3 高齢者
高齢者6例に20mg注)を単回吸入投与した時の血中薬物動態は、健康成人と比較してTmax及びT1/2に変化を認めず、Cmaxは約1.5倍、AUCは約1.6倍高かった。なお、海外では、本薬の主要排泄経路が腎であり、腎機能障害患者において投与量の調整の必要はないことから、高齢者においても投与量の調整は必要ないとされている。
16.6.4 小児
小児に10mgを単回吸入投与した時の薬物動態パラメータを以下に示した。
| Cmax(ng/mL) | Tmax(hr) | AUCinf(ng・hr/mL) | T1/2(hr) | |
| 日本人(10例) | 30.5±11.5 | 0.8±0.3 | 133.5±51.3 | 2.2±0.5 |
| 外国人(11例) | 44.1±14.8 | 1.0±0.4 | 182.7±68.0 | 2.0±0.3 |
注)本剤を治療に用いる場合の承認用法及び用量は、1回10mg、1日2回5日間の吸入投与である。本剤を予防に用いる場合の承認用法及び用量は、1回10mg、1日1回10日間の吸入投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<治療>
17.1.1 国内第II相試験(成人)
ザナミビル吸入(20mg、40mg/日注))5日間投与において、主要評価項目である主要な3症状(発熱、頭痛及び筋肉痛)の軽減(発熱は腋窩体温が37.0℃未満、頭痛及び筋肉痛は「ほとんど気にならない」又は「症状がない」の状態が24時間以上持続した場合を軽減と定義)した率をプラセボを対照に二重盲検法により比較した。登録された333例の内、同意撤回又は有効性のデータが評価できない15例を除いた318例を有効性解析対象例として解析した結果、軽減の中央値はいずれの群も4.0日で統計学的に有意な差は見られなかった。なお、治験実施計画書から逸脱した症例数は89例(26.7%)であった。
| 薬剤群 | 累積軽減率(軽減人数) | ||||||||
| 初診日 | 2日目 | 3日目 | 4日目 | 5日目 | 6日目 | 7日目 | 8日目 | 9日目 | |
| プラセボ (107例) | 0.9 (1例) | 10.3 (10例) | 27.1 (18例) | 56.1 (31例) | 74.8 (20例) | 86.0 (12例) | 87.9 (2例) | 93.5 (6例) | 96.3 (3例) |
| ザナミビル20mg/日群 (101例) | 4.0 (4例) | 13.9 (10例) | 32.7 (19例) | 62.4 (30例) | 78.2 (16例) | 86.1 (8例) | 94.1 (8例) | 97.0 (3例) | 97.0 (0例) |
| ザナミビル40mg/日注)群 (110例) | 0.0 (0例) | 13.6 (15例) | 35.5 (24例) | 58.2 (25例) | 78.2 (22例) | 87.3 (10例) | 90.0 (3例) | 94.6 (5例) | 94.6 (0例) |
日内最高体温は、2日目及び3日目においてザナミビル吸入投与はプラセボに比し速やかな低下がみられた。
日内最高体温の推移
また、副次的評価項目である主要な5症状(発熱、頭痛、筋肉痛、咳及び咽頭痛)について、インフルエンザウイルスの感染が確認された症例における軽減の推移を示した。
| 薬剤群 | 累積軽減率(軽減人数) | ||||||||
| 初診日 | 2日目 | 3日目 | 4日目 | 5日目 | 6日目 | 7日目 | 8日目 | 9日目 | |
| プラセボ (54例) | 0.0 (0例) | 3.7 (2例) | 5.6 (1例) | 20.4 (8例) | 35.2 (8例) | 46.3 (6例) | 57.4 (6例) | 61.1 (2例) | 64.8 (2例) |
| ザナミビル20mg/日群 (55例) | 0.0 (0例) | 3.6 (2例) | 14.6 (6例) | 25.5 (6例) | 32.7 (4例) | 45.5 (7例) | 60.0 (8例) | 69.1 (5例) | 78.2 (5例) |
| ザナミビル40mg/日注)群 (63例) | 0.0 (0例) | 6.4 (4例) | 20.6 (9例) | 33.3 (8例) | 52.4 (12例) | 66.7 (9例) | 74.6 (5例) | 79.4 (3例) | 84.1 (3例) |
ザナミビル20mg/日群における投与期間中の副作用発現頻度は6.8%(7/103例)であった。主な副作用は、動悸が1.9%(2/103例)、発汗、背部痛、耳鳴、喘鳴及び発熱がそれぞれ1.0%(1/103例)であった。また、投与終了後22日目までの副作用発現率は1.0%(1/103例)であり、発疹及び四肢浮腫がそれぞれ1.0%(1/103例)であった。
注)本剤を治療に用いる場合の承認用法及び用量は、1回10mg、1日2回5日間の吸入投与である。
17.1.2 海外第III相試験(成人)
(1)南半球における臨床試験
ザナミビル20mg/日吸入における症状の軽減の速さを、投与した全例の集団、インフルエンザウイルスの感染が確認された集団について二重盲検法によりプラセボを対照として比較した。なお、発熱がなくなり(口腔内体温37.8℃未満かつ発熱感無)、頭痛、筋肉痛、咽頭痛及び咳が「軽症」又は「症状無」の状態が24時間以上持続した場合を軽減と定義した。ザナミビル群はプラセボ群に比し有意に速い軽減がみられた。
| 解析集団/実施地域 | 軽減に要した日数の中央値 | |
| ザナミビル20mg/日群 | プラセボ群 | |
| 投与された全例 | 5.0日(227例) | 6.5日(228例) |
| インフルエンザウイルスの感染が確認された集団 | 4.5日(161例) | 6.0日(160例) |
A型あるいはB型インフルエンザウイルスの感染が確認された患者における発熱、頭痛、筋肉痛、咽頭痛及び咳症状の軽減に要した日数(中央値)を以下に示した。
| インフルエンザウイルスの型 | ザナミビル20mg/日群 | プラセボ群 | 日数の差 |
| A型 | 4.5日(105例) | 6.5日(109例) | 2.0日 |
| B型 | 4.5日(56例) | 6.0日(51例) | 1.5日 |
副次的な評価項目として、インフルエンザにおける一般的な症状である咳と発熱の軽減及び二次的な合併症(気管支炎、肺炎及び副鼻腔炎等)の併発率について以下に示した。
| 咳の軽減日 | 発熱の軽減日 | 合併症併発率注1) | |||
| ザナミビル20mg/日群 | プラセボ群 | ザナミビル20mg/日群 | プラセボ群 | ザナミビル20mg/日群 | プラセボ群 |
| 3.0日 | 3.8日 | 1.0日 | 1.5日 | 24% | 30% |
ザナミビル20mg/日群における投与中の有害事象発現頻度は37%(83/227例)であった。主な有害事象は、副鼻腔炎が4%(10/227例)、咳が4%(8/227例)、気管支炎及び下気道感染症が3%(7/227例)であった。また、投与後の有害事象発現頻度は15%(33/227例)であり、咳が2%(4/227例)、気管支炎及び副鼻腔炎が1%(3/227例)であった。
(2)欧州における臨床試験
ザナミビル20mg/日吸入における症状の軽減の速さを、投与した全例の集団、インフルエンザウイルスの感染が確認された集団について二重盲検法によりプラセボを対照として比較した。なお、インフルエンザ症状の軽減は南半球の試験と同様に定義した。ザナミビル群はプラセボ群に比し有意に速い軽減がみられた。
| 解析集団/実施地域 | 軽減に要した日数の中央値 | |
| ザナミビル20mg/日群 | プラセボ群 | |
| 投与された全例 | 5.0日(174例) | 7.5日(182例) |
| インフルエンザウイルスの感染が確認された集団 | 5.0日(136例) | 7.5日(141例) |
A型あるいはB型インフルエンザウイルスの感染が確認された患者における発熱、頭痛、筋肉痛、咽頭痛及び咳症状の軽減に要した日数(中央値)を以下に示した。
| インフルエンザウイルスの型 | ザナミビル20mg/日群 | プラセボ群 | 日数の差 |
| A型 | 5.0日(132例) | 7.5日(133例) | 2.5日 |
| B型 | 7.5日(4例) | 14.0日(8例) | 6.5日 |
副次的な評価項目として、インフルエンザにおける一般的な症状である咳と発熱の軽減及び二次的な合併症(気管支炎、肺炎及び副鼻腔炎等)の併発率について以下に示した。
| 咳の軽減日 | 発熱の軽減日 | 合併症併発率注1) | |||
| ザナミビル20mg/日群 | プラセボ群 | ザナミビル20mg/日群 | プラセボ群 | ザナミビル20mg/日群 | プラセボ群 |
| 3.0日 | 4.0日 | 1.5日 | 2.0日 | 24% | 33% |
ザナミビル20mg/日群における投与中の有害事象発現頻度は25%(44/174例)であった。主な有害事象は、嘔気・嘔吐、副鼻腔炎及び気管支炎が2%(4/174例)、下痢及び咽頭炎が2%(3/174例)であった。また、投与後の有害事象発現頻度は20%(34/174例)であり、気管支炎が5%(9/174例)、副鼻腔炎が3%(5/174例)、咳が2%(4/174例)、鼻炎が2%(3/174例)であった。
(3)北米における臨床試験
ザナミビル20mg/日吸入における症状の軽減の速さを、投与した全例の集団、インフルエンザウイルスの感染が確認された集団について二重盲検法によりプラセボを対照として比較した。なお、インフルエンザ症状の軽減は南半球の試験と同様に定義した。その結果、ザナミビル群とプラセボ群の間に統計学的に有意な差はみられなかった。
| 解析集団/実施地域 | 軽減に要した日数の中央値 | |
| ザナミビル20mg/日群 | プラセボ群 | |
| 投与された全例 | 5.5日(412例) | 6.0日(365例) |
| インフルエンザウイルスの感染が確認された集団 | 5.0日(312例) | 6.0日(257例) |
A型あるいはB型インフルエンザウイルスの感染が確認された患者における発熱、頭痛、筋肉痛、咽頭痛及び咳症状の軽減に要した日数(中央値)を以下に示した。
| インフルエンザウイルスの型 | ザナミビル20mg/日群 | プラセボ群 | 日数の差 |
| A型 | 5.0日(307例) | 6.0日(251例) | 1.0日 |
| B型 | 4.5日(3例) | 13.5日(5例) | 9.0日 |
副次的な評価項目として、インフルエンザにおける一般的な症状である咳と発熱の軽減及び二次的な合併症(気管支炎、肺炎及び副鼻腔炎等)の併発率について以下に示した。
| 咳の軽減日 | 発熱の軽減日 | 合併症併発率注1) | |||
| ザナミビル20mg/日群 | プラセボ群 | ザナミビル20mg/日群 | プラセボ群 | ザナミビル20mg/日群 | プラセボ群 |
| 3.0日 | 4.5日 | 1.5日 | 1.5日 | 15% | 22% |
ザナミビル20mg/日群における投与中の有害事象発現頻度は31%(126/412例)であった。主な有害事象は、下痢が5%(19/412例)、気管支炎が4%(15/412例)、嘔気・嘔吐及び副鼻腔炎が3%(12/412例)であった。また、投与後の有害事象発現頻度は26%(106/412例)であり、嘔気・嘔吐及び副鼻腔炎が3%(13/412例)、頭痛が3%(12/412例)、下痢が1%(6/412例)であった。
17.1.3 国内第III相試験(小児)
5〜14歳までの小児を対象とし、ザナミビル吸入(20mg/日)5日間投与による治療投与試験(Open試験)を実施した。主要評価項目であるインフルエンザ主要症状の軽減[体温(腋窩)37.5℃未満、咳「なし」又は「軽度」、頭痛、咽頭痛、熱感・悪寒、筋肉・関節痛が「なし/気にならない程度」の状態が24時間以上持続した場合を軽減と定義]までに要した日数(中央値)は4.0日であった。
副作用発現頻度は2%(3/145例)であり、口内炎、顔面浮腫(口唇の腫脹)及びそう痒症(全身そう痒感)が各1%未満(1/145例)であった。
副作用発現頻度は2%(3/145例)であり、口内炎、顔面浮腫(口唇の腫脹)及びそう痒症(全身そう痒感)が各1%未満(1/145例)であった。
17.1.4 海外第III相試験(小児)
5〜12歳までの小児を対象とした治療投与試験3)を、成人を対象とした治療投与試験と同様の用法及び用量(ザナミビル20mg/日吸入、5日間投与)で実施した。主要評価項目であるインフルエンザ主要症状の軽減[体温(耳内)37.8℃未満、咳「なし」又は「軽度」、筋肉痛・関節痛、咽頭痛、熱感・悪寒及び頭痛「なし/少々症状あるが気にならない」の状態が24時間以上持続した場合を軽減と定義]までに要した日数(中央値)は、インフルエンザウイルスの感染が確認された集団において、ザナミビル投与群がプラセボ投与群に比し有意に短かった(p<0.001)。
| 解析集団 | ザナミビル20mg/日群 | プラセボ群 | 日数の差 | P値 (95%信頼区間) |
| インフルエンザウイルスの感染が確認された症例 | 4.0日(164例) | 5.25日(182例) | 1.25日 | <0.001 (0.5,2.0) |
ザナミビル20mg/日群の副作用発現頻度は3%(7/224例)であり、下痢、消化不良、嘔気、嘔吐、嗄声、浮動性めまい、胸痛及び皮膚炎がそれぞれ1%未満(1/224例)であった。
<予防>
17.1.5 国内第III相試験(成人)
18歳以上の医療機関の従事者を対象とし、ザナミビル吸入(10mg/日)28日間投与注)による予防試験(プラセボを対照とした二重盲検群間比較試験)を実施した。その結果、インフルエンザ様症状の発現(発熱(37.5℃以上)、発熱感、咳、頭痛、咽頭痛、筋肉・関節痛のうち2つ以上の症状の発現)及びインフルエンザウイルス感染が確認された患者の割合は、ザナミビル群1.9%(3/160例)、プラセボ群3.8%(6/156例)であった(p=0.331)。
ザナミビル群の副作用発現率は1%未満(1/161例)であり、好酸球数増加1%未満(1/161例)であった。
ザナミビル群の副作用発現率は1%未満(1/161例)であり、好酸球数増加1%未満(1/161例)であった。
17.1.6 海外第III相試験(家族内感染)
(1)NAI30010試験では、家族内においてインフルエンザウイルス感染症患者が確認されてから家族全員(5歳以上)をザナミビル10mg1日1回又はプラセボ1日1回、10日間吸入のいずれかに割り付け、予防効果を比較した。本試験では初発症例も接触症例と同一の投与群にランダム化された。その結果、インフルエンザ様症状の発現(口腔体温37.8℃以上又は発熱感、咳、頭痛、咽頭痛、筋肉痛のうち2つ以上の症状の発現)及びインフルエンザウイルス感染が確認された患者が1例以上認められた家族の割合は、ザナミビル10mg/日群4%(7/169家族)及びプラセボ群19%(32/168家族)であり、ザナミビル10mg/日群はプラセボ群に比し有意な予防効果を示した(p<0.001)。
(2)NAI30031試験では、家族内においてインフルエンザウイルス感染症患者が確認されてから家族全員(5歳以上)をザナミビル10mg1日1回又はプラセボ1日1回、10日間吸入のいずれかに割り付け、予防効果を比較した。本試験では初発症例に対する抗ウイルス薬によるインフルエンザ治療は実施されていない。その結果、インフルエンザ様症状の発現(口腔体温37.8℃以上又は発熱感、咳、頭痛、咽頭痛、筋肉痛のうち2つ以上の症状の発現)及びインフルエンザウイルス感染が確認された患者が1例以上認められた家族の割合は、ザナミビル10mg/日群4%(10/245家族)及びプラセボ群19%(46/242家族)であり、ザナミビル10mg/日群はプラセボ群に比し有意な予防効果を示した(p<0.001)。
17.1.7 海外第III相試験(地域内感染)
(1)NAIA3005試験では、インフルエンザウイルス感染症の発生が認められている地域を対象に、共通の大学に属する18歳以上の者を対象としてザナミビル10mg1日1回又はプラセボ1日1回、28日間吸入注)のいずれかに割り付け、予防効果を比較した。その結果、インフルエンザ様症状の発現(口腔体温37.8℃以上又は発熱感、咳、頭痛、咽頭痛、筋肉痛のうち2つ以上の症状の発現)及びインフルエンザウイルス感染が確認された患者の割合は、ザナミビル10mg/日群2.0%(11/553例)及びプラセボ群6.1%(34/554例)であり、ザナミビル10mg/日群はプラセボ群に比し有意な予防効果を示した(p<0.001)。
(2)NAI30034試験では、インフルエンザウイルス感染症の発生が認められている地域を対象に、共通のコミュニティーに属する高齢者(65歳以上)、糖尿病を有する患者、慢性呼吸器疾患又は慢性心疾患患者等のハイリスク患者を対象としてザナミビル10mg1日1回又はプラセボ1日1回、28日間吸入注)のいずれかに割り付け、予防効果を比較した。その結果、インフルエンザ様症状の発現(口腔体温37.8℃以上又は発熱感、咳、頭痛、咽頭痛、筋肉痛のうち2つ以上の症状の発現)及びインフルエンザウイルス感染が確認された患者の割合は、ザナミビル10mg/日群0.2%(4/1678例)及びプラセボ群1.4%(23/1685例)であり、ザナミビル10mg/日群はプラセボ群に比し有意な予防効果を示した(p<0.001)。
17.1.8 海外第III相試験(介護施設内感染)
(1)米国における臨床試験
インフルエンザウイルス感染症の発生が認められている介護施設の入所者を対象に、ザナミビル10mg1日1回又は対照群1日1回、14日間投与注)のいずれかに割り付け、予防効果を比較した。その結果、新たな症状又は症候を発現し、インフルエンザウイルス感染が確認された患者の割合は、以下のとおりであった。
| 試験 | ザナミビル10mg/日群 | 対照群注1) | P値 |
| NAIA3003 | 4%(7/184例) | 8%(16/191例) | 0.085 |
ザナミビル群の副作用発現率は34%(80/238例)であった。主な副作用は咳嗽7%(17/238例)、消化管徴候・症状5%(13/238例)、便秘5%(12/238例)、頭痛5%(11/238例)、鼻の徴候・症状5%(11/238例)であった。
(2)欧州における臨床試験
インフルエンザウイルス感染症の発生が認められている介護施設の入所者を対象に、ザナミビル10mg1日1回又は対照群1日1回、14日間投与注)のいずれかに割り付け、予防効果を比較した。その結果、新たな症状又は症候を発現し、インフルエンザウイルス感染が確認された患者の割合は、以下のとおりであった。
| 試験 | ザナミビル10mg/日群 | 対照群注1) | P値 |
| NAIA3004 | 6%(15/240例) | 9%(23/249例) | 0.355 |
ザナミビル群の副作用発現率は7%(16/242例)であった。主な副作用は咽喉・扁桃の不快感・疼痛2%(4/242例)、咳嗽、鼻の徴候・症状、悪心・嘔吐が1%未満(1/242例)であった。
注)本剤を予防に用いる場合の承認用法及び用量は、1回10mg、1日1回10日間の吸入投与である。
17.1.9 海外臨床試験(ハイリスク患者)
(1)慢性呼吸器疾患(喘息/慢性閉塞性肺疾患)を基礎疾患に持つ患者での臨床試験
南半球、欧州及び北米にて、気管支喘息又は慢性閉塞性肺疾患(以下COPD)を基礎疾患にもつインフルエンザウイルス感染患者を対象とした試験が実施された。
発熱、頭痛、筋肉痛、咽頭痛及び咳の5症状の全ての症状が軽減するのに要した日数を指標として、ザナミビル(20mg/日吸入)の有効性を、プラセボを対照として評価した。評価には、インフルエンザウイルスの感染が確認された症例と試験薬が割り付けられた全例を用いた。その結果、試験薬が割り付けられた全例では、ザナミビル群はプラセボ群に比し軽減までの所要日数を1.0日短縮していたが、統計学的有意差は検出されなかった。なお、インフルエンザウイルスの感染が確認された症例でザナミビル群はプラセボ群に比し、1.5日(p=0.009)の有意な短縮がみられた。
発熱、頭痛、筋肉痛、咽頭痛及び咳の5症状の全ての症状が軽減するのに要した日数を指標として、ザナミビル(20mg/日吸入)の有効性を、プラセボを対照として評価した。評価には、インフルエンザウイルスの感染が確認された症例と試験薬が割り付けられた全例を用いた。その結果、試験薬が割り付けられた全例では、ザナミビル群はプラセボ群に比し軽減までの所要日数を1.0日短縮していたが、統計学的有意差は検出されなかった。なお、インフルエンザウイルスの感染が確認された症例でザナミビル群はプラセボ群に比し、1.5日(p=0.009)の有意な短縮がみられた。
| 解析集団 | ザナミビル20mg/日群 | プラセボ群 | 日数の差 | P値 |
| 試験薬を割り付けた全例 | 6.0日(262例) | 7.0日(263例) | 1.0日 | 0.123 |
| インフルエンザウイルスの感染が確認された集団 | 5.5日(160例) | 7.0日(153例) | 1.5日 | 0.009 |
有害事象の発現率は、投与中においてプラセボ群42%(111/263例)、ザナミビル群38%(99/261例)、投与後においてプラセボ群35%(92/263例)、ザナミビル群43%(112/261例)といずれも両群で同程度であった。薬剤に関連があると判定された有害事象は、投与中においてプラセボ群9%(23/263例)、ザナミビル群9%(23/261例)であり、投与後においてプラセボ群2%(6/263例)、ザナミビル群1%未満(2/261例)であった。
主な有害事象は喘息、副鼻腔炎、気管支炎であり、両群間に差は認められなかった。
主な有害事象は喘息、副鼻腔炎、気管支炎であり、両群間に差は認められなかった。
肺機能に対するザナミビルの影響を喘息又はCOPDを基礎疾患にもつインフルエンザウイルス感染患者を対象にプラセボを対照として評価した。肺機能の指標として、試験期間中の朝と夜の最大呼気流量(PEFR)の変化量(患者測定)と1秒量(FEV1.0)(1日目、6日目、28日目に医療機関にて測定)を用いた。ザナミビル吸入中の最大呼気流量(PEFR)の平均値は、プラセボに比し良好に推移し、投与開始後6日目及び28日目で肺機能が投与開始前より1秒量(FEV1.0)あるいは最大呼気流量(PEFR)が20%を超えて低下した患者の頻度はザナミビル群とプラセボ群間に差はみられなかった。
(2)ハイリスク患者での臨床試験
ハイリスクと定義されている患者(65歳以上、慢性呼吸器疾患、高血圧を除く心循環器系疾患、糖尿病、免疫不全状態のいずれかに該当)の集団を、南半球、欧州及び北米の臨床第III相試験(3試験)、欧州及び北米で実施された小児臨床試験、南半球での臨床第II相試験、予防検討のための家族内予防試験(予防試験に組み入れの後インフルエンザウイルス感染症に罹患した患者)から抽出し、ザナミビル20mg/日吸入投与群について、投与された全例及びインフルエンザウイルスの感染が確認された症例につきプラセボを対照として比較した。
ザナミビル群の発熱、頭痛、筋肉痛、咽頭痛及び咳の5症状の全ての症状が軽減に要する日数は、プラセボ群に比し、投与された全例で1.5日(p=0.046)、インフルエンザウイルスの感染が確認された症例で2.5日(p=0.015)の有意な短縮がみられた。
ザナミビル群の発熱、頭痛、筋肉痛、咽頭痛及び咳の5症状の全ての症状が軽減に要する日数は、プラセボ群に比し、投与された全例で1.5日(p=0.046)、インフルエンザウイルスの感染が確認された症例で2.5日(p=0.015)の有意な短縮がみられた。
| 解析集団 | ザナミビル20mg/日群 | プラセボ群 | 日数の差 | P値 |
| 投与された全例 | 5.5日(154例) | 7.0日(167例) | 1.5日 | 0.046 |
| インフルエンザウイルスの感染が確認された集団 | 5.0日(105例) | 7.5日(122例) | 2.5日 | 0.015 |
また、抗生物質による治療を必要とする二次的な合併症の発現率は、投与された全例では、ザナミビル群で16%(24/154例)に対し、プラセボ群では25%(41/167例)、インフルエンザウイルスの感染が確認された集団では、ザナミビル群で13%(14/105例)に対しプラセボ群では24%(29/122例)であり、ザナミビル群における発現率は有意に低かった(投与された全例p=0.042、インフルエンザウイルスの感染が確認された症例p=0.045)。
| 解析集団 | ザナミビル20mg/日群 | プラセボ群 | 相対リスク | P値 |
| 投与された全例 | 16%(24/154例) | 25%(41/167例) | 0.63 | 0.042 |
| インフルエンザウイルスの感染が確認された集団 | 13%(14/105例) | 24%(29/122例) | 0.57 | 0.045 |
有害事象の発現率は、ザナミビル群で39%(60/154例)、プラセボ群で43%(72/167例)であった。最も多くみられた事象は「喘息症状の悪化/喘息症状の増加」であり、ザナミビル群で7%(11/154例)、プラセボ群で14%(24/167例)であった。
| 有害事象 | プラセボ群 167例 | ザナミビル20mg/日群 154例 | |
| 有害事象発現例数 | 72例(43%) | 60例(39%) | |
| 喘息症状の悪化/喘息症状の増加 | 24例(14%) | 11例(7%) | |
| 気管支炎 | 11例(7%) | 7例(5%) | |
| 嘔吐 | 5例(3%) | 5例(3%) | |
| めまい | 3例(2%) | 5例(3%) | |
| 肺炎 | 1例(<1%) | 6例(4%) | |
| 下気道感染症 | 5例(3%) | 0例 | |
| 咳 | 6例(4%) | 0例 | |
また、ハイリスク患者のうち慢性呼吸器疾患を有している集団(ザナミビル群109例、プラセボ群113例)での有害事象の発現率は、ザナミビル群で41%(45/109例)、プラセボ群で45%(51/113例)、65歳以上の高齢者の集団(ザナミビル群36例、プラセボ群40例)においては、ザナミビル群で39%(14/36例)、プラセボ群で45%(18/40例)と、いずれの集団においてもザナミビル群はプラセボ群を上回らなかった。
17.2 製造販売後調査等
17.2.1 使用成績調査
インフルエンザウイルス感染症の治療に関する使用成績調査における安全性及び有効性は以下のとおりである。
| 有効性注2) | |
| 解析対象全症例 | 97.2%(4041/4159例) |
| ハイリスク患者以外 | 97.2%(3643/3747例) |
| ハイリスク患者注1) | 96.6%(398/412例) |
| ハイリスク因子高齢者(65歳以上) | 96.7%(204/211例) |
| ハイリスク因子慢性呼吸器疾患(気管支喘息、COPDを含む) | 96.0%(169/176例) |
| ハイリスク因子循環器系疾患(高血圧を除く) | 100.0%(28/28例) |
| ハイリスク因子糖尿病 | 98.0%(50/51例) |
| ハイリスク因子慢性腎不全 | 100.0%(3/3例) |
| 年齢〜5歳未満 | 100.0%(44/44例) |
| 年齢5歳〜15歳未満 | 98.1%(418/426例) |
| 年齢15歳〜65歳未満 | 97.0%(3375/3478例) |
17.2.2 特定使用成績調査
(1)治療
インフルエンザウイルス感染症に対する本剤の有効性を確認するために、インフルエンザ迅速診断キットの検査結果が陽性であった15歳以上の成人患者及び15歳未満の小児患者を対象とした特定使用成績調査をそれぞれ実施した。インフルエンザ主要症状軽減及び解熱の所要日数(中央値)は以下のとおりである。
| 評価項目 | 所要日数(中央値) | |
| 成人(15歳以上) | 小児(2〜15歳未満) | |
| インフルエンザ主要症状注1)軽減 | 3日(421例) | 2日(334例) |
| 解熱 | 2日(387例) | 2日(430例) |
(2)予防
インフルエンザウイルス感染症の予防に関する有効性を確認するために、インフルエンザを発症している患者の同居家族あるいは共同生活者を対象とした調査を行った。その結果、本剤予防投与群及び非本剤予防投与群でのインフルエンザ発症率注1)はそれぞれ1.13%(3/266例)及び5.06%(16/316例)であった。
注1)発熱(37.5℃以上)、さむけ・発汗、頭痛、のどの痛み、筋肉又は関節の痛み、咳のうち2症状以上が継続して1.5日以上みられ、かつ迅速診断キット陽性の患者の割合
18. 薬効薬理
18.1 作用機序
ザナミビルは、インフルエンザウイルス表面に存在する酵素ノイラミニダーゼの選択的な阻害薬であり4)、A型インフルエンザウイルスで知られている全てのサブタイプのノイラミニダーゼ及びB型インフルエンザウイルスのノイラミニダーゼを阻害した5)6)。ウイルスノイラミニダーゼは新しく産生されたウイルスが感染細胞から遊離するのに必要であり、さらに、ウイルスが粘膜を通って気道の上皮細胞に接近するのにも必要である可能性がある。ザナミビルは細胞外から作用し、この酵素を阻害することで気道の上皮細胞から感染性のインフルエンザウイルスが遊離するのを阻害し、A型及びB型インフルエンザウイルスの感染の拡大を阻止すると考えられる。
18.2 抗ウイルス作用
18.2.1 In vitro試験
A型あるいはB型インフルエンザウイルスを感染させたMadin Darbyイヌ腎臓細胞に対して、ザナミビルは用量依存的な抗ウイルス作用を示し、そのIC50値はA型に対して0.004μM〜16μM、B型に対して0.005μM〜1.3μM、IC90値はA型に対して0.065μM〜>100μM、B型に対して0.065μM〜8.6μMであった。
18.2.2 In vivo試験
18.3 耐性
急性インフルエンザウイルス感染に対するザナミビルの効果を検討した海外第II相9)及び第III相臨床試験10)並びに予防効果を検討した海外臨床試験11)で、300例以上の患者から分離したインフルエンザウイルス株においてザナミビルに対する感受性の低下した株は認められなかった。これまでのところ、B型インフルエンザウイルス感染症の免疫力の低下した小児にザナミビルを2週間投与した1症例において、ザナミビル耐性株発現の報告がある12)。
国内において成人及び小児患者を対象にザナミビルに耐性を示すインフルエンザウイルス出現に関する調査を行った(2001年〜2005年シーズン:成人、2006年〜2009年シーズン:小児)。その結果、本剤投与前又は投与後に分離・同定した580例の患者のインフルエンザウイルス株のIC50値より、ザナミビル耐性が示唆される株は認められなかった。
国内において成人及び小児患者を対象にザナミビルに耐性を示すインフルエンザウイルス出現に関する調査を行った(2001年〜2005年シーズン:成人、2006年〜2009年シーズン:小児)。その結果、本剤投与前又は投与後に分離・同定した580例の患者のインフルエンザウイルス株のIC50値より、ザナミビル耐性が示唆される株は認められなかった。
19. 有効成分に関する理化学的知見
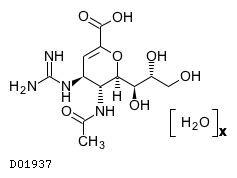
19.1. ザナミビル水和物
21. 承認条件
本剤の耐性化の調査結果は、随時、規制当局に報告すること。
22. 包装
(4ブリスター×5)×1
23. 主要文献
- Cass LMR,et al., Clin Pharmacokinet., 36 (Suppl.1), 1-11, (1999)
- Daniel MJ,et al., Clin Pharmacokinet., 36 (Suppl.1), 41-50, (1999)
- Hedrick JA,et al., Pediatr Infect Dis J., 19, 410-417, (2000) »PubMed
- von Itzstein M,et al., Nature., 363, 418-423, (1993) »PubMed
- Woods JM,et al., Antimicrob Agents Chemother., 37, 1473-1479, (1993) »PubMed
- Gubareva LV,et al., Virology., 212, 323-330, (1995) »PubMed
- Ryan DM,et al., Antimicrob Agents Chemother., 38, 2270-2275, (1994) »PubMed
- Ryan DM,et al., Antimicrob Agents Chemother., 39, 2583-2584, (1995) »PubMed
- Barnett JM,et al., Antimicrob Agents Chemother., 44, 78-87, (2000) »PubMed
- Boivin G,et al., J Infect Dis., 181, 1471-1474, (2000) »PubMed
- Hayden FG,et al., N Engl J Med., 343, 1282-1289, (2000) »PubMed
- Gubareva LV,et al., J Infect Dis., 178, 1257-1262, (1998) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
グラクソ・スミスクライン株式会社
メディカル・インフォメーション
東京都港区赤坂1-8-1
電話:0120-561-007(9:00〜17:45/土日祝日及び当社休業日を除く)
製品情報問い合わせ先
グラクソ・スミスクライン株式会社
メディカル・インフォメーション
東京都港区赤坂1-8-1
電話:0120-561-007(9:00〜17:45/土日祝日及び当社休業日を除く)
25. 保険給付上の注意
本剤は「A型又はB型インフルエンザウイルス感染症の発症後の治療」の目的で使用した場合にのみ保険給付される。
26. 製造販売業者等
26.1 製造販売元
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1