医薬品情報
| 総称名 | アイピーディ |
|---|---|
| 一般名 | スプラタストトシル酸塩 |
| 欧文一般名 | Suplatast Tosilate |
| 製剤名 | スプラタストトシル酸塩ドライシロップ |
| 薬効分類名 | アレルギー性疾患治療剤 |
| 薬効分類番号 | 4490 |
| KEGG DRUG |
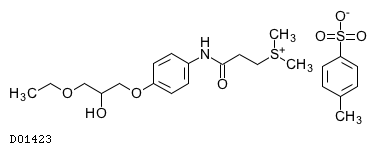
D01423
スプラタストトシル酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年2月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アイピーディドライシロップ5% | IPD dry syrup | 大鵬薬品工業 | 4490016R1020 | 27.6円/g |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、小児にはスプラタストトシル酸塩として1回3mg/kgを1日2回朝食後及び夕食後に、用時溶解して経口投与する。
なお、年齢、症状により適宜増減する。
ただし、1日投与量はドライシロップとして6.0g(スプラタストトシル酸塩として成人の通常の1日用量300mg)を超えないこと。
年齢別の標準投与量は、通常、下記の用量を1回量とし、1日2回朝食後及び夕食後に、用時溶解して経口投与する。
なお、年齢、症状により適宜増減する。
ただし、1日投与量はドライシロップとして6.0g(スプラタストトシル酸塩として成人の通常の1日用量300mg)を超えないこと。
年齢別の標準投与量は、通常、下記の用量を1回量とし、1日2回朝食後及び夕食後に、用時溶解して経口投与する。
| 年齢 | 1回投与量 |
| 3歳以上5歳未満 | 0.75g(スプラタストトシル酸塩として37.5mg) |
| 5歳以上11歳未満 | 1.5g(スプラタストトシル酸塩として75mg) |
| 11歳以上 | 2.0g(スプラタストトシル酸塩として100mg) |
7. 用法及び用量に関連する注意
高齢者では、低用量(例えば150mg/日)から投与を開始し、増量する場合は患者の副作用及び臨床症状を十分観察しながら行うこと。[9.8参照]
8. 重要な基本的注意
8.1 本剤は喘息の悪化時ばかりでなく、喘息が良好にコントロールされている場合でも継続して服用するよう、患者、保護者又はそれに代わり得る適切な者に十分説明しておくこと。
8.2 本剤は気管支拡張剤、ステロイド剤等と異なり、既に起こっている喘息発作を緩解する薬剤ではないので、このことは患者、保護者又はそれに代わり得る適切な者に十分説明しておく必要がある。
8.3 本剤を投与中、大発作をみた場合は気管支拡張剤あるいはステロイド剤を投与する必要がある。
8.4 本剤の使用によりステロイド維持量を減量し得た患者で、本剤の投与を中止する場合は原疾患再発のおそれがあるので注意すること。
8.5 本剤の使用により効果が認められない場合には漫然と長期にわたり投与しないように注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 長期ステロイド療法を受けている患者
本剤投与によりステロイドの減量をはかる場合は十分な管理下で徐々に行うこと。
9.3 肝機能障害患者
肝障害が悪化するおそれがある。[11.1.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている1)。
9.7 小児等
低出生体重児又は新生児を対象とした臨床試験は実施していない。
9.8 高齢者
一般に、生理機能が低下していることが多い。[7.参照]
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害
黄疸(頻度不明)、ALT上昇、AST上昇、γ-GTP上昇、Al-P上昇、LDH上昇等の肝機能障害(0.1%未満)(初期症状:全身倦怠感、食欲不振、発熱、嘔気等)があらわれることがある。[9.3参照]
11.1.2 ネフローゼ症候群(頻度不明)
注)発現頻度には使用成績調査を含め、ドライシロップとカプセル剤の合計から算出。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 消化器 | 胃部不快感、嘔気、胃痛、下痢 | 口渇、食欲不振、口内炎、腹痛、嘔吐、腹部膨満感、舌のあれ | |
| 精神神経系 | 眠気 | 頭痛、痙攣、振戦、めまい、しびれ | |
| 血液 | 好酸球増多 | 白血球減少 | |
| 過敏症 | 発疹、そう痒感 | 蕁麻疹 | |
| 肝臓 | AST上昇、ALT上昇、γ-GTP上昇、LDH上昇 | ビリルビン上昇、Al-P上昇 | |
| 泌尿器 | 蛋白尿、頻尿 | ||
| その他 | 生理不順、倦怠感・脱力感 | 浮腫、耳鳴、眼瞼乾燥感、発熱、ほてり、鼻出血、味覚異常、口臭 | 動悸、咳、胸部圧迫感 |
12. 臨床検査結果に及ぼす影響
本剤の投与はアレルゲン皮内反応を抑制し、アレルゲンの確認に支障をきたすので、アレルゲン皮内反応検査を実施する前は本剤を投与しないこと。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は水道水に溶かして放置した場合、製剤が不安定になることから、患者が服用する際に溶解すること。また、溶解後は速やかに使用すること。
14.1.2 配合変化
他剤との配合により本剤の含量低下等の変化が起こることがあるので、他剤との配合には注意すること。
なお、現在までに次の薬剤との配合変化が確認されているため、配合しないこと。
なお、現在までに次の薬剤との配合変化が確認されているため、配合しないこと。
(1)混合により本剤の含量が低下するもの
クラリスドライシロップ小児用(クラリスロマイシン)、バナンドライシロップ(セフポドキシム プロキセチル)、アトックドライシロップ(ホルモテロールフマル酸塩水和物)、ネオフィリン末(アミノフィリン水和物)、エリスロシンドライシロップ(エリスロマイシンエチルコハク酸エステル)、ミオカマイシンドライシロップ(ミデカマイシン酢酸エステル)、ジスロマック細粒小児用(アジスロマイシン水和物)
(2)混合により塊になるもの
ビソルボン細粒(ブロムヘキシン塩酸塩)、アスベリンドライシロップ(チペピジンヒベンズ酸塩)、フロモックス小児用細粒(セフカペン ピボキシル塩酸塩水和物)、セフスパン細粒(セフィキシム)、スピロペント顆粒(クレンブテロール塩酸塩)
(3)混合により特異なにおいが発生するもの
オノンドライシロップ(プランルカスト水和物)、アレギサールドライシロップ(ペミロラストカリウム)、ベラチンドライシロップ(ツロブテロール塩酸塩)
15. その他の注意
15.1 臨床使用に基づく情報
スプラタストトシル酸塩からジメチルスルフィドが生じ、口臭が発現することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 小児
小児気管支喘息患者にスプラタストトシル酸塩3mg/kg/回を食後に経口投与し、血漿中のスプラタスト(塩基)及びその代謝物を測定した。
(1)単回投与
スプラタスト(塩基)及びその脱ジメチルスルフィド体である4-(3-エトキシ-2-ヒドロキシプロポキシ)アクリルアニリド(以下M-1と略す。)の血漿中濃度は図のごとく推移した2)。
| Tmax(hr) | Cmax(ng/mL) | AUC(0-24hr)(ng・hr/mL) | T1/2(hr) | |
| スプラタスト(塩基) | 2.7±0.5 | 59.6±18.7 | 407.4±105.3 | 3.0±0.3 |
| M-1 | 4.6±1.8 | 9.0±3.4 | 105.1±29.3 | − |
(2)反復投与
1日目は1回、2日目以降は1日2回、計8日間の反復経口投与におけるスプラタスト(塩基)の血漿中濃度は2日目以降ほぼ定常状態に達した。また、M-1は4日目で既に定常状態に達していた2)。
16.1.2 成人
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
18.2 抗アレルギー作用
18.2.1 気道反応性亢進抑制作用
18.2.2 実験的喘息抑制作用
18.2.3 好酸球浸潤抑制作用
18.2.4 インターロイキン-4(IL-4)及びインターロイキン-5(IL-5)の産生抑制作用
18.2.5 IgE抗体産生抑制作用
18.2.6 ケミカルメディエーター拮抗作用
注):臨床1日投与量を6mg/kg/dayとした場合の薬理試験における効果発現用量との比
19. 有効成分に関する理化学的知見
19.1. スプラタストトシル酸塩
20. 取扱い上の注意
アルミピロー包装やボトルの開封後は吸湿に注意すること。
22. 包装
ヒートシール(乾燥剤入り)
0.75g×56包、1.5g×56包
バラ包装(プラスチックボトル、乾燥剤入り)
100g、500g
23. 主要文献
- 桑田慶三 他, 薬物動態, 7 (4), 399-421, (1992) »DOI
- 飯倉洋治 他, アレルギー・免疫, 8 (12), 1399-1407, (2001)
- 丁宗鉄 他, 基礎と臨床, 26 (7), 3199-3215, (1992)
- 馬場實 他, 小児気管支喘息に対するIPD-DSの臨床効果−至適用量検討試験−(承認年月日:2001年6月20日、申請資料概要ト.2.(2))
- 馬場實 他, 小児気管支喘息に対するIPD-DSの長期投与による臨床的検討(承認年月日:2001年6月20日、申請資料概要ト.2.(4))
- 馬場實 他, 新薬と臨牀, 52 (4), 477-503, (2003)
- 谷口一 他, アレルギー, 47 (8), 720-725, (1998) »DOI
- Taniguchi,H.et al., Eur.J.Pharmacol., 318 (2-3), 447-454, (1996) »PubMed
- 山谷英利 他, 幼若モルモットにおけるトシル酸スプラタストの気道好酸球浸潤に対する作用(承認年月日:2001年6月20日、申請資料概要ホ.1.(3).1))
- Yamaya,H.et al., Life Sci., 56 (19), 1647-1654, (1995) »PubMed
- 浅香直正 他, Th2細胞によるマウス腹腔内細胞増多に対するトシル酸スプラタストの作用(承認年月日:2001年6月20日、申請資料概要ホ.1.(3).1))
- Yanagihara,Y.et al., Japan.J.Pharmacol., 61 (1), 23-30, (1993) »PubMed
- Yanagihara,Y.et al., Japan.J.Pharmacol., 61 (1), 31-39, (1993) »PubMed
- 浅香直正 他, Th2細胞によるマウス腹腔内サイトカイン産生に対するトシル酸スプラタストの作用(承認年月日:2001年6月20日、申請資料概要ホ.1.(3).1))
- Matsuura,N.et al., 薬理と治療, 22 (3), 1369-1383, (1994)
- 松浦直資 他, 日薬理誌, 100 (6), 485-493, (1992) »PubMed
- 山谷英利 他, 幼若モルモットにおけるトシル酸スプラタストの気道反応性亢進に対する作用(承認年月日:2001年6月20日、申請資料概要ホ.1.(2).1))
- 山谷英利 他, 成熟モルモットにおけるトシル酸スプラタストの気道反応性亢進に対する作用(承認年月日:2001年6月20日、申請資料概要ホ.1.(2).1))
- 松浦直資 他, 薬理と治療, 20 (7), 2425-2435, (1992)
- Konno,S.et al., Jpn.J.Allergol., 44 (5), 556-561, (1995) »PubMed
- 田島清孝 他, 応用薬理, 43 (6), 531-548, (1992)
- 秋澤有四郎 他, Suplatast tosilate(IPD-1151T)のchemical mediator拮抗作用,社内資料,研究報告書No.76
24. 文献請求先及び問い合わせ先
文献請求先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
製品情報問い合わせ先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
26. 製造販売業者等
26.1 製造販売元
大鵬薬品工業株式会社
東京都千代田区神田錦町1-27