医薬品情報
| 総称名 | セルシン |
|---|---|
| 一般名 | ジアゼパム |
| 欧文一般名 | Diazepam |
| 製剤名 | ジアゼパム注射液 |
| 薬効分類名 | マイナートランキライザー |
| 薬効分類番号 | 1124 |
| ATCコード | N05BA01 |
| KEGG DRUG |
D00293
ジアゼパム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| セルシン注射液5mg | CERCINE INJECTION | T’s製薬 | 1124402A1030 | 79円/管 | 向精神薬(第三種向精神薬), 処方箋医薬品注) |
| セルシン注射液10mg | CERCINE INJECTION | T’s製薬 | 1124402A2053 | 82円/管 | 向精神薬(第三種向精神薬), 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 急性閉塞隅角緑内障の患者[抗コリン作用により眼圧が上昇し、症状を悪化させることがある。]
2.2 重症筋無力症の患者[本剤の筋弛緩作用により症状が悪化するおそれがある。]
2.3 ショック、昏睡、バイタルサインの悪い急性アルコール中毒の患者[ときに頻脈、徐脈、血圧低下、循環性ショックがあらわれることがある。]
2.4 リトナビル(HIVプロテアーゼ阻害剤)、ニルマトレルビル・リトナビルを投与中の患者[10.1参照]
4. 効能または効果
○神経症における不安・緊張・抑うつ
○下記疾患及び状態における不安・興奮・抑うつの軽減
麻酔前、麻酔導入時、麻酔中、術後、アルコール依存症の禁断(離脱)症状、分娩時
○てんかん様重積状態におけるけいれんの抑制
6. 用法及び用量
本剤は、疾患の種類、症状の程度、年齢および体重などを考慮して用いる。
一般に成人には、初回2mL(ジアゼパムとして10mg)を筋肉内または静脈内に、できるだけ緩徐に注射する。以後、必要に応じて3〜4時間ごとに注射する。
一般に成人には、初回2mL(ジアゼパムとして10mg)を筋肉内または静脈内に、できるだけ緩徐に注射する。以後、必要に応じて3〜4時間ごとに注射する。
7. 用法及び用量に関連する注意
7.1 低出生体重児、新生児、乳児、幼児、小児には、筋肉内注射しないこと。
7.2 痙攣の抑制のために本剤を投与する時、特に追加投与を繰り返す際には、呼吸器・循環器系の抑制に注意すること。
8. 重要な基本的注意
8.1 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
8.2 連用により薬物依存を生じることがあるので、漫然とした継続投与による長期使用を避けること。本剤の投与を継続する場合には、治療上の必要性を十分に検討すること。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心障害のある患者
症状が悪化するおそれがある。
9.1.2 脳に器質的障害のある患者
作用が強くあらわれる。
9.1.3 衰弱患者
作用が強くあらわれる。
9.1.4 高度重症患者、呼吸予備力の制限されている患者
静脈内注射時、無呼吸、心停止が起こり易い。
9.2 腎機能障害患者
排泄が遅延するおそれがある。
9.3 肝機能障害患者
排泄が遅延するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.5.1 妊娠中に本剤の投与を受けた患者の中に奇形を有する児等の障害児を出産した例が対照群と比較して有意に多いとの疫学的調査報告がある。
9.5.2 ベンゾジアゼピン系薬剤で新生児に哺乳困難、嘔吐、活動低下、筋緊張低下、過緊張、嗜眠、傾眠、呼吸抑制・無呼吸、チアノーゼ、易刺激性、神経過敏、振戦、低体温、頻脈等を起こすことが報告されている。なお、これらの症状は、離脱症状あるいは新生児仮死として報告される場合もある。ベンゾジアゼピン系薬剤で新生児に黄疸の増強を起こすことが報告されている。また、分娩時に静脈内注射した例にSleeping babyが報告されている。
9.5.3 分娩前に連用した場合、出産後新生児に離脱症状があらわれることが、ベンゾジアゼピン系薬剤で報告されている。
9.6 授乳婦
授乳を避けさせること。ヒト母乳中へ移行し、新生児に嗜眠、体重減少等を起こすことがあり、また、黄疸を増強する可能性がある。
9.7 小児等
9.7.1 低出生体重児、新生児に使用する場合には十分注意すること。外国において、ベンジルアルコールの静脈内大量投与(99〜234mg/kg)により、中毒症状(あえぎ呼吸、アシドーシス、痙攣等)が低出生体重児に発現したとの報告がある。本剤は添加剤としてベンジルアルコールを含有している。
9.7.2 乳児、幼児では作用が強くあらわれる。
9.8 高齢者
少量から投与を開始するなど慎重に投与すること。運動失調等の副作用が発現しやすい。
10. 相互作用
10.1 併用禁忌
| リトナビル ノービア ニルマトレルビル・リトナビル パキロビッド [2.4参照] | 過度の鎮静や呼吸抑制等が起こる可能性がある。 | チトクロームP450に対する競合的阻害により、本剤の血中濃度が大幅に上昇することが予測されている。 |
10.2 併用注意
| 中枢神経抑制剤 フェノチアジン誘導体 バルビツール酸誘導体等 モノアミン酸化酵素阻害剤 オピオイド鎮痛剤 | 眠気、注意力・集中力・反射運動能力等の低下が増強することがある。 | 相互に中枢神経抑制作用を増強することが考えられている。 |
| アルコール(飲酒) | 眠気、注意力・集中力・反射運動能力等の低下が増強することがある。 | 相互に中枢神経抑制作用を増強することが考えられている。 |
| シメチジン オメプラゾール エソメプラゾール ランソプラゾール | 眠気、注意力・集中力・反射運動能力等の低下が増強することがある。 | 本剤のクリアランスがシメチジンとの併用により27〜51%、オメプラゾールとの併用により27〜55%減少することが報告されている。 本剤の代謝、排泄を遷延させるおそれがある。 |
| シプロフロキサシン | 眠気、注意力・集中力・反射運動能力等の低下が増強することがある。 | 本剤のクリアランスが37%減少することが報告されている。 |
| フルボキサミンマレイン酸塩 | 眠気、注意力・集中力・反射運動能力等の低下が増強することがある。 | 本剤のクリアランスが65%減少することが報告されている。 |
| 強いCYP3Aを阻害する薬剤 コビシスタットを含有する製剤 ボリコナゾール等 | 本剤の血中濃度が上昇する可能性がある。 | これら薬剤のCYP3A阻害作用により、本剤の代謝が阻害されるため。 |
| CYP3A4で代謝される薬剤 アゼルニジピン ホスアンプレナビル等 | 本剤又はこれらの薬剤の作用が増強されるおそれがある。 | 本剤とこれらの薬剤がCYP3A4を競合的に阻害することにより、相互のクリアランスが低下すると考えられる。 |
| エトラビリン | 本剤の血中濃度が上昇する可能性がある。 | エトラビリンのCYP2C9、CYP2C19阻害作用により、本剤の代謝が阻害される。 |
| マプロチリン塩酸塩 | 1)眠気、注意力・集中力・反射運動能力等の低下が増強することがある。 2)併用中の本剤を急速に減量又は中止すると痙攣発作がおこる可能性がある。 | 1)相互に中枢神経抑制作用を増強することが考えられている。 2)本剤の抗痙攣作用により抑制されていたマプロチリン塩酸塩の痙攣誘発作用が本剤の減量・中止によりあらわれることが考えられている。 |
| ミルタザピン | 鎮静作用が増強されるおそれがある。 また、ミルタザピンとの併用により精神運動機能及び学習獲得能力が減退するとの報告がある。 | 相加的な鎮静作用を示すことが考えられる。 |
| バルプロ酸ナトリウム | 本剤の作用が増強することがある。 | 本剤の非結合型の血中濃度を上昇させる。 |
| ダントロレンナトリウム水和物 ボツリヌス毒素製剤 | 筋弛緩作用が増強する可能性がある。 | 相互に筋弛緩作用を増強することが考えられている。 |
| リファンピシン | 本剤の血中濃度が低下し、作用が減弱するおそれがある。 | リファンピシンのCYP3A4誘導作用により、本剤の代謝が誘導され、血中濃度が低下する可能性がある。 |
| アパルタミド | 本剤の血中濃度が低下し、作用が減弱するおそれがある。 | アパルタミドのCYP2C19誘導作用により、本剤の代謝が誘導され、血中濃度が低下する可能性がある。 |
| シナカルセト エボカルセト | これら薬剤の血中濃度に影響を与えるおそれがある。 | 血漿蛋白結合率が高いことによる。 |
| 無水カフェイン | 本剤の血中濃度が減少することがある。 | 不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 依存性、離脱症状(いずれも頻度不明)
連用により薬物依存を生じることがあるので、観察を十分に行い、用量及び使用期間に注意し慎重に投与すること。また、連用中における投与量の急激な減少ないし投与の中止により、痙攣発作、せん妄、振戦、不眠、不安、幻覚、妄想等の離脱症状があらわれることがあるので、投与を中止する場合には、徐々に減量するなど慎重に行うこと。[8.2参照]
11.1.2 舌根の沈下による上気道閉塞、呼吸抑制(いずれも頻度不明)
慢性気管支炎等の呼吸器疾患に用いた場合、呼吸抑制があらわれることがある。
11.1.3 刺激興奮、錯乱(いずれも頻度不明)
11.1.4 循環性ショック(頻度不明)
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 精神神経系 | 眠気 | ふらつき、頭痛 | 眩暈 | 言語障害、振戦、複視、霧視、眼振、失神、失禁、歩行失調、多幸症 |
| 肝臓 | 黄疸 | |||
| 血液 | 顆粒球減少、白血球減少 | |||
| 循環器 | 血圧低下 | 頻脈 | 徐脈 | |
| 消化器 | 悪心、嘔吐、便秘、口渇 | 食欲不振 | ||
| 過敏症 | 発疹 | |||
| その他 | 倦怠感、脱力感 | 浮腫 |
13. 過量投与
13.1 処置
本剤の過量投与が明白又は疑われた場合の処置としてフルマゼニル(ベンゾジアゼピン受容体拮抗剤)を投与する場合には、使用前にフルマゼニルの使用上の注意を必ず読むこと。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 配合変化
他の注射液と混合又は希釈して使用しないこと。
14.2 薬剤投与時の注意
14.2.1 投与経路
(1)経口投与が困難な場合や、緊急の場合、また、経口投与で効果が不十分と考えられる場合にのみ使用すること。なお、経口投与が可能で効果が十分と判断された場合には、速やかに経口投与にきりかえること。
(2)投与経路は静脈内注射を原則とすること。
14.2.2 静脈内に注射する場合には、なるべく太い静脈を選んで、できるだけ緩徐に(2分間以上の時間をかけて)注射すること。
14.2.3 急速に静脈内に注射した場合、あるいは細い静脈内に注射した場合には、血栓性静脈炎を起こすおそれがある。
14.2.4 動脈内に注射した場合には、末梢の壊死を起こすおそれがあるので、動脈内には絶対に注射しないこと。
14.2.5 筋肉内注射にあたっては、組織・神経等への影響を避けるため以下の点に注意すること。
(1)筋肉内注射は、やむを得ない場合にのみ、必要最小限に行うこと。なお、特に同一部位への反復注射は行わないこと。
(2)神経走行部位を避けるよう注意すること。
(3)注射針を刺入したとき、激痛を訴えたり、血液の逆流をみた場合は、直ちに針を抜き、部位をかえて注射すること。
14.2.6 投与部位
静脈内注射時に血管痛が、また、筋肉内注射時に注射部痛、硬結がみられることがある。
15. その他の注意
15.1 臨床使用に基づく情報
投与した薬剤が特定されないままにフルマゼニル(ベンゾジアゼピン受容体拮抗剤)を投与された患者で、新たに本剤を投与する場合、本剤の鎮静・抗痙攣作用が変化、遅延するおそれがある。
18. 薬効薬理
18.1 作用機序
中枢における抑制性伝達物質GABAの受容体には、GABAA受容体とGABAB受容体があるが、GABAA受容体は、GABA結合部位、ベンゾジアゼピン結合部位、バルビツール酸誘導体結合部位などからなる複合体を形成し、中央にCl-を通す陰イオンチャネル(Cl-チャネル)が存在する。GABAがその結合部位に結合するとCl-チャネルが開口し、それにより神経細胞は過分極し、神経機能の全般的な抑制がもたらされる。ベンゾジアゼピン系薬物がこの複合体の結合部位に結合すると、GABAによる過分極誘起作用すなわち神経機能抑制作用を促進する1)。
18.2 馴化、鎮静作用
18.3 筋弛緩作用
18.4 抗痙攣作用
ストリキニーネ痙攣、メトラゾール痙攣、電気ショック痙攣に対して抗痙攣作用を示す4)(マウス)。
18.5 子宮筋弛緩作用
子宮筋に作用して、子宮筋の異常緊張を除去する7)(ラット摘出子宮、ヒト子宮)。
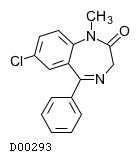
19. 有効成分に関する理化学的知見
19.1. ジアゼパム
22. 包装
<セルシン注射液5mg>
1mL×10アンプル
<セルシン注射液10mg>
2mL×10アンプル
23. 主要文献
- 第十八改正日本薬局方解説書, 2135-C-2140, (2021), (廣川書店)
- Arrigo A.et al., Arch Int Pharmacodyn., 154, 364-373, (1965)
- Brockmann A.W., Arch Pharm., 299, 229-231, (1966)
- Randall L.O.et al., Curr Ther Res., 3, 405-425, (1961)
- 宇根岡啓基, 脳と神経, 21, 129-138, (1969)
- Ngai S.H.et al., J Pharmacol Exp Ther., 153, 344-351, (1966)
- 井上正二 他, 診療と新薬, 2, 979-983, (1965)
24. 文献請求先及び問い合わせ先
文献請求先
T's製薬株式会社
ティーズDIセンター
〒451-0045
名古屋市西区名駅二丁目27番8号
電話:0120-923-093 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製品情報問い合わせ先
T's製薬株式会社
ティーズDIセンター
〒451-0045
名古屋市西区名駅二丁目27番8号
電話:0120-923-093 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
T's製薬株式会社
大阪市中央区道修町四丁目1番1号
26.2 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号