医薬品情報
| 総称名 | ミケラン |
|---|---|
| 一般名 | カルテオロール塩酸塩 |
| 欧文一般名 | Carteolol Hydrochloride |
| 製剤名 | カルテオロール塩酸塩細粒 |
| 薬効分類名 | βブロッカー |
| 薬効分類番号 | 2123 |
| ATCコード | C07AA15 |
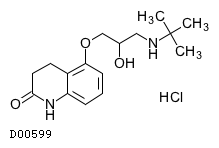
| KEGG DRUG |
D00599
カルテオロール塩酸塩
|
| KEGG DGROUP |
DG03231
血圧降下薬
DG01653
抗不整脈薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年5月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| 小児用ミケラン細粒0.2% | Pediatric Mikelan fine granules 0.2% | 大塚製薬 | 2123005C1030 | 6.7円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 気管支喘息、気管支痙攣のおそれのある患者[気管支筋収縮作用により、喘息症状の誘発、悪化を起こすおそれがある。]
2.3 糖尿病性ケトアシドーシス、代謝性アシドーシスのある患者[アシドーシスによる心筋収縮力の抑制を増強するおそれがある。]
2.4 高度の徐脈(著しい洞性徐脈)、房室ブロック(II、III度)、洞不全症候群、洞房ブロックのある患者[刺激伝導系に対し抑制的に作用し、症状を悪化させるおそれがある。]
2.5 心原性ショックの患者[心拍出量抑制作用により、症状が悪化するおそれがある。]
2.6 肺高血圧による右心不全のある患者[心拍出量抑制作用により、症状が悪化するおそれがある。]
2.7 うっ血性心不全のある患者あるいは、そのおそれのある患者[心収縮力抑制作用により、症状が悪化するおそれがある。]
2.8 低血圧症の患者[降圧作用により症状を悪化させるおそれがある。]
2.9 未治療の褐色細胞腫又はパラガングリオーマの患者[7.、9.1.6参照]
4. 効能または効果
ファロー四徴症に伴うチアノーゼ発作
6. 用法及び用量
通常、乳幼児には1日量として体重1kg当たり0.1〜0.15g(カルテオロール塩酸塩として0.2〜0.3mg)を、朝・夕の2回に分割経口投与する。なお、症状に応じて適宜増減する。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.1 投与が長期にわたる場合は、心機能検査(脈拍、血圧、心電図、X線等)を定期的に行うこと。特に徐脈になったとき及び低血圧を起こした場合には減量又は中止すること。また、必要に応じアトロピン硫酸塩水和物を使用すること。なお、肝機能、腎機能、血液像等に注意すること。
8.2 類似化合物(プロプラノロール塩酸塩)使用中の狭心症の患者で、急に投与を中止したとき、症状が悪化したり、心筋梗塞を起こした症例が報告されているので、休薬を要する場合は徐々に減量し、観察を十分に行うこと。また、患者に医師の指示なしに服薬を中止しないよう注意すること。
8.3 手術前24時間は投与しないことが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 特発性低血糖症、コントロール不十分な糖尿病、長期間絶食状態の患者
血糖値に注意すること。低血糖症状を起こしやすく、かつ症状をマスクしやすい。
9.1.2 徐脈、房室ブロック(I度)のある患者
心刺激伝導系を抑制し、症状を悪化させるおそれがある。
9.1.3 末梢循環障害のある患者(レイノー症候群、間欠性跛行症等)
末梢血管収縮作用により、症状が悪化するおそれがある。
9.1.4 甲状腺中毒症の患者
休薬を要する場合には徐々に減量し、観察を十分に行うこと。急に投与を中止すると、症状を悪化させることがある。また、頻脈等の中毒症状をマスクすることがある。
9.1.5 異型狭心症の患者
類薬で症状を悪化させたとの報告がある。
9.1.6 褐色細胞腫又はパラガングリオーマの患者
本剤の単独投与により急激に血圧が上昇することがある。[2.9、7.参照]
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
薬物動態の影響等で副作用が出現するおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
薬物代謝の遅延等で副作用が出現するおそれがある。
9.7 小児等
低出生体重児及び新生児を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| 交感神経系に対し抑制的に作用する他の薬剤 レセルピン等 | 過剰の交感神経抑制を来すことがあるので、減量するなど慎重に投与すること。 | 相加的に交感神経抑制作用を増強させる。 |
| 血糖降下剤 インスリン トルブタミド アセトヘキサミド等 | 血糖降下作用が増強することがある。また、低血糖症状(頻脈、発汗等)をマスクすることがあるので、血糖値に注意すること。 | 低血糖に伴う交感神経系の症状をマスクしたり、β遮断作用により低血糖の回復を遅れさせる。 |
| カルシウム拮抗剤 ベラパミル塩酸塩 ジルチアゼム塩酸塩 | 徐脈、房室ブロック等の伝導障害、うっ血性心不全があらわれることがある。併用する場合には用量に注意すること。 | 相互に作用が増強される。 |
| クロニジン塩酸塩 グアナベンズ酢酸塩 | クロニジン塩酸塩、グアナベンズ酢酸塩投与中止後のリバウンド現象を増強するおそれがある。β遮断剤を先に中止し、クロニジン塩酸塩、グアナベンズ酢酸塩を徐々に減量すること。 | クロニジン塩酸塩はα2受容体に選択的に作用し、ノルアドレナリンの遊離を抑制しているため、急激な中止によって血中カテコラミンの上昇が起こる。この時、β受容体遮断薬を併用すると上昇したカテコラミンの作用のうち、β受容体刺激作用が遮断され、α受容体刺激作用だけが残り、急激な血圧上昇が起こるおそれがある。グアナベンズ酢酸塩も作用機序から同様な反応が予想される。 |
| クラスI抗不整脈剤 リン酸ジソピラミド プロカインアミド塩酸塩等 | 過度の心機能抑制があらわれるおそれがあるので、減量するなど注意すること。 | 相加的に心機能抑制作用を増強させる。 |
| ジギタリス製剤 | 徐脈、房室ブロック等の伝導障害があらわれるおそれがあるので、心機能に注意すること。 | 相加的に心刺激伝導抑制作用を増強させる。 |
| 非ステロイド性抗炎症剤 インドメタシン等 | 本剤の降圧作用が減弱するおそれがある。 | 非ステロイド性抗炎症剤は、血管拡張作用を有するプロスタグランジンの合成・遊離を阻害する。 |
| 降圧作用を有する他の薬剤 降圧剤 硝酸剤等 | 降圧作用が増強するおそれがある。 併用する場合には、用量に注意すること。 | 降圧作用を増強させる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 低血糖(0.1〜5%未満)
小児で意識障害、痙攣があらわれることがある。低血糖症状があらわれた場合には、経口摂取可能な状態では角砂糖、あめ等の糖分の摂取、意識障害、痙攣を伴う場合には、ブドウ糖の静注等を行い、十分に経過観察すること。また、保護者に対し患児の状態(悪寒、顔面蒼白、多量の発汗、不機嫌、意識もうろう状態等の低血糖に伴う症状)を十分観察するよう注意を与えること。
11.1.2 房室ブロック(頻度不明)、洞不全症候群(頻度不明)、洞房ブロック(頻度不明)、洞停止(頻度不明)等の徐脈性不整脈、うっ血性心不全(又はその悪化)(0.1〜5%未満)、冠攣縮性狭心症(頻度不明)
定期的に心機能検査を行い、必要に応じ、減量又は中止するなど適切な処置を行うこと。
11.1.3 失神(頻度不明)
高度な徐脈に伴う失神があらわれることがある。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 循環器 | めまい・ふらつき・立ちくらみ、徐脈、動悸、息切れ、低血圧 | 胸痛 | |
| 精神神経系 | 頭痛・頭重感、眠気、不眠、振戦、抑うつ感 | 耳鳴、不安感、悪夢、耳の蟻走感 | |
| 消化器 | 腹部不快感、嘔気、下痢、腹痛、便秘 | 食欲不振、鼓腸 | 口内炎 |
| 呼吸器 | 呼吸困難、咳・痰 | 喘息様症状、上気道閉塞感 | |
| 眼 | 目がしょぼつく | 霧視、涙液分泌減少 | |
| 過敏症 | 皮疹 | 皮膚そう痒感 | |
| 肝臓 | AST、ALT、LDHの上昇 | ||
| その他 | 倦怠感、脱力感、浮腫、ほてり、疲労感 | 頻尿 | 筋肉痛、総コレステロール値の上昇、手足のしびれ、下肢冷感、発汗、腓腸筋痙攣(こむらがえり)、血清CK値の上昇 |
13. 過量投与
13.1 症状
過量投与により、徐脈、完全房室ブロック、心不全、低血圧、気管支痙攣等があらわれることがある。
13.2 処置
以下の処置の間は常に観察下におくこと。
・徐脈、完全房室ブロック:アトロピン硫酸塩水和物、イソプレナリン等の投与や心臓ペーシングを適用すること。
・心不全、低血圧:強心剤、昇圧剤、輸液等の投与や補助循環を適用すること。
・気管支痙攣:β2刺激剤又はアミノフィリン水和物を静注等の投与や補助呼吸を適用すること。
14. 適用上の注意
14.1 薬剤投与時の注意
服用に際し、水、ミルクあるいは牛乳に溶解してもさしつかえない。なお、本剤を水に溶解した場合、わずかに白濁する。
15. その他の注意
15.1 臨床使用に基づく情報
β遮断剤服用中の患者では、他の薬剤によるアナフィラキシー反応がより重篤になることがあり、また、通常用量のアドレナリンによる治療に抵抗するとの報告がある。
16. 薬物動態
16.1 血中濃度
健康成人19例にカルテオロール塩酸塩10〜30mgを単回経口投与した時、速やかに吸収され、血中濃度は約1時間後に最高に達した。血中濃度の半減期は約5時間であった1)。
16.3 分布
ヒト血漿蛋白結合率は約15%であった2)(in vitro、平衡透析法)。
16.4 代謝
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
国内16施設で総計155例について実施された臨床試験(カルテオロール塩酸塩として0.08〜0.8mg/kg/日注))の概要は次のとおりである。ファロー四徴症患者を対象とした臨床試験において、本剤の有用率(「有用」以上の判定を得たもの)は88.5%(123/139例)であった7)8)9)。
また、プロプラノロール塩酸塩を対照薬とする交叉比較試験において本剤は、「チアノーゼ発作の回数と程度」及び「チアノーゼ発作の持続時間」に対する改善効果に優れ、副作用を加味した有用度においても優れることが明らかにされている。
また、プロプラノロール塩酸塩を対照薬とする交叉比較試験において本剤は、「チアノーゼ発作の回数と程度」及び「チアノーゼ発作の持続時間」に対する改善効果に優れ、副作用を加味した有用度においても優れることが明らかにされている。
注)本剤の承認された1日用量は、体重1kg当たりカルテオロール塩酸塩として0.2〜0.3mgを1日2回分割経口投与である。
18. 薬効薬理
18.1 作用機序
18.2 アドレナリン性β受容体遮断作用
18.2.2 麻酔した幼若犬においても成熟犬と同様に、カルテオロール塩酸塩はイソプレナリンによる心拍数増大と血圧下降に対し拮抗した13)。
18.3 作用持続時間
18.3.1 麻酔犬において、カルテオロール塩酸塩のアドレナリン性β受容体遮断作用は長時間持続した14)。
18.3.2 健康成人での運動負荷試験において、カルテオロール塩酸塩の心拍数上昇抑制効果は長時間持続した15)。
18.4 内因性交感神経刺激様作用(ISA)
19. 有効成分に関する理化学的知見
19.1. カルテオロール塩酸塩
22. 包装
プラスチックボトル:100g
23. 主要文献
- Morita,S.et al., Arzneim-Forsch/Drug Res., 27 (II), 2380-2383, (1977)
- 社内資料:ヒト血漿蛋白結合試験
- Kudo,S.et al., Eur J Clin Pharmacol., 52 (6), 479-485, (1997) »PubMed
- 内多 稔 ほか, 薬学雑誌, 96 (5), 571-577, (1976) »DOI
- 石原高文 ほか, 社内資料(代謝産物の一般薬理作用), (1976)
- 笹辺裕行 ほか, 社内資料(尿中代謝産物の定量), (1982)
- 森 忠三 ほか, 第86回日本小児科学会発表, (1983), (大阪)
- 長嶋正實 ほか, 小児科臨床, 36 (2), 415-424, (1983)
- 石原義紀 ほか, 小児科診療, 42 (6), 772-777, (1979)
- Hashimoto,K.et al., Jpn J Pharmacol., 26 (4), 504-506, (1976) »PubMed
- Yabuuchi,Y.et al., Jpn J Pharmacol., 24 (6), 853-861, (1974) »DOI
- 岳中典男 ほか, 日薬理誌, 71 (2), 221-230, (1975) »PubMed
- 山下修司 ほか, 社内資料(イヌにおけるβ-遮断作用), (1982)
- Nakagawa,K.et al., J Med Chem., 17 (5), 529-533, (1974) »PubMed
- 仁木敏晴 ほか, 心臓, 7 (10), 1151-1158, (1975) »DOI
- Taira,N.et al., Jpn J Pharmacol., 28 (3), 473-483, (1978) »PubMed
- 佐藤 光 ほか, 臨床成人病, 6 (5), 815-824, (1976)
24. 文献請求先及び問い合わせ先
文献請求先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
製品情報問い合わせ先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
26. 製造販売業者等
26.1 製造販売元
大塚製薬株式会社
東京都千代田区神田司町2-9