医薬品情報
| 総称名 | ノバントロン |
|---|---|
| 一般名 | ミトキサントロン塩酸塩 |
| 欧文一般名 | Mitoxantrone Hydrochloride |
| 製剤名 | ミトキサントロン塩酸塩注射液 |
| 薬効分類名 | アントラキノン系抗悪性腫瘍剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01DB07 |
| KEGG DRUG |
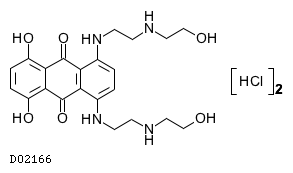
D02166
ミトキサントロン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年5月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ノバントロン注20mg | NOVANTRON INJECTION | あすか製薬 | 4291402A1032 | 30568円/瓶 | 毒薬, 処方箋医薬品注) |
| ノバントロン注10mg | NOVANTRON INJECTION | あすか製薬 | 4291402A2020 | 16735円/瓶 | 毒薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 心機能異常又はその既往歴のある患者[心筋障害があらわれるおそれがある。]
2.2 本剤の成分に対し重篤な過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
<急性白血病(慢性骨髄性白血病の急性転化を含む)>
通常、成人にはミトキサントロンとして1日1回2〜5mg/m2(本剤1〜2.5mL/m2)を5日間連日、3〜4週間隔で静脈内にゆっくり投与する。
<悪性リンパ腫、乳癌>
通常、成人にはミトキサントロンとして1日1回2〜4mg/m2(本剤1〜2mL/m2)を5日間連日あるいは1回8〜14mg/m2(本剤4〜7mL/m2)を3〜4週間隔で静脈内にゆっくり投与する。
<肝細胞癌>
通常、成人にはミトキサントロンとして1日1回6〜12mg/m2(本剤3〜6mL/m2)を3〜4週間隔で静脈内にゆっくり投与する。
なお、年齢、症状により適宜増減する。
7. 用法及び用量に関連する注意
7.1 静脈内投与に際しては、調整後の希釈液を3分以上かけてゆっくり投与すること。
7.2 点滴静脈内投与に際しては、30分以上かけて投与すること。
8. 重要な基本的注意
8.1 骨髄機能抑制、心筋障害等の重篤な副作用が起こることがあるので、以下の点に注意すること。[9.1.1、9.1.2、9.1.4、11.1.1、11.1.2参照]
8.1.1 緊急時に十分処置できる医療施設及び癌化学療法に十分な経験をもつ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与すること。
8.1.2 頻回に臨床検査(血液検査、肝機能・腎機能検査、心機能検査等)を行うなど、患者の状態を十分に観察すること。心電図等による心機能検査は、原則としてコース(通常3〜4週)ごとに実施することが望ましい。また、使用が長期間にわたると副作用が強くあらわれ、遷延性に推移することがあるので、投与は慎重に行うこと。
8.1.3 従前にアントラサイクリン系薬剤を使用した症例では、本剤の投与量の多少にかかわらず心筋障害を起こすことがあるので、心機能検査を頻回に行い、異常が認められた場合には投与を中止すること1)。
8.2 従前にアントラサイクリン系薬剤を使用していない症例では、本剤の総投与量が160mg/m2、及び従前にアントラサイクリン系薬剤を使用した症例では、本剤の総投与量が100mg/m2を超える場合にうっ血性心不全等の重篤な心障害を起こすことがある。[9.1.4、11.1.1参照]
8.3 感染症・出血傾向の発現又は増悪に十分注意すること。[9.1.2参照]
8.4 免疫機能が抑制された患者への生ワクチン接種により、ワクチン由来の感染を増強又は持続させるおそれがあるので、本剤投与中に生ワクチンを接種しないこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄機能抑制のある患者
9.1.2 感染症を合併している患者
9.1.3 水痘患者
致命的な全身障害があらわれるおそれがある。
9.2 腎機能障害患者
副作用が強くあらわれるおそれがある。
9.3 肝機能障害患者
副作用が強くあらわれるおそれがある。
9.4 生殖能を有する者
生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。アントラサイクリン系の抗悪性腫瘍剤(ドキソルビシン塩酸塩、ダウノルビシン塩酸塩等)の動物試験で催奇形作用が報告されている。
9.6 授乳婦
授乳を避けさせること。ヒトで乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。腎機能等生理機能が低下していることが多く、副作用があらわれやすい。
10. 相互作用
10.2 併用注意
| 投与前の心臓部あるいは縦隔への放射線照射 潜在的に心毒性を有する他の抗悪性腫瘍剤 アントラサイクリン系薬剤等 | 心筋障害が増強されることがある。 | 心筋に対する蓄積毒性が増強される。 |
| 他の抗悪性腫瘍剤 放射線照射 | 骨髄機能抑制等の副作用が増強されることがある。急性白血病(前白血病相を伴う場合もある)、骨髄異形成症候群(MDS)が発生することがある。 | 副作用が相互に増強される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.2 骨髄抑制、汎血球減少(いずれも頻度不明)
11.1.3 間質性肺炎(頻度不明)
発熱、咳嗽、労作時息切れ、呼吸困難等の異常が認められた場合には、速やかに胸部X線検査等を実施し、間質性肺炎が疑われる場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.4 ショック、アナフィラキシー(いずれも頻度不明)
発疹、呼吸困難、血圧低下等の症状があらわれた場合には直ちに投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 10%以上 | 5〜10%未満 | 5%未満 | 頻度不明 | |
| 心臓 | 心電図異常、頻脈 | 不整脈、心悸亢進 | ||
| 過敏症 | 発疹 | 紅斑 | ||
| 肝臓 | ALT上昇(32.0%)、AST上昇(24.6%)、ビリルビン上昇、ALP上昇等の肝機能検査値異常 | 黄疸 | ||
| 腎臓 | BUN上昇 | 蛋白尿 | 血尿、クレアチニン上昇 | |
| 消化器 | 食欲不振(49.7%)、悪心・嘔吐(44.5%)、口内炎(20.6%)、下痢 | 腹痛、消化管出血 | ||
| 皮膚 | 脱毛(21.1%) | |||
| 精神神経系 | 倦怠感、頭痛 | |||
| 投与部位 | 静脈炎 | 血管痛 | ||
| その他 | 発熱 | 感染症 | 味覚異常、鼻出血 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 溶解時のpHの高い薬剤及びβ-ラクタム環を有する抗生物質と配合した場合、沈殿を生ずることがあるので、これらの薬剤との混注を避けること2)。また、ヘパリンと結合することが報告されているので、ヘパリンとの混注時に沈殿を生じる可能性が否定できないため、ヘパリンとの混注を避けること。
14.1.2 希釈方法
(1)静脈内投与の場合、本剤の必要量を通常、注射用蒸留水、生理食塩液又は5%ブドウ糖液20mL以上で希釈する。
(2)点滴静脈内投与の場合、本剤の必要量を通常、生理食塩液又は5%ブドウ糖液100mL以上で希釈する。なお、注射用蒸留水で希釈した場合は低張となるので使用しないこと。
(3)希釈した注射液は調製後24時間以内に使用すること。
(4)分割使用する場合には、4週間以内に使い終えること3)。
14.1.3 本剤及び希釈液が皮膚などに付着しないよう慎重に取り扱うこと。
14.2 薬剤投与時の注意
14.2.1 静脈内投与により血管痛、静脈炎、血栓を起こすおそれがあるので、注射部位、注射方法等に十分注意し、注射速度をできるだけ遅くすること。
14.2.2 静脈内投与に際し薬液が血管外に漏れると、皮膚が青色に変色したり、注射部位に硬結・壊死を起こすことがあるので、薬液が血管外に漏れないように投与すること。
14.2.3 本剤が目や皮膚に付着した場合には直ちに水道水で洗い流すこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤の投与により皮膚や強膜が一過性に青色を呈したり、尿が青〜緑色になることがある。
15.1.2 免疫機能が抑制された患者にワクチンを接種した場合、抗体反応の欠如が報告されている。
15.2 非臨床試験に基づく情報
15.2.1 ラットに静脈内投与した試験で、発癌性の可能性が示唆されたという報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
ノバントロン10mg/m2を進行性癌患者5例(悪性リンパ腫3例、乳癌2例)に30分かけて単回点滴静脈内投与したときの血清中ミトキサントロン濃度は、点滴終了時に最高値533ng/mLを示し、以後図のような推移を示す4)。
| AUC(μg・hr/mL) | T1/2(hr) | ||
| α | β | γ | |
| 689±71.7 | 0.164±0.0236 | 1.58±0.795 | 83.4±55.6 |
16.3 分布
血漿蛋白結合率
78.3%5)(in vitro)
16.4 代謝
16.5 排泄
血清中濃度測定と同時に測定した尿中のミトキサントロンの排泄量は、点滴終了後96時間までの累積尿中排泄率で、投与量の5.17%(5例の平均)である4)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
国内で実施された多剤併用例を含む1,364例の臨床試験成績の概要を下記に示す(再審査終了時の集計)8)。
| 疾患名 | 奏効症例/評価症例 | 奏効率※(%) |
| 急性白血病(慢性骨髄性白血病の急性転化を含む) | 544/769 | 70.7 |
| 悪性リンパ腫 | 223/342 | 65.2 |
| 乳癌 | 59/168 | 35.1 |
| 肝細胞癌 | 14/85 | 16.5 |
18. 薬効薬理
18.1 作用機序
ミトキサントロンは、DNA鎖と架橋形成し、腫瘍細胞の核酸合成を阻害する。
ミトキサントロンを作用させた白血病細胞(L1210)のDNA鎖では、DNA鎖の溶融に必要な温度の上昇がみられ、ミトキサントロンがDNA鎖と架橋を形成することが示唆されている。ミトキサントロンの架橋形成作用は、ミトキサントロンの白血病細胞(L1210)におけるチミジン及びウリジンの50%取り込み阻害速度(IC50値)が、それぞれ0.34μmol/L(150ng/mL)、0.17μmol/L(75ng/mL)であることからも推察される9)。
また、ミトキサントロンは、トポイソメラーゼ-IIによるDNA切断作用を阻害することが確認されている10)。
ミトキサントロンを作用させた白血病細胞(L1210)のDNA鎖では、DNA鎖の溶融に必要な温度の上昇がみられ、ミトキサントロンがDNA鎖と架橋を形成することが示唆されている。ミトキサントロンの架橋形成作用は、ミトキサントロンの白血病細胞(L1210)におけるチミジン及びウリジンの50%取り込み阻害速度(IC50値)が、それぞれ0.34μmol/L(150ng/mL)、0.17μmol/L(75ng/mL)であることからも推察される9)。
また、ミトキサントロンは、トポイソメラーゼ-IIによるDNA切断作用を阻害することが確認されている10)。
18.2 抗腫瘍作用
19. 有効成分に関する理化学的知見
19.1. ミトキサントロン塩酸塩
20. 取扱い上の注意
本剤及び希釈液は他の注射液と区分して保管すること。
22. 包装
<ノバントロン注10mg>
1バイアル
<ノバントロン注20mg>
1バイアル
23. 主要文献
- Smith,J.F,ed., Pharmanual,a comprehensive guide to the therapeutic use of Novantrone., (1984), (Chicago:Pharma Libri)
- 幸保文治他, 医薬ジャーナル, 23 (9), 1879-1891, (1987)
- 社内資料:安定性試験
- 小川一誠他, 癌と化学療法, 13 (10), 3028-3033, (1986) »PubMed
- 社内資料:CL 232,315の蛋白結合
- Ehninger,G.et al., Cancer Treat.Rep., 70 (12), 1373-1378, (1986) »PubMed
- Chiccarelli,F.S.et al., Cancer Res., 46 (9), 4858-4861, (1986) »PubMed
- 社内資料:臨床成績集計
- Johnson,R.K., Cancer Treat.Rep., 63 (3), 425-439, (1979) »PubMed
- Osheroff,N.et al., Advances Pharmacol., 29B, 105-126, (1994) »PubMed
- Wallace,R.E.et al., Cancer Res., 39 (5), 1570-1574, (1979) »PubMed
- Goldin,A.et al., Cancer Treat.Rev., 7 (4), 167-176, (1980) »PubMed
- Durr,F.E.et al., Am.Soc.Microbiology., 1595-1596, (1980)
- Kimler,B.F.et al., Cancer Res., 42 (9), 3631-3636, (1982) »PubMed
- Fujimoto,S.et al., Cancer Chemother.Pharamacol., 8 (2), 157-162, (1982) »PubMed
- 佐藤 博, 癌と化学療法, 9 (1), 26-30, (1982) »PubMed
- 奥田博明他, 化学療法の領域, 4 (9), 133-137, (1988)
24. 文献請求先及び問い合わせ先
文献請求先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
製品情報問い合わせ先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
26. 製造販売業者等
26.1 製造販売元
あすか製薬株式会社
東京都港区芝浦二丁目5番1号
26.2 販売元
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号