医薬品情報
| 総称名 | キュバール |
|---|---|
| 一般名 | ベクロメタゾンプロピオン酸エステル |
| 欧文一般名 | Beclometasone Dipropionate |
| 製剤名 | ベクロメタゾンプロピオン酸エステル吸入用エアゾール |
| 薬効分類名 | 吸入ステロイド喘息治療剤 |
| 薬効分類番号 | 2290 |
| ATCコード | R03BA01 |
| KEGG DRUG |
D00689
ベクロメタゾンプロピオン酸エステル
|
| KEGG DGROUP |
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年4月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| キュバール50エアゾール | QVAR Aerosol | 住友ファーマ | 2259703G9020 | 1354.4円/瓶 | 処方箋医薬品注) |
| キュバール100エアゾール | QVAR Aerosol | 住友ファーマ | 2259703Y1025 | 1732.2円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 有効な抗菌剤の存在しない感染症、全身の真菌症の患者[症状を増悪するおそれがある。]
2.2 本剤の成分に対して過敏症の既往歴のある患者
2.3 デスモプレシン酢酸塩水和物(男性における夜間多尿による夜間頻尿)を投与中の患者[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
本剤の投与開始前には、患者の喘息症状を比較的安定な状態にしておくこと。特に、喘息発作重積状態又は喘息の急激な悪化状態のときには原則として本剤は使用しないこと。
6. 用法及び用量
成人には、通常1回100μgを1日2回口腔内に噴霧吸入する。
小児には、通常1回50μgを1日2回口腔内に噴霧吸入する。
なお、年齢、症状により適宜増減するが、1日の最大投与量は成人では800μg、小児では200μgを限度とする。
8. 重要な基本的注意
8.1 本剤は気管支拡張剤ならびに全身性ステロイド剤のように既に起きている発作を速やかに軽減する薬剤ではないので、毎日規則正しく使用すること。
8.2 本剤の投与期間中に喘息の悪化がみられた場合には、気管支拡張剤あるいは全身性ステロイド剤を短期間併用し、症状の軽減にあわせて併用薬剤を徐々に減量すること。
8.3 全身性ステロイド剤と比較し可能性は低いが、吸入ステロイド剤の投与により全身性の作用(クッシング症候群、クッシング様症状、副腎皮質機能抑制、小児の成長遅延、骨密度の低下、白内障、緑内障を含む)が発現する可能性があるので、吸入ステロイド剤の投与量は患者ごとに喘息をコントロールできる最少用量に調節すること。特に長期間、大量投与の場合には定期的に検査を行い、全身性の作用が認められた場合には患者の喘息症状を観察しながら徐々に減量するなど適切な処置を行うこと。[9.7.1、13.1参照]
8.4 全身性ステロイド剤の減量は本剤の吸入開始後症状の安定をみて徐々に行う。減量にあたっては一般のステロイド剤の減量法に準ずる。
8.5 ベクロメタゾンプロピオン酸エステル吸入剤を含む吸入ステロイド剤投与後に、潜在していた基礎疾患である好酸球性多発血管炎性肉芽腫症にみられる好酸球増多症がまれにあらわれることがある。この症状は通常、全身性ステロイド剤の減量ならびに離脱に伴って発現しており、ベクロメタゾンプロピオン酸エステル吸入剤との直接的な因果関係は確立されていない。本剤の投与期間中は、好酸球数の推移や、他の好酸球性多発血管炎性肉芽腫症の症状(しびれ、発熱、関節痛、肺の浸潤等の血管炎症状等)に注意すること。
8.6 全身性ステロイド剤の減量ならびに離脱に伴って、鼻炎、湿疹、じん麻疹、眩暈、動悸、倦怠感、顔のほてり、結膜炎等の症状が発現・増悪することがある。このような症状があらわれた場合には適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 結核性疾患の患者
症状を増悪するおそれがある。
9.1.2 感染症(有効な抗菌剤の存在しない感染症、全身の真菌症を除く)の患者
症状を増悪するおそれがある。
9.1.3 高血圧の患者
血圧上昇を起こすおそれがある。
9.1.4 気管支粘液の分泌が著しい患者
本剤の肺内での作用を確実にするため本剤の吸入に先立って、分泌がある程度減少するまで他剤を使用するとよい。
9.1.5 長期又は大量の全身性ステロイド療法を受けている患者
全身性ステロイド剤の減量中ならびに離脱後も副腎皮質機能検査を行い、外傷、手術、重症感染症等の侵襲には十分に注意を払うこと。また、必要があれば一時的に全身性ステロイド剤の増量を行うこと。これらの患者では副腎皮質機能不全となっていることが考えられる。
9.1.6 長期間コルチコトロピン療法を受けている患者
気管支喘息の症状に変化がみられる場合には、全身性ステロイド剤の投与等の適切な処置を行うこと。ベクロメタゾンプロピオン酸エステル吸入剤の投与によりコルチコトロピンの離脱後、喘息発作重積状態を認めたとの報告がある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ベクロメタゾンプロピオン酸エステルは動物実験(マウス)で催奇形作用が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
9.7.1 長期間投与する場合には、投与量は患者ごとに喘息をコントロールできる最少用量に調節することとし、身長等の経過の観察を十分に行うこと。また、使用にあたっては、使用法を正しく指導すること。全身性ステロイド剤と比較し可能性は低いが、吸入ステロイド剤を特に長期間、大量に投与する場合に成長遅延をきたすおそれがある。[8.3、13.1参照]
9.7.2 低出生体重児、新生児、乳児又は4歳以下の幼児を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.1 併用禁忌
| デスモプレシン酢酸塩水和物(ミニリンメルト)(男性における夜間多尿による夜間頻尿) [2.3参照] | 低ナトリウム血症が発現するおそれがある。 | 機序不明。 |
11. 副作用
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 過敏症 | じん麻疹等の発疹、そう痒、浮腫、紅斑 | ||
| 口腔ならびに呼吸器 | 咳、咽喉頭症状(疼痛、異和感)、口渇、嗄声、気管支喘息の増悪、口内炎 | 咽喉頭症状(刺激感、異物感、発赤)、感染、口腔カンジダ症、味覚障害、呼吸器カンジダ症、口腔ならびに咽頭アスペルギルス症、肺好酸球増多症 | |
| 消化器 | 悪心 | 食欲不振、嘔吐、下痢、腹痛 | |
| 肝臓 | AST、ALT、γ-GTP、ALPの上昇 | ||
| 循環器 | 高血圧、動悸 | ||
| 筋肉・骨格 | 関節痛、筋肉痛、脱力感 | ||
| 精神神経系 | 気分不良、頭痛 | 倦怠感、憂うつ感 | |
| その他 | コルチゾール減少、鼻出血 | 尿糖、白血球増多、リンパ球減少、尿潜血 | 鼻炎、嗅覚障害 |
13. 過量投与
13.1 症状
13.2 処置
全身性ステロイド療法を中止する手順で本剤を徐々に減量すること。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 吸入前
患者には添付の携帯袋及び使用説明書(キュバールをお使いになる患者さんと保護者の方へ)を渡し、使用方法を指導すること。
14.1.2 吸入時
専用のアダプターを使用すること。
14.1.3 吸入後
局所的な副作用(口腔カンジダ症等)を予防するため、本剤吸入後に、うがいを実施するよう患者を指導すること。ただし、うがいが困難な患者には、うがいではなく、口腔内をすすぐよう指導すること。なお、小児への投与にあたっては、保護者又はそれに代わり得る適切な者に対しても十分に指導すること。
14.1.4 保管時
(1)アダプターは、少なくとも週1回流水か温湯で十分に洗浄し、乾燥させた後、清潔に保管すること(洗浄・乾燥が不十分だと噴霧不良の原因となる)。
(2)アルミ容器は濡らさないこと(噴射口がつまる原因となる)。
16. 薬物動態
16.1 血中濃度
| パラメータ | 総ベクロメタゾン | ||
| 1日用量(μg) | 200 | 400 | 800 |
| Tmax(h) | 1.1±0.4 | 1.0±0.0 | 1.1±0.4 |
| Cmax(pg/mL) | 197±84 | 539±238 | 953±359 |
| t1/2(h) | 5.1±3.6 | 4.3±0.7 | 4.1±0.8 |
| AUC0-t(pg・h/mL) | 792±180 | 2,113±804 | 3,999±1,562 |
16.3 分布
16.3.1 肺への分布
投与量の約40%(気管支喘息患者、99mTcで標識した本剤50μg1回噴霧吸入投与後のシンチグラフィー)2)(外国人データ)
16.4 代謝
16.4.1 主な代謝物
17-モノプロピオン酸ベクロメタゾン、ベクロメタゾン3)(外国人データ)
16.5 排泄
16.5.1 排泄経路
尿中及び糞便中
16.6 特定の背景を有する患者
16.6.1 小児
| パラメータ | 17-モノプロピオン酸ベクロメタゾン |
| Tmax(h) | 0.5±0.0 |
| Cmax(pg/mL) | 825±453 |
| t1/2(h) | 2.1±0.7 |
| AUC0-t(pg・h/mL) | 1,659±850 |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験(成人)
クロロフルオロカーボン(CFC)を噴射剤に使用したベクロメタゾンプロピオン酸エステル吸入剤を吸入している気管支喘息患者を対象に、本剤が1日2回分割噴霧吸入投与された。最終全般改善度は、ピークフロー値の改善を主とし、その他症状点数、治療点数、喘息点数等を総合し、観察期と比較した。
(1)国内第II相試験
| 対象疾患 | 改善率 | ||
| 改善した | 同様であった | 悪化した | |
| 気管支喘息 | 14.9%(10/67) | 80.6%(54/67) | 4.5%(3/67) |
副作用は、76例中3例(3.9%)に認められ、口渇、気分不快、嗄声(各1.3%)であった5)。
(2)国内第III相試験
| 対象疾患 | 改善率 | |||
| 改善した | 同様であった | 悪化した | 判定不能 | |
| 気管支喘息 | 16.4%(11/67) | 80.6%(54/67) | 3.0%(2/67) | 0 |
副作用は、86例中8例(9.3%)に認められた。主なものは嘔気、尿糖(各2.3%)であった6)。
(3)国内臨床試験
| 対象疾患 | 改善率 | |||
| 改善した | 同様であった | 悪化した | 判定不能 | |
| 気管支喘息 | 18.9%(10/53) | 71.7%(38/53) | 9.4%(5/53) | 0 |
副作用は、65例中4例(6.2%)に認められ、吸入時咳(3.1%)、尿糖、尿潜血(各1.5%)であった7)。
17.1.2 国内臨床試験(小児)
クロロフルオロカーボン(CFC)を噴射剤に使用したベクロメタゾンプロピオン酸エステル吸入剤を吸入している小児気管支喘息患者を対象に、本剤1日量100又は200μgが1日2回分割噴霧吸入投与された。全般改善度(4週後)は、ピークフロー値の改善を主とし、その他臨床症状、併用薬の使用状況を総合し、観察期と比較した。
| 対象疾患 | 改善率 | |||
| 改善した | 同様であった | 悪化した | 判定不能 | |
| 気管支喘息 | 10.7%(9/84) | 89.3%(75/84) | 0 | 0 |
副作用は、107例中12例(11.2%)に認められた。主なものはコルチゾール減少(3.7%)、鼻出血、咽喉頭疼痛(各1.9%)であった8)。
18. 薬効薬理
18.1 作用機序
気管支及び肺において、グルココルチコイド受容体と結合し、気道の慢性炎症を抑制することが示唆されている。
18.2 抗炎症作用
局所投与時(McKenzie変法):ヒト正常皮膚血管収縮作用において、ヒドロコルチゾンの約5,000倍、デキサメタゾンの約600倍の局所抗炎症活性を示した9)(外国人データ)。
18.3 気道抵抗増大に及ぼす影響
卵白アルブミン感作モルモットにおいて抗原吸入により誘発される気道抵抗増大を抑制した10)。
18.4 全身性ステロイド作用
19. 有効成分に関する理化学的知見
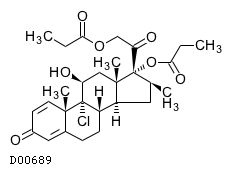
19.1. ベクロメタゾンプロピオン酸エステル
20. 取扱い上の注意
20.1 アルミ容器は火中に投じないこと。
20.2 地方自治体により定められたアルミ容器の廃棄処理法に従うこと。
20.3 アルミ容器に穴を開けるときは空にしてから開けること。
22. 包装
<キュバール50エアゾール>
1缶[アダプター付]
10缶[アダプター付]
<キュバール100エアゾール>
1缶[アダプター付]
10缶[アダプター付]
23. 主要文献
- 社内資料:喘息患者でのHPA系抑制用量反応性試験(2002年4月11日承認、申請資料概要へ−3)
- 社内資料:喘息患者での肺への分布(2002年4月11日承認、申請資料概要へ−3)
- Harrison,L.I.,et al., Eur.J.Clin.Pharmacol., 58, 197-201, (2002) »PubMed »DOI
- Teramoto,T.,et al., Allergol.Int., 55, 317-320, (2006) »PubMed »DOI
- 宮本昭正, アレルギー・免疫, 9, 1088-1100, (2002)
- 宮本昭正ほか, アレルギー・免疫, 9, 918-932, (2002)
- 宮本昭正, アレルギー・免疫, 9, 934-945, (2002)
- 西間三馨ほか, アレルギー・免疫, 12, 80-94, (2005)
- Harris,D.M., Postgrad.Med.J., 51 (Suppl.4), 20-25, (1975) »PubMed
- 柳田知司ほか, 実中研・前臨床研究報, 2, 137-147, (1976)
- 田中寿子ほか, 実中研・前臨床研究報, 2, 97-111, (1976)
- 田中寿子ほか, 実中研・前臨床研究報, 2, 113-135, (1976)
- 山本慧, 日本薬理学雑誌, 73, 25-36, (1977) »PubMed »DOI
24. 文献請求先及び問い合わせ先
文献請求先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
製品情報問い合わせ先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
26. 製造販売業者等
26.1 製造販売元
住友ファーマ株式会社
大阪市中央区道修町2-6-8