医薬品情報
| 総称名 | ノリトレン |
|---|---|
| 一般名 | ノルトリプチリン塩酸塩 |
| 欧文一般名 | Nortriptyline Hydrochloride |
| 薬効分類名 | 情動調整剤 |
| 薬効分類番号 | 1179 |
| ATCコード | N06AA10 |
| KEGG DRUG |
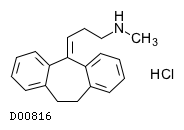
D00816
ノルトリプチリン塩酸塩
|
| KEGG DGROUP |
DG01730
非選択的モノアミン再取り込み阻害薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年4月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ノリトレン錠10mg | NORITREN Tablets | 住友ファーマ | 1179004F1024 | 5.9円/錠 | 劇薬, 処方箋医薬品注) |
| ノリトレン錠25mg | NORITREN Tablets | 住友ファーマ | 1179004F2039 | 10.4円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 閉塞隅角緑内障の患者[抗コリン作用により眼圧が上昇し、症状を悪化させることがある。]
2.2 本剤の成分及び三環系抗うつ剤に対し過敏症の患者
2.3 心筋梗塞の回復初期の患者[循環器系への影響を強く受けるおそれがある。]
2.4 尿閉(前立腺疾患等)のある患者[本剤の抗コリン作用により、尿閉が助長されるおそれがある。]
2.5 モノアミン酸化酵素阻害剤(セレギリン塩酸塩、ラサギリンメシル酸塩、サフィナミドメシル酸塩)を投与中又は投与中止後2週間以内の患者[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
6. 用法及び用量
はじめ1回量としてノルトリプチリン10〜25mg相当量を1日3回経口投与する。又はその1日量を2回に分けて経口投与する。その後、症状および副作用を観察しつつ、必要ある場合は漸次増量する。通常最大量は1日量としてノルトリプチリン150mg相当量以内であり、これを2〜3回に分けて経口投与する。
8. 重要な基本的注意
8.1 うつ症状を呈する患者は希死念慮があり、自殺企図のおそれがあるので、このような患者は投与開始早期並びに投与量を変更する際には患者の状態及び病態の変化を注意深く観察すること。[5.、8.2、8.3、8.4、9.1.6、9.1.9、15.1.1参照]
8.2 不安、焦燥、興奮、パニック発作、不眠、易刺激性、敵意、攻撃性、衝動性、アカシジア/精神運動不穏、軽躁、躁病等があらわれることが報告されている。また、因果関係は明らかではないが、これらの症状・行動を来した症例において、基礎疾患の悪化又は自殺念慮、自殺企図、他害行為が報告されている。患者の状態及び病態の変化を注意深く観察するとともに、これらの症状の増悪が観察された場合には、服薬量を増量せず、徐々に減量し、中止するなど適切な処置を行うこと。[5.、8.1、8.3、8.4、9.1.6、9.1.7、9.1.8、9.1.9、15.1.1参照]
8.3 家族等に自殺念慮や自殺企図、興奮、攻撃性、易刺激性等の行動の変化及び基礎疾患悪化があらわれるリスク等について十分説明を行い、医師と緊密に連絡を取り合うよう指導すること。[5.、8.1、8.2、8.4、9.1.6、9.1.7、9.1.8、9.1.9、15.1.1参照]
8.5 投与量の急激な減少ないし投与の中止により、嘔気、頭痛、倦怠感、易刺激性、情動不安、睡眠障害等の離脱症状があらわれることがある。投与を中止する場合には、徐々に減量するなど慎重に行うこと。
8.6 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には、自動車の運転など危険を伴う機械の操作に従事させないよう注意すること。
8.8 心室性頻拍(Torsades de pointesを含む)が報告されているので、定期的に心電図検査を行うなど観察を十分に行うこと。[11.1.6参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 排尿困難のある患者
排尿困難が悪化するおそれがある。
9.1.2 眼圧上昇のある患者
眼圧上昇が悪化するおそれがある。
9.1.3 開放隅角緑内障の患者
抗コリン作用により眼圧が上昇し、症状を悪化させることがある。
9.1.4 心不全・心筋梗塞・狭心症・不整脈(発作性頻拍・刺激伝導障害等)等の心疾患のある患者又は甲状腺機能亢進症の患者(心筋梗塞の回復初期の患者を除く)
循環器系に影響を及ぼすことがある。
9.1.5 てんかん等の痙れん性疾患又はこれらの既往歴のある患者
痙れんを起こすことがある。[11.1.1参照]
9.1.6 躁うつ病患者
9.1.7 脳の器質障害又は統合失調症の素因のある患者
9.1.8 衝動性が高い併存障害を有する患者
9.1.9 自殺念慮又は自殺企図の既往のある患者、自殺念慮のある患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。三環系抗うつ剤(イミプラミン)では、動物実験(ウサギ)で催奇形性(外形異常)が報告されている。
9.6 授乳婦
授乳中の女性に投与する場合には、治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。授乳中の女性に125mg注)経口投与した症例で母乳中への移行が認められている(外国人データ)。
注)本剤の承認された用法及び用量は「通常最大量は1日量としてノルトリプチリン150mg相当量以内であり、これを2〜3回に分けて経口投与」である。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
少量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。起立性低血圧、ふらつき、抗コリン作用による口渇、排尿困難、便秘、眼圧上昇等があらわれやすい。
10. 相互作用
相互作用序文
本剤は、主として薬物代謝酵素CYP2D6によって代謝される。[16.4.4参照]
薬物代謝酵素用語
CYP2D6
10.1 併用禁忌
| モノアミン酸化酵素阻害剤 セレギリン塩酸塩(エフピー) ラサギリンメシル酸塩(アジレクト) サフィナミドメシル酸塩(エクフィナ) [2.5参照] | 発汗、不穏、全身痙れん、異常高熱、昏睡等があらわれることがある。 モノアミン酸化酵素阻害剤の投与を受けた患者に本剤を投与する場合には、少なくとも2週間の間隔をおき、また本剤からモノアミン酸化酵素阻害剤に切り替えるときには、2〜3日間の間隔をおくことが望ましい。 | 詳細は不明であるが、相加・相乗作用によると考えられる。 |
10.2 併用注意
| 抗コリン作用を有する薬剤 フェノチアジン系薬剤 ブチロフェノン系薬剤 等 | 口渇、便秘、排尿困難、眼圧上昇等があらわれることがある。 | 併用により抗コリン作用が増強される。 |
| バルプロ酸ナトリウム | 本剤の作用が増強することがある。 | 併用により本剤の血中濃度が上昇する。 |
| 中枢神経抑制剤 バルビツール酸誘導体等 | 眠気、脱力感、倦怠感、ふらつきがあらわれることがある。 | 併用により中枢神経抑制作用が増強される。 |
| アルコール | 本剤の中枢神経抑制作用が増強することがある。 | 併用により中枢神経抑制作用が増強される。 |
| アドレナリン作動薬 アドレナリン ノルアドレナリン 等 | 過度の交感神経興奮、重篤な高血圧、異常高熱等があらわれることがある。 | 三環系抗うつ剤は交感神経終末へのノルアドレナリンの取り込みを抑制し、作用が増強される。 |
| リファンピシン | 本剤の作用が減弱することがある。 | リファンピシンの肝CYP誘導作用により、本剤の代謝が促進する。 |
| スルファメトキサゾール・トリメトプリム | 本剤の作用が減弱することがある。 | 機序は不明である。 |
| キニジン | 本剤の血中濃度が上昇することがある。 | キニジンの肝CYP2D6阻害作用により、本剤の代謝が抑制される。 |
| クマリン系抗凝血剤 ワルファリン | クマリン系抗凝血剤の血中濃度半減期が延長することがある。 | 本剤がワルファリンの肝代謝を抑制するとの報告がある。 |
| 血糖降下剤 インスリン 経口血糖降下剤 | これらの薬剤の血糖降下作用が増強することがある。 | 機序は不明であるが、本剤がインスリン感受性を増強するなどの報告がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 てんかん発作(頻度不明)[9.1.5参照]
11.1.2 無顆粒球症(頻度不明)
異常(前駆症状として、発熱、咽頭痛、インフルエンザ様症状等があらわれる場合もある)が認められた場合には、投与を中止すること。[8.7参照]
11.1.3 麻痺性イレウス(頻度不明)
腸管麻痺(食欲不振、悪心・嘔吐、著しい便秘、腹部の膨満又は弛緩及び腸内容物のうっ滞等の症状)をきたし、麻痺性イレウスに移行することがあるので、腸管麻痺があらわれた場合には、投与を中止すること。なお、この悪心・嘔吐は、本剤の制吐作用により不顕性化することもあるので、注意すること。
11.1.4 悪性症候群(頻度不明)
無動緘黙、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗等が発現し、それにひきつづき発熱が認められる場合は、投与を中止し、体冷却、水分補給等の全身管理とともに適切な処置を行うこと。
11.1.5 抗利尿ホルモン不適合分泌症候群(SIADH)(頻度不明)
11.1.6 心室性頻拍(Torsades de pointesを含む)(頻度不明)[8.8参照]
11.2 その他の副作用
| 1%以上注3) | 1%未満注3) | 頻度不明 | |
| 循環器 | 血圧降下 | 血圧上昇、頻脈 | 動悸、心電図異常(QT延長等) |
| 精神神経系 | 眠気、不眠、振戦等のパーキンソン症状、焦燥 | 不安、耳鳴、知覚異常 | 幻覚、せん妄、精神錯乱、運動失調 |
| 抗コリン作用 | 口渇(14.8%)、便秘 | 排尿困難、視調節障害、鼻閉 | 眼圧上昇 |
| 過敏症 | 発疹、そう痒感 | ||
| 血液注1) | 白血球減少 | ||
| 肝臓 | 黄疸 | AST・ALTの上昇等の肝障害 | |
| 消化器 | 食欲不振 | 悪心、嘔吐、味覚異常、下痢 | |
| 長期投与注2) | 口周部等の不随意運動 | ||
| その他 | 眩暈、頭痛、倦怠感 | ふらつき、発汗 |
13. 過量投与
13.1 症状
昏睡、錯乱、不安、激越、異常高熱、筋強剛、反射亢進、痙れん、不整脈、伝導障害を示す心電図異常、うっ血性心不全、ショック、嘔吐等があらわれる。
13.2 処置
特異的な解毒剤は知られていない。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外で実施された大うつ病性障害等の精神疾患を有する患者を対象とした、複数の抗うつ剤の短期プラセボ対照臨床試験の検討結果において、24歳以下の患者では、自殺念慮や自殺企図の発現のリスクが抗うつ剤投与群でプラセボ群と比較して高かった。なお、25歳以上の患者における自殺念慮や自殺企図の発現のリスクの上昇は認められず、65歳以上においてはそのリスクが減少した。[5.、8.1、8.2、8.3、8.4、9.1.6、9.1.9参照]
15.1.2 主に50歳以上を対象に実施された海外の疫学調査において、選択的セロトニン再取り込み阻害剤及び三環系抗うつ剤を含む抗うつ剤を投与された患者で、骨折のリスクが上昇したとの報告がある。
16. 薬物動態
16.1 血中濃度
| 投与量(mg) | 投与例数(例) | Tmax(h) | Cmax(ng/mL) | AUC0-72hr(ng・h/mL) | t1/2(h) |
| 25 | 19 | 4.8±0.4 | 18.3±4.4 | 469.2±119.5 | 26.7±8.5 |
16.3 分布
16.3.1 血漿蛋白結合率
約94%(in vitro、ヒト血漿、限外ろ過法)3)
16.4 代謝
16.4.1 主な代謝産物
10-hydroxynortriptyline(10-OH-NT)、desmethylnortriptyline(DNT)、10-hydroxydesmethylnortriptyline(10-OH-DNT)4)
16.4.2 代謝経路
主に肝臓において10位の水酸化体、N位の脱メチル体に代謝される。一部は抱合を受ける4)(外国人データ)。
16.4.3 初回通過効果
41〜54%5)(外国人データ)
16.4.4 代謝酵素
主としてCYP2D6(ノルトリプチリンの10位の水酸化)[10.参照]
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
ノルアドレナリンの再取り込みを選択的に阻害し、シナプス間隙のノルアドレナリン量を増加させることにより、抗うつ作用を示すことが考えられている。
18.2 モノアミン再取り込み阻害作用
ラット脳シナプトゾームにおいて、ノルアドレナリン、セロトニン、ドパミンいずれの再取り込みも阻害するが、特にノルアドレナリンに対して強い阻害作用を示す13)(in vitro)。
18.3 レセルピン拮抗作用
レセルピンによる体温下降作用に対し、抑制作用を示す14)(マウス、腹腔内投与)。
19. 有効成分に関する理化学的知見
19.1. ノルトリプチリン塩酸塩
22. 包装
<ノリトレン錠10mg>
1,000錠[10錠(PTP)×100]
500錠[瓶、バラ]
<ノリトレン錠25mg>
1,000錠[10錠(PTP)×100]
500錠[瓶、バラ]
23. 主要文献
- Beckstrom D.,et al., JAMA., 241, 133, (1979) »PubMed
- Luzecky M.H.,et al., South.Med.J., 67, 495-497, (1974) »PubMed
- Borga O.,et al., Biochem.Pharmacol., 18, 2135-2143, (1969) »PubMed
- Alexanderson B., Eur.J.Clin.Pharmacol., 5, 174-180, (1973)
- Gram L.F.,et al., Clin.Pharmacol.Ther., 18, 305-314, (1975) »PubMed
- 葉田 裕ほか, 臨床精神医学., 5, 250-256, (1976)
- 栗原雅直ほか, 臨床評価., 1, 27-51, (1972)
- 小河原龍太郎ほか, 診療., 18, 1863-1874, (1965)
- 佐々木邦幸ほか, 精神医学., 8, 949-954, (1966)
- 三浦岱栄ほか, 診療と新薬., 2, 603-612, (1965)
- 平井宏之, 診療と新薬., 10, 1135-1140, (1973)
- 村崎光邦ほか, 診療と新薬., 9, 2197-2207, (1972)
- Richelson E.,et al., Eur.J.Pharmacol., 104, 277-286, (1984) »PubMed
- 広岡哲夫ほか, 医学研究., 40, 289-304, (1970)
24. 文献請求先及び問い合わせ先
文献請求先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
製品情報問い合わせ先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
26. 製造販売業者等
26.1 製造販売元
住友ファーマ株式会社
大阪市中央区道修町2-6-8
26.2 提携
H.ルンドベック社
デンマーク