医薬品情報
| 総称名 | アレビアチン |
|---|---|
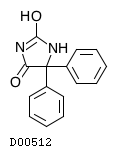
| 一般名 | フェニトイン |
| 欧文一般名 | Phenytoin |
| 製剤名 | フェニトインナトリウム注射液 |
| 薬効分類名 | 抗けいれん剤 |
| 薬効分類番号 | 1132 |
| ATCコード | N03AB02 |
| KEGG DRUG |
D02103
フェニトインナトリウム
|
| KEGG DGROUP |
DG00846
フェニトイン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アレビアチン注250mg | ALEVIATIN Injection | 住友ファーマ | 1132400A1033 | 123円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分又はヒダントイン系化合物に対し過敏症の患者
2.2 洞性徐脈、高度の刺激伝導障害のある患者[心停止を起こすことがある。][11.1.7参照]
2.3 タダラフィル(肺高血圧症を適応とする場合)、マシテンタン、チカグレロル、アルテメテル・ルメファントリン、ダルナビル・コビシスタット、ドラビリン、ルラシドン、イサブコナゾニウム、エンシトレルビル、ニルマトレルビル・リトナビル、ミフェプリストン・ミソプロストール、リルピビリン、リルピビリン・テノホビル アラフェナミド・エムトリシタビン、ビクテグラビル・エムトリシタビン・テノホビル アラフェナミド、ダルナビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド、エルビテグラビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド、ソホスブビル・ベルパタスビル、ソホスブビル、レジパスビル・ソホスブビル、ドルテグラビル・リルピビリン、カボテグラビル、レナカパビルを投与中の患者[10.1参照]
4. 効能または効果
○てんかん様けいれん発作が長時間引き続いて起こる場合(てんかん発作重積症)
○経口投与が不可能でかつけいれん発作の出現が濃厚に疑われる場合(特に意識障害、術中、術後)
○急速にてんかん様けいれん発作の抑制が必要な場合
6. 用法及び用量
本剤の有効投与量は、発作の程度、患者の耐薬性などにより異なるが、通常成人には、本剤2.5〜5mL(フェニトインナトリウムとして125〜250mg)を1分間1mLを越えない速度で徐々に静脈内注射する。
以上の用量で発作が抑制できない時には、30分後さらに2〜3mL(フェニトインナトリウムとして100〜150mg)を追加投与するか、他の対策を考慮する。
小児には成人量を基準として、体重により決定する。
本剤の投与により、けいれんが消失し、意識が回復すれば経口投与に切り換える。
以上の用量で発作が抑制できない時には、30分後さらに2〜3mL(フェニトインナトリウムとして100〜150mg)を追加投与するか、他の対策を考慮する。
小児には成人量を基準として、体重により決定する。
本剤の投与により、けいれんが消失し、意識が回復すれば経口投与に切り換える。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.1 混合発作型では、単独投与により小発作の誘発又は増悪を招くことがある。
8.4 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転など危険を伴う機械の操作に従事させないよう注意すること。
8.5 長期投与例で、小脳萎縮があらわれることがあり、持続した本剤の血中濃度上昇との関連が示唆されているので、小脳症状(眼振、構音障害、運動失調等)に注意し、定期的に検査を行うなど観察を十分に行うこと。[11.1.10参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 虚弱者
9.1.2 心疾患のある患者
9.1.3 血液障害のある患者
9.1.4 甲状腺機能低下症の患者
甲状腺機能の異常をきたすおそれがある。
9.1.5 糖尿病の患者
2型糖尿病の患者で、高血糖を起こしたとの報告がある。
9.3 肝機能障害患者
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性(母体のてんかん発作頻発を防ぎ、胎児を低酸素状態から守る)が危険性を上回ると判断される場合にのみ投与すること。妊娠中に本剤を投与された患者の中に、口唇裂、口蓋裂、心奇形等を有する児を出産した例が多いとの疫学的調査報告がある。
9.5.2 妊娠中にやむを得ず本剤を投与する場合には、可能な限り単独投与することが望ましい。妊娠中に他の抗てんかん剤(特にプリミドン)と併用して投与された患者群に、奇形を有する児を出産した例が本剤単独投与群と比較して多いとの疫学的調査報告がある。
9.5.3 妊娠中の投与により、児に腫瘍(神経芽細胞腫等)がみられたとの報告がある。
9.5.4 妊娠中の投与により、新生児に出血傾向があらわれることがある。
9.5.5 妊娠中の投与により、葉酸低下が生じるとの報告がある。
9.6 授乳婦
授乳しないことが望ましい。ヒトで乳汁中への移行が報告されている1)。
9.8 高齢者
10. 相互作用
相互作用序文
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
CYP2C19
薬物代謝酵素用語
CYP3A
薬物代謝酵素用語
CYP2B6
薬物代謝酵素用語
P糖蛋白
10.1 併用禁忌
| タダラフィル(肺高血圧症を適応とする場合) アドシルカ マシテンタン オプスミット チカグレロル ブリリンタ アルテメテル・ルメファントリン リアメット配合錠 ダルナビル・コビシスタット プレジコビックス配合錠 ドラビリン ピフェルトロ ルラシドン ラツーダ リルピビリン エジュラント イサブコナゾニウム クレセンバ エンシトレルビル ゾコーバ ニルマトレルビル・リトナビル パキロビッド [2.3参照] | これらの薬剤の代謝が促進され、血中濃度が低下することがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導による。 |
| ミフェプリストン・ミソプロストール メフィーゴ [2.3参照] | ミフェプリストンの血中濃度が低下し、効果が減弱するおそれがある。本剤を中止してミフェプリストンを用いる場合は、本剤の影響がなくなるまで投与しないこと。 | 本剤の肝薬物代謝酵素(CYP3A)誘導による。 |
| リルピビリン・テノホビル アラフェナミド・エムトリシタビン オデフシィ配合錠 [2.3参照] | リルピビリン及びテノホビル アラフェナミドの血中濃度が低下することがある。 | 本剤の肝薬物代謝酵素(CYP3A)及びP糖蛋白誘導による。 |
| ビクテグラビル・エムトリシタビン・テノホビル アラフェナミド ビクタルビ配合錠 [2.3参照] | ビクテグラビル及びテノホビル アラフェナミドの血中濃度が低下することがある。 | 本剤の肝薬物代謝酵素(CYP3A)及びP糖蛋白誘導による。 |
| ダルナビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド シムツーザ配合錠 [2.3参照] | ダルナビル、コビシスタット及びテノホビル アラフェナミドの血中濃度が低下することがある。 | 本剤の肝薬物代謝酵素(CYP3A)及びP糖蛋白誘導による。 |
| エルビテグラビル・コビシスタット・エムトリシタビン・テノホビル アラフェナミド ゲンボイヤ配合錠 [2.3参照] | エルビテグラビル、コビシスタット及びテノホビル アラフェナミドの血中濃度が低下することがある。 | 本剤の肝薬物代謝酵素(CYP3A)及びP糖蛋白誘導による。 |
| ソホスブビル・ベルパタスビル エプクルーサ配合錠 [2.3参照] | ソホスブビル及びベルパタスビルの血中濃度が低下することがある。 | 本剤の肝薬物代謝酵素(CYP3A)及びP糖蛋白誘導による。 |
| ソホスブビル ソバルディ レジパスビル・ソホスブビル ハーボニー配合錠 [2.3参照] | これらの薬剤の血中濃度が低下することがある。 | 本剤のP糖蛋白誘導による。 |
| ドルテグラビル・リルピビリン ジャルカ配合錠 [2.3参照] | ドルテグラビル及びリルピビリンの血中濃度が低下することがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用及びUGT1A1誘導作用による。 |
| カボテグラビル ボカブリア [2.3参照] | カボテグラビルの血中濃度が低下するおそれがある。 | 本剤のUGT1A1誘導作用によると考えられている。 |
| レナカパビル シュンレンカ [2.3参照] | レナカパビルの血中濃度が低下するおそれがある。 | 本剤の肝薬物代謝酵素(CYP3A)誘導作用、P糖蛋白誘導作用及びUGT1A1誘導作用による。 |
10.2 併用注意
| ゾニサミド トピラマート ボリコナゾール スチリペントール | (1)フェニトインの血中濃度が上昇することがある注1)。 (2)これらの薬剤の血中濃度が低下することがある注2)。 | (1)これらの薬剤が肝代謝を抑制すると考えられている。 (2)本剤の肝薬物代謝酵素誘導によると考えられている。 |
| クロバザム タクロリムス テラプレビル | (1)フェニトインの血中濃度が上昇することがある注1)。 (2)これらの薬剤の血中濃度が低下することがある注2)。 | (1)機序は不明である。 (2)本剤の肝薬物代謝酵素誘導による。 |
| ルフィナミド | (1)フェニトインの血中濃度が上昇することがある注1)。 (2)これらの薬剤の血中濃度が低下することがある注2)。 | (1)、(2)機序は不明である。 |
| カルバマゼピン | (1)フェニトインの血中濃度が上昇することがある注1)。 (2)フェニトインの血中濃度が低下することがある注3)。 (3)これらの薬剤の血中濃度が低下することがある注2)。 | (1)カルバマゼピンが肝代謝を抑制する。 (2)カルバマゼピンの肝薬物代謝酵素誘導による。 (3)本剤の肝薬物代謝酵素誘導による。 |
| ネルフィナビル | (1)フェニトインの血中濃度が上昇することがある注1)。 (2)フェニトインの血中濃度が低下することがある注3)。 (3)これらの薬剤の血中濃度が低下することがある注2)。 | (1)ネルフィナビルが肝代謝を抑制すると考えられている。 (2)機序は不明である。 (3)機序は不明であるが、本剤の肝薬物代謝酵素誘導等が考えられている。 |
| バルプロ酸 | (1)フェニトインの血中濃度が上昇することがある注1)。 (2)フェニトインの血中濃度が低下することがある注3)。 (3)バルプロ酸の血中濃度が低下することがある注2)。 (4)バルプロ酸による高アンモニア血症のリスクが増加するとの報告がある。 | (1)バルプロ酸が肝代謝を抑制する。 (2)バルプロ酸による蛋白結合からの置換により、遊離フェニトイン濃度が上昇し、肝代謝が促進すると考えられている。 (3)本剤の肝薬物代謝酵素誘導による。 (4)機序は不明である。 |
| クマリン系抗凝血剤 ワルファリン | (1)フェニトインの血中濃度が上昇することがある注1)。 (2)クマリン系抗凝血剤の作用が増強することがある。 (3)クマリン系抗凝血剤の作用が減弱することがある。 通常より頻回に血液凝固時間の測定を行い、クマリン系抗凝血剤の用量を調整すること。 | (1)クマリン系抗凝血剤が肝代謝を抑制する。 (2)本剤による蛋白結合からの置換により、クマリン系抗凝血剤の血中濃度が上昇する。 (3)本剤の肝薬物代謝酵素誘導による。 |
| CYP2C9又はCYP2C19を阻害する薬剤 アミオダロン クロラムフェニコール シメチジン スルファメトキサゾール・トリメトプリム チクロピジン フルコナゾール フルボキサミン ホスフルコナゾール ミコナゾール セリチニブ アシミニブ ニチシノン | フェニトインの血中濃度が上昇することがある注1)。 | これらの薬剤又は代謝物が肝代謝を抑制すると考えられている。 |
| アロプリノール イソニアジド エトスクシミド オメプラゾール ジスルフィラム ジルチアゼム スルチアム パラアミノサリチル酸 メチルフェニデート エソメプラゾール | フェニトインの血中濃度が上昇することがある注1)。 | これらの薬剤又は代謝物が肝代謝を抑制すると考えられている。 |
| フルオロウラシル系薬剤 テガフール製剤 ドキシフルリジン 等 三環系抗うつ剤 イミプラミン等 四環系抗うつ剤 マプロチリン等 トラゾドン | フェニトインの血中濃度が上昇することがある注1)。 | 機序は不明である。 |
| テオフィリン アミノフィリン | (1)フェニトインの血中濃度が低下することがある注3)。 (2)テオフィリンの血中濃度が低下することがある注2)。 | (1)機序は不明である。 (2)本剤の肝薬物代謝酵素誘導による。 |
| リファンピシン アパルタミド レテルモビル | フェニトインの血中濃度が低下することがある注3)。 | これらの薬剤の肝薬物代謝酵素誘導による。 |
| ジアゾキシド シスプラチン ビンカアルカロイド ビンクリスチン等 シプロフロキサシン ビガバトリン | フェニトインの血中濃度が低下することがある注3)。 | 機序は不明である。 |
| イリノテカン | イリノテカンの活性代謝物の血中濃度が低下し、作用が減弱することがあるので、併用を避けることが望ましい。 | 本剤の肝薬物代謝酵素誘導による。 |
| 主にCYP3Aの基質となる薬剤 アゼルニジピン イトラコナゾール イマチニブ オンダンセトロン キニジン クエチアピン ジソピラミド ニソルジピン ニフェジピン フェロジピン プラジカンテル ベラパミル 等 副腎皮質ホルモン剤 デキサメタゾン等 卵胞ホルモン剤・黄体ホルモン剤 ノルゲストレル・エチニルエストラジオール等 PDE5阻害剤 タダラフィル(勃起不全、前立腺肥大症に伴う排尿障害を適応とする場合:シアリス、ザルティア) シルデナフィル バルデナフィル | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤の肝薬物代謝酵素誘導による。 |
| パロキセチン フレカイニド メキシレチン | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤の肝薬物代謝酵素誘導による。 |
| CYP3A及びP糖蛋白の基質となる薬剤 アピキサバン ミラベグロン レンバチニブ 等 | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤の肝薬物代謝酵素及びP糖蛋白誘導による。 |
| P糖蛋白の基質となる薬剤 グレカプレビル・ピブレンタスビル テノホビル アラフェナミド ニンテダニブ 等 | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤のP糖蛋白誘導による。 |
| ラモトリギン デフェラシロクス カナグリフロジン ラルテグラビル | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤がこれらの薬剤のグルクロン酸抱合を促進する。 |
| ポサコナゾール | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤のUGT1A4及び/又はP糖蛋白誘導による。 |
| シクロスポリン | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤の肝薬物代謝酵素誘導による。また、本剤が吸収を阻害する。 |
| 甲状腺ホルモン剤 レボチロキシン等 | これらの薬剤の血中濃度が低下することがある注2)。 | 機序は不明である。 |
| カスポファンギン | これらの薬剤の血中濃度が低下することがある注2)。 | 本剤がカスポファンギンの取り込み輸送過程に影響し、カスポファンギンのクリアランス誘導が起こると考えられている。 |
| ドルテグラビル ドルテグラビル・ラミブジン ドルテグラビル・アバカビル・ラミブジン | ドルテグラビルの血中濃度が低下することがある。 | 本剤の肝薬物代謝酵素(CYP3A)及びUGT1A1誘導作用による。 |
| ドキシサイクリン | ドキシサイクリンの血中濃度半減期が短縮することがある。 | 本剤の肝薬物代謝酵素誘導による。 |
| アルベンダゾール | アルベンダゾールの活性代謝物の血中濃度が低下し、効果が減弱することがある。 | 機序は不明である。 |
| 非脱分極性筋弛緩剤 ベクロニウム等 | フェニトインを長期前投与した場合、非脱分極性筋弛緩剤の作用が減弱することがある。 | 機序は不明である。 |
| 血糖降下剤 インスリン 経口血糖降下剤 | 血糖降下剤の作用が減弱され、高血糖を起こすことがあるので、血糖の上昇に注意すること。 | 本剤のインスリン分泌抑制作用による。 |
| アセタゾラミド [11.2参照] | くる病、骨軟化症があらわれやすい。 | 本剤によるビタミンD不活性化促進、アセタゾラミドによる代謝性アシドーシス、腎尿細管障害の影響が考えられている。 |
| アセトアミノフェン | 本剤の長期連用者は、アセトアミノフェンの代謝物による肝機能障害を生じやすくなる。 | 本剤の肝薬物代謝酵素誘導により、アセトアミノフェンから肝毒性を持つN-アセチル-p-ベンゾキノンイミンへの代謝が促進されると考えられている。 |
| セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 | フェニトインの代謝が促進され、血中濃度が低下するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | セイヨウオトギリソウの肝薬物代謝酵素誘導によると考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
発熱、紅斑、水疱・びらん、そう痒感、咽頭痛、眼充血、口内炎等の異常が認められた場合には、投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.2 過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、さらにリンパ節腫脹、肝機能障害等の臓器障害、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、発疹、発熱、肝機能障害等の症状が、投与中止後も再燃あるいは遷延化することがあるので注意すること。
11.1.3 SLE様症状(頻度不明)
発熱、紅斑、関節痛、肺炎、白血球減少、血小板減少、抗核抗体陽性等のSLE様症状があらわれることがある。
11.1.5 劇症肝炎、肝機能障害、黄疸(いずれも頻度不明)
11.1.6 間質性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎(肺臓炎)があらわれることがある。このような症状があらわれた場合には、投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.7 心停止、心室細動、呼吸停止(いずれも頻度不明)
11.1.8 強直発作(頻度不明)
11.1.9 悪性リンパ腫、リンパ節腫脹(いずれも頻度不明)
11.1.10 小脳萎縮(頻度不明)
長期投与例であらわれることがある。[8.5参照]
11.1.11 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等があらわれることがある。また、横紋筋融解症による急性腎障害の発症に注意すること。
11.1.12 急性腎障害、間質性腎炎(いずれも頻度不明)[8.3参照]
11.1.13 悪性症候群(頻度不明)
発熱、意識障害、筋強剛、不随意運動、発汗、頻脈等があらわれた場合には、本剤の投与中止、体冷却、水分補給、呼吸管理等の適切な処置を行うこと。本症発症時には、白血球の増加や血清CKの上昇がみられることが多く、また、ミオグロビン尿を伴う腎機能の低下がみられることがある。
11.2 その他の副作用
| 頻度不明 | |
| 過敏症 | 猩紅熱様・麻疹様・中毒疹様発疹 |
| 血液 | 巨赤芽球性貧血 |
| 肝臓 | AST・ALT・γ-GTPの上昇等の肝機能障害、黄疸 |
| 腎臓 | 蛋白尿等の腎障害 |
| 精神神経系 | 不随意運動(ジスキネジア、舞踏病アテトーゼ、アステリキシス(asterixis)等)、ニューロパシー、注意力・集中力・反射運動能力等の低下、倦怠感、けいれん・てんかん増悪 |
| 消化器 | 歯肉増殖注1) |
| 骨・歯注2) | くる病注3)、骨軟化症注3)、歯牙の形成不全 |
| 内分泌系 | 甲状腺機能検査値(血清T3、T4値等)の異常、高血糖 |
| その他 | 口渇、血管痛、血清葉酸値の低下、CK上昇、免疫グロブリン低下(IgA、IgG等) |
13. 過量投与
13.1 症状
13.2 処置
特異的解毒剤は知られていない。また、フェニトインは血漿蛋白と完全には結合していないので、重症の場合は、血液透析を考慮すること。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は強アルカリ性であるので、他剤とは配合できない。また、pHが低下するとフェニトインの結晶を析出する。
14.2 薬剤投与時の注意
14.2.1 強アルカリ性で組織障害を起こすおそれがあるので、皮下、筋肉内又は血管周辺には注射しないこと。
14.2.2 動脈内に注射した場合には、末梢の壊死を起こすおそれがあるので、動脈内には絶対に注射しないこと。
14.2.3 静脈内注射に際しては、薬液が血管外に漏れると疼痛、発赤、腫脹等の炎症、壊死を起こすことがあるので、慎重に投与すること。
14.2.4 静脈内注射時に、血管外漏出が明らかではない場合においても、投与部位に皮膚の変色、疼痛、浮腫が起こり、次第に遠位部に広がり、さらに壊死に至ることもあるので、観察を十分に行い、このような症状があらわれた場合には、適切な処置を行うこと。
14.2.5 静脈内注射により血管痛を起こすことがあるので、注射部位、注射方法等について十分注意すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 血清免疫グロブリン(IgA、IgG等)の異常があらわれることがある。
15.1.2 経腸栄養剤を投与中の患者で、本剤の血中濃度が低下したとの報告がある。
15.1.3 本剤と他の抗てんかん薬(フェノバルビタール、カルバマゼピン)との間に交差過敏症(過敏症症候群を含む皮膚過敏症)を起こしたとの報告がある。
15.1.4 海外で実施された複数の抗てんかん薬における、てんかん、精神疾患等を対象とした199のプラセボ対照臨床試験の検討結果において、自殺念慮及び自殺企図の発現のリスクが、抗てんかん薬の服用群でプラセボ群と比較して約2倍高く(抗てんかん薬服用群:0.43%、プラセボ群:0.24%)、抗てんかん薬の服用群では、プラセボ群と比べ1,000人あたり1.9人多いと計算された(95%信頼区間:0.6〜3.9)。また、てんかん患者のサブグループでは、プラセボ群と比べ1,000人あたり2.4人多いと計算されている。
16. 薬物動態
16.1 血中濃度
| Cmax | t1/2β(h) |
| データなし | 約10 |
16.3 分布
16.3.1 血漿蛋白結合率
約90%(in vitro、ヒト血漿、約20μg/mL、限外ろ過法)3)
16.4 代謝
16.4.1 主な代謝産物及び代謝経路
16.4.2 代謝酵素
16.5 排泄
16.5.1 排泄経路
主として尿中2)
16.5.2 排泄率
尿中排泄率は、総HPPHとして24時間以内に54.0〜58.0%、最終的に82.4〜93.0%、フェニトインとして0.4〜0.7%であった2)(健康成人、250mg 1回静脈内投与)。
16.7 薬物相互作用
18. 薬効薬理
18.1 作用機序
フェニトインナトリウムはマウス、ラット等の最小電撃けいれん閾値やペンテトラゾールけいれん閾値に対してほとんど作用を及ぼさないが、最大電撃けいれんに対してそのパターンを変える作用があり、最大電撃けいれんの強直相を強く抑制する8)9)10)11)。
また、本剤は神経膜を安定化し12)、シナプスにおけるpost-tetanic potentiation(PTP)を抑制する13)。
これらのことから、本剤の抗けいれん作用は、けいれん閾値を上昇させることによってもたらされるのではなく、発作焦点からのてんかん発射のひろがりを阻止することによるものと考えられている11)14)。
フェニトインナトリウムをマウスに静注すると、最大電撃けいれん抑制作用は約30分後にピークとなり、その値は1.5時間持続し、以後徐々に減少する15)。
また、本剤は神経膜を安定化し12)、シナプスにおけるpost-tetanic potentiation(PTP)を抑制する13)。
これらのことから、本剤の抗けいれん作用は、けいれん閾値を上昇させることによってもたらされるのではなく、発作焦点からのてんかん発射のひろがりを阻止することによるものと考えられている11)14)。
フェニトインナトリウムをマウスに静注すると、最大電撃けいれん抑制作用は約30分後にピークとなり、その値は1.5時間持続し、以後徐々に減少する15)。
19. 有効成分に関する理化学的知見
19.1. フェニトイン
22. 包装
5mL[10アンプル]
23. 主要文献
- 鈴木喜八郎ほか, 周産期医学., 9, 1259-1264, (1979)
- Suzuki T.,et al., Chem.Pharm.Bull., 18, 405-411, (1970) »PubMed
- Hooper W.D.,et al., Clin.Pharmacol.Ther., 15, 276-282, (1974) »PubMed
- Butler T.C., J. Pharmacol.Exp.Ther., 119, 1-11, (1957) »PubMed
- Maynert E.W., J. Pharmacol.Exp.Ther., 130, 275-284, (1960) »PubMed
- Bajpai M.,et al., Drug Metab.Dispos., 24, 1401-1403, (1996) »PubMed
- Faucette S.R.,et al., Drug Metab.Dispos., 32, 348-358, (2004) »PubMed
- Swinyard E.A., J.Am.Pharm.Assoc., 38, 201-204, (1949) »PubMed
- Swinyard E.A.,et al., J.Pharmacol.Exp.Ther., 106, 319-330, (1952) »PubMed
- Goodman L.S.,et al., J.Pharmacol.Exp.Ther., 108, 168-176, (1953) »PubMed
- Rall T.W.&Schleifer L.S., GOODMAN and GILMAN's The Pharmacological Basis of Therapeutics 8th ed.Pergamon Press, 436-444, (1990)
- Korey S.R., Proc.Soc.Exp.Biol.Med., 76, 297-299, (1951) »PubMed
- Esplin D.W., J.Pharmacol.Exp.Ther., 120, 301-323, (1957) »PubMed
- Toman J.E.P., Neurology., 1, 444-460, (1951) »PubMed
- Ensor C.R.,et al., Proc.Soc.Exp.Biol.Med., 100, 133-135, (1959) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
製品情報問い合わせ先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
26. 製造販売業者等
26.1 製造販売元
住友ファーマ株式会社
大阪市中央区道修町2-6-8