医薬品情報
| 総称名 | カロナール |
|---|---|
| 一般名 | アセトアミノフェン |
| 欧文一般名 | Acetaminophen |
| 製剤名 | アセトアミノフェン細粒 |
| 薬効分類名 | 解熱鎮痛剤 |
| 薬効分類番号 | 1141 |
| ATCコード | N02BE01 |
| KEGG DRUG |
D00217
アセトアミノフェン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年10月 改訂(第2版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| カロナール細粒20% | CALONAL Fine Gran.20% | あゆみ製薬 | 1141007C1075 | 12.2円/g | 劇薬 |
| カロナール細粒50% | CALONAL Fine Gran.50% | あゆみ製薬 | 1141007C2020 | 13.6円/g | 劇薬 |
1. 警告
2. 禁忌
4. 効能または効果
○各種疾患及び症状における鎮痛
○下記疾患の解熱・鎮痛
急性上気道炎(急性気管支炎を伴う急性上気道炎を含む)
○小児科領域における解熱・鎮痛
6. 用法及び用量
<各種疾患及び症状における鎮痛>
通常、成人にはアセトアミノフェンとして、1回300〜1000mgを経口投与し、投与間隔は4〜6時間以上とする。なお、年齢、症状により適宜増減するが、1日総量として4000mgを限度とする。また、空腹時の投与は避けさせることが望ましい。
<急性上気道炎(急性気管支炎を伴う急性上気道炎を含む)>
通常、成人にはアセトアミノフェンとして、1回300〜500mgを頓用する。なお、年齢、症状により適宜増減する。ただし、原則として1日2回までとし、1日最大1500mgを限度とする。また、空腹時の投与は避けさせることが望ましい。
<小児科領域における解熱・鎮痛>
通常、乳児、幼児及び小児にはアセトアミノフェンとして、体重1kgあたり1回10〜15mgを経口投与し、投与間隔は4〜6時間以上とする。なお、年齢、症状により適宜増減するが、1日総量として60mg/kgを限度とする。ただし、成人の用量を超えない。また、空腹時の投与は避けさせることが望ましい。
7. 用法及び用量に関連する注意
7.1 乳児、幼児及び小児の1回投与量の目安は下記のとおり。[9.7.1参照]
| 体重 | 1回用量 | ||
| アセトアミノフェン | 細粒20% | 細粒50% | |
| 5kg | 50-75mg | 0.25-0.375g | 0.1-0.15g |
| 10kg | 100-150mg | 0.5-0.75g | 0.2-0.3g |
| 20kg | 200-300mg | 1.0-1.5g | 0.4-0.6g |
| 30kg | 300-450mg | 1.5-2.25g | 0.6-0.9g |
7.2 「小児科領域における解熱・鎮痛」の効能又は効果に対する1回あたりの最大用量はアセトアミノフェンとして500mg、1日あたりの最大用量はアセトアミノフェンとして1500mgである。
7.3 他の消炎鎮痛剤との併用は避けることが望ましい。
7.4 本剤とアセトアミノフェンを含む他の薬剤(一般用医薬品を含む)との併用により、アセトアミノフェンの過量投与による重篤な肝障害が発現するおそれがあることから、特に総合感冒剤や解熱鎮痛剤等の配合剤を併用する場合は、アセトアミノフェンが含まれていないか確認し、含まれている場合は併用を避けること。[1.2、8.6参照]
7.5 アスピリン喘息又はその既往歴のある患者に対する1回あたりの最大用量はアセトアミノフェンとして300mg以下とすること。[9.1.8参照]
8. 重要な基本的注意
8.1 解熱鎮痛剤による治療は原因療法ではなく対症療法であることから原因療法があればこれを行うこと。
8.2 重篤な肝障害が発現するおそれがあるので、1日総量1500mgを超す高用量で長期投与する場合には定期的に肝機能検査を行い、患者の状態を十分に観察すること。高用量でなくとも長期投与する場合にあっては定期的に肝機能検査を行うことが望ましい。また、高用量で投与する場合などは特に患者の状態を十分に観察すること。[1.1、11.1.4参照]
8.3 急性疾患に対し本剤を用いる場合には、次の事項を考慮すること。
・発熱、疼痛の程度を考慮し投与すること。
・原則として同一の薬剤の長期投与を避けること。
8.4 慢性疾患に対し本剤を用いる場合には、薬物療法以外の療法も考慮すること。
8.5 過度の体温下降、虚脱、四肢冷却等があらわれることがあるので、特に高熱を伴う高齢者及び小児等又は消耗性疾患の患者においては、投与後の患者の状態に十分注意すること。
8.7 アセトアミノフェンの高用量投与により副作用として腹痛・下痢がみられることがある。本剤においても同様の副作用があらわれるおそれがあり、上気道炎等に伴う消化器症状と区別できないおそれがあるので、観察を十分行い慎重に投与すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 アルコール多量常飲者
9.1.2 絶食・低栄養状態・摂食障害等によるグルタチオン欠乏、脱水症状のある患者
肝障害があらわれやすくなる。[11.1.4参照]
9.1.3 消化性潰瘍又はその既往歴のある患者
症状が悪化又は再発を促すおそれがある。
9.1.4 血液の異常又はその既往歴のある患者
症状が悪化又は再発を促すおそれがある。[11.1.5参照]
9.1.5 出血傾向のある患者
血小板機能異常が起こることがある。
9.1.6 心機能異常のある患者
症状が悪化又は心不全が増悪するおそれがある。
9.1.7 気管支喘息のある患者
症状が悪化するおそれがある。[11.1.3参照]
9.1.8 アスピリン喘息(非ステロイド性消炎鎮痛剤による喘息発作の誘発)又はその既往歴のある患者
9.1.9 感染症を合併している患者
必要に応じて適切な抗菌剤を併用し、観察を十分に行い慎重に投与すること。感染症を不顕性化するおそれがある。[10.2参照]
9.2 腎機能障害患者
9.2.1 腎障害又はその既往歴のある患者
投与量の減量、投与間隔の延長を考慮すること。症状が悪化又は再発を促すおそれがある。[11.1.7参照]
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。重篤な転帰をとるおそれがある。[2.1参照]
9.3.2 肝障害又はその既往歴のある患者(重篤な肝障害のある患者を除く)
肝障害が悪化するおそれがある。[11.1.4参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、次のリスクを考慮し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
・妊娠後期の女性への投与により胎児に動脈管収縮を起こすことがある。
・妊娠後期のラットに投与した実験で、弱い胎仔の動脈管収縮が報告されている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
9.7.1 副作用の発現に特に注意し、必要最小限の使用にとどめるなど慎重に投与すること。[7.1参照]
9.7.2 低出生体重児、新生児及び3ヵ月未満の乳児を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
副作用の発現に特に注意し、少量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。副作用があらわれやすい。
10. 相互作用
10.2 併用注意
| リチウム製剤 炭酸リチウム | 他の非ステロイド性消炎鎮痛剤(インドメタシン、イブプロフェン等)で、リチウムとの併用によりリチウムの血中濃度が上昇し、リチウム中毒を呈したとの報告がある。 | 非ステロイド性消炎鎮痛剤は腎のプロスタグランジン合成を抑制することにより、炭酸リチウムの排泄が減少し、血中濃度が上昇すると考えられている。 |
| チアジド系利尿剤 ヒドロクロロチアジド等 | 他の非ステロイド性消炎鎮痛剤(インドメタシン等)で、チアジド系利尿剤の作用を減弱することが報告されている。 | 非ステロイド性消炎鎮痛剤は腎のプロスタグランジン合成を抑制して水、塩類貯留が生じ、チアジド系利尿剤の排泄作用に拮抗すると考えられている。 |
| アルコール(飲酒) [9.1.1参照] | アルコール多量常飲者がアセトアミノフェンを服用したところ肝不全を起こしたとの報告がある。 | アルコール常飲によるCYP2E1の誘導により、アセトアミノフェンから肝毒性を持つN-アセチル-p-ベンゾキノンイミンへの代謝が促進される。 |
| クマリン系抗凝血剤 ワルファリンカリウム | クマリン系抗凝血剤の作用を増強することがあるので、減量するなど慎重に投与すること。 | 本剤が血漿蛋白結合部位において競合することで、抗凝血剤を遊離させ、その抗凝血作用を増強させる。 |
| カルバマゼピン フェノバルビタール フェニトイン プリミドン リファンピシン イソニアジド | これらの薬剤の長期連用者は、肝薬物代謝酵素が誘導され、肝障害を生じやすくなるとの報告がある。 | これらの薬剤の代謝酵素誘導作用により、アセトアミノフェンから肝毒性を持つN-アセチル-p-ベンゾキノンイミンへの代謝が促進される。 |
| 抗生物質 抗菌剤 [9.1.9参照] | 過度の体温下降を起こす頻度が高くなることから、併用する場合には観察を十分に行い、慎重に投与すること。 | 機序は不明である。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(呼吸困難、全身潮紅、血管浮腫、蕁麻疹等)があらわれることがある。[2.2参照]
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発疹性膿疱症(いずれも頻度不明)
11.1.4 劇症肝炎、肝機能障害、黄疸(いずれも頻度不明)
11.1.5 顆粒球減少症(頻度不明)[9.1.4参照]
11.1.6 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.7 間質性腎炎、急性腎障害(いずれも頻度不明)[9.2.1参照]
11.1.8 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
11.2 その他の副作用
| 頻度不明 | |
| 血液 | チアノーゼ、血小板減少、血小板機能低下(出血時間の延長)注) |
| 消化器 | 悪心・嘔吐、食欲不振 |
| その他 | 過敏症注) |
13. 過量投与
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 類似化合物(フェナセチン)の長期投与により、血色素異常を起こすことがある。
15.1.2 腎盂及び膀胱腫瘍の患者を調査したところ、類似化合物(フェナセチン)製剤を長期・大量に使用(例:総服用量1.5〜27kg、服用期間4〜30年)していた人が多いとの報告がある。
15.1.3 非ステロイド性消炎鎮痛剤を長期間投与されている女性において、一時的な不妊が認められたとの報告がある。
15.2 非臨床試験に基づく情報
15.2.1 類似化合物(フェナセチン)を長期・大量投与した動物実験で、腫瘍発生が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
<カロナール細粒20%>
クロスオーバー法により、健康成人男性に、カロナール細粒20% 2.0gと標準製剤(錠剤200mg)2錠(アセトアミノフェンとして400mg)をそれぞれ空腹時単回経口投与したとき、アセトアミノフェンの血中濃度及び薬物動態パラメータは以下のとおりであり、両剤の生物学的同等性が確認された2)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-12(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | t1/2(hr) | |
| カロナール細粒20%(細粒剤20%、2.0g) | 19.20±2.04 | 9.1±3.2 | 0.43±0.23 | 2.45±0.21 |
| 標準製剤(錠剤200mg、2錠) | 19.03±2.45 | 9.1±2.9 | 0.46±0.19 | 2.36±0.28 |
カロナール細粒20%
<カロナール細粒50%>
クロスオーバー法により、健康成人男性に、カロナール細粒50% 1.0gと標準製剤(細粒剤20%)2.5g(アセトアミノフェンとして500mg)をそれぞれ空腹時単回経口投与したとき、アセトアミノフェンの血中濃度及び薬物動態パラメータは以下のとおりであり、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-12(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | t1/2(hr) | |
| カロナール細粒50%(細粒剤50%、1.0g) | 27.36±6.60 | 10.3±3.2 | 0.43±0.18 | 2.86±0.36 |
| 標準製剤(細粒剤20%、2.5g) | 26.69±6.57 | 9.3±2.8 | 0.59±0.41 | 2.90±0.44 |
カロナール細粒50%
16.5 排泄
代謝物は主に尿中に排泄される。健康成人男性14例にアセトアミノフェン500mgを経口単回投与した結果、投与量の約80%が投与開始24時間後までに尿中に排泄された4)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
肝硬変患者は健常人に比べてAUC値は高く、クリアランスは低く、また半減期は長かった5)(外国人データ)。
17. 臨床成績
17.3 その他
<小児科領域における解熱>
17.3.1 小児科領域における解熱に対する臨床使用成績
カロナール細粒20%を用いて小児の解熱効果について検討した(投与量はアセトアミノフェン量として記載)。
(1)小児64例に対し、5.6〜7.3mg/kg注)を頓用投与した結果、有効率(有効以上)は64.1%(41/64)であった。副作用は認めなかった6)。
(2)小児30例に対し、Harnack用量に従い5.4〜10.0mg/kg注)を投与し、うち検温経過をはっきり観察できた20例について検討した結果、有効率(有効以上)は80.0%(16/20)であった。副作用は認めなかった7)。
(3)小児41例に対し、15mg/kgを頓用投与し、有効率(有効以上)は97.6%(40/41)であった。副作用は5例に36℃以下の体温下降を認めた8)。
(4)小児44例に対し、7.9mg/kg以下注)投与群16例(31回測定)、8.0〜10.0mg/kg注)投与群16例(27回測定)、10.1mg/kg以上注)投与群17例(19回測定)の有効性、安全性を確認した結果、7.9mg/kg以下投与群の有効率(有効以上)は51.6%(16/31回)、8.0〜10.0mg/kg投与群は77.8%(21/27回)、10.1mg/kg以上投与群は89.5%(17/19回)であり、全体としての有効率は70.1%(54/77回)であった。副作用は10.1mg以上投与群の3例に36℃以下の体温下降を認めた9)。
注)本剤の承認された用量は、体重1kgあたり1回10〜15mgである。
18. 薬効薬理
18.1 作用機序
アセトアミノフェンの作用の正確な部位や機序は完全には解明されていないが、作用機序としては、中枢神経系に作用し、プロスタグランジン合成、カンナビノイド受容体系又はセロトニン作動系などに影響を及ぼすと考えられている10)。
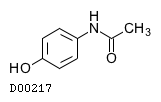
19. 有効成分に関する理化学的知見
19.1. アセトアミノフェン
22. 包装
<カロナール細粒20%>
100g[瓶、バラ、乾燥剤入り]
500g[瓶、バラ、乾燥剤入り]
0.5g×1,200包[分包]
1.0g×360包[分包]
1.0g×1,200包[分包]
<カロナール細粒50%>
100g[瓶、バラ、乾燥剤入り]
500g[瓶、バラ、乾燥剤入り]
0.6g×1,200包[分包]
1.0g×360包[分包]
1.0g×1,200包[分包]
23. 主要文献
- 門間和夫 他, 小児科の進歩2, 95-101, (1983), (診断と治療社)
- あゆみ製薬(株)社内資料:カロナール細粒20%の生物学的同等性試験
- あゆみ製薬(株)社内資料:カロナール細粒50%の生物学的同等性試験
- 大西明弘 他, 基礎と臨床, 27 (11), 4310-4321, (1993)
- Zapater,P.et al., Aliment Pharmacol Ther., 20 (1), 29-36, (2004) »PubMed
- 松田博雄 他, 基礎と臨床, 18 (1), 233-236, (1984)
- 塙 賢二, 基礎と臨床, 18 (2), 675-681, (1984)
- 木村昭彦 他, 小児科, 27 (2), 241-245, (1986)
- 黒須義宇 他, 基礎と臨床, 18 (7), 3157-3163, (1984)
- 鈴木孝治, ペインクリニック, 33 (2), 218-226, (2012)
24. 文献請求先及び問い合わせ先
文献請求先
あゆみ製薬株式会社
〒104-0061
東京都中央区銀座四丁目12番15号
電話:0120-137-413
製品情報問い合わせ先
あゆみ製薬株式会社
〒104-0061
東京都中央区銀座四丁目12番15号
電話:0120-137-413
26. 製造販売業者等
26.1 製造販売元
あゆみ製薬株式会社
東京都中央区銀座四丁目12番15号