医薬品情報
| 総称名 | ファモチジン |
|---|---|
| 一般名 | ファモチジン |
| 欧文一般名 | Famotidine |
| 薬効分類名 | H2受容体拮抗剤 |
| 薬効分類番号 | 2325 |
| ATCコード | A02BA03 |
| KEGG DRUG |
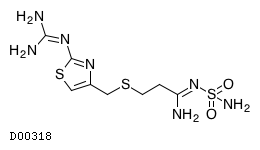
D00318
ファモチジン
|
| KEGG DGROUP |
DG01481
ヒスタミンH2受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年10月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ファモチジン錠10「サワイ」 (後発品) | FAMOTIDINE Tablets [SAWAI] | 沢井製薬 | 2325003F1040 | 10.4円/錠 | |
| ファモチジン錠20「サワイ」 (後発品) | FAMOTIDINE Tablets [SAWAI] | 沢井製薬 | 2325003F2055 | 10.4円/錠 | |
| ファモチジン細粒2%「サワイ」 (後発品) | FAMOTIDINE Fine Granules [SAWAI] | 沢井製薬 | 2325003B2045 | 10.2円/g | |
| ファモチジン散10%「サワイ」 (後発品) | FAMOTIDINE Powder [SAWAI] | 沢井製薬 | 2325003B1065 | 40.9円/g |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
○下記疾患の胃粘膜病変(びらん、出血、発赤、浮腫)の改善
急性胃炎、慢性胃炎の急性増悪期
6. 用法及び用量
<胃潰瘍、十二指腸潰瘍、吻合部潰瘍、上部消化管出血(消化性潰瘍、急性ストレス潰瘍、出血性胃炎による)、逆流性食道炎、Zollinger-Ellison症候群>
通常、成人にはファモチジンとして1回20mgを1日2回(朝食後、夕食後または就寝前)経口投与する。また、1回40mgを1日1回(就寝前)経口投与することもできる。
なお、年齢・症状により適宜増減する。ただし、上部消化管出血の場合には通常注射剤で治療を開始し、内服可能になった後は経口投与に切りかえる。
なお、年齢・症状により適宜増減する。ただし、上部消化管出血の場合には通常注射剤で治療を開始し、内服可能になった後は経口投与に切りかえる。
<下記疾患の胃粘膜病変(びらん、出血、発赤、浮腫)の改善
急性胃炎、慢性胃炎の急性増悪期>
急性胃炎、慢性胃炎の急性増悪期>
通常、成人にはファモチジンとして1回10mgを1日2回(朝食後、夕食後または就寝前)経口投与する。また、1回20mgを1日1回(就寝前)経口投与することもできる。
なお、年齢・症状により適宜増減する。
なお、年齢・症状により適宜増減する。
7. 用法及び用量に関連する注意
7.1 腎機能低下患者への投与法
8. 重要な基本的注意
血液像、肝機能、腎機能等に注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
症状が悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中に移行することが報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
本剤を減量するか投与間隔を延長するなど慎重に投与すること。本剤は主として腎臓から排泄されるが、高齢者では、腎機能が低下していることが多いため血中濃度が持続するおそれがある。
10. 相互作用
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(各0.1%未満)
ショック、アナフィラキシー(呼吸困難、全身潮紅、血管浮腫<顔面浮腫、咽頭浮腫等>、蕁麻疹等)があらわれることがある。
11.1.2 再生不良性貧血、汎血球減少、無顆粒球症、溶血性貧血(いずれも頻度不明)、血小板減少(0.1%未満)
再生不良性貧血、汎血球減少、無顆粒球症、溶血性貧血、血小板減少(初期症状として全身倦怠感、脱力、皮下・粘膜下出血、発熱等)があらわれることがあるので、定期的に血液検査を実施し、異常が認められた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.4 肝機能障害、黄疸(いずれも頻度不明)
AST・ALT等の上昇、黄疸があらわれることがある。
11.1.5 横紋筋融解症(頻度不明)
高カリウム血症、ミオグロビン尿、血清逸脱酵素の著明な上昇、筋肉痛等が認められた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.6 QT延長(頻度不明)
特に心疾患(心筋梗塞、弁膜症、心筋症等)を有する患者においてあらわれやすいので、投与後の患者の状態に十分注意すること。[9.1.1参照]
11.1.7 意識障害、痙攣(いずれも頻度不明)
意識障害、全身痙攣(痙直性、間代性、ミオクローヌス性)があらわれることがある。特に腎機能障害を有する患者においてあらわれやすいので、注意すること。[9.2参照]
11.1.8 間質性腎炎、急性腎障害(いずれも頻度不明)
初期症状として発熱、皮疹、腎機能検査値異常(BUN・クレアチニン上昇等)等が認められた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.9 間質性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常等を伴う間質性肺炎があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.10 不全収縮
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹・皮疹、蕁麻疹(紅斑)、顔面浮腫 | ||
| 血液 | 白血球減少 | 好酸球増多 | |
| 消化器 | 便秘 | 下痢・軟便、口渇、悪心・嘔吐、腹部膨満感、食欲不振、口内炎 | |
| 循環器 | 血圧上昇、顔面潮紅、耳鳴 | 徐脈、頻脈、房室ブロック | |
| 肝臓 | AST上昇、ALT上昇、Al-P上昇 | 総ビリルビン上昇、LDH上昇 | 肝機能異常、黄疸 |
| 精神神経系 | 全身倦怠感、無気力感、頭痛、眠気、不眠 | 可逆性の錯乱状態、うつ状態、痙攣、意識障害、めまい | |
| 内分泌系 | 月経不順、女性化乳房 | 乳汁漏出症 | |
| その他 | CK上昇、味覚異常、筋肉痛、背部痛 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
本剤の投与が胃癌による症状を隠蔽することがあるので、悪性でないことを確認のうえ投与すること。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
<ファモチジン錠10「サワイ」>
ファモチジン錠10「サワイ」とガスター錠10mgを健康成人男子にそれぞれ1錠(ファモチジンとして10mg)空腹時単回経口投与(クロスオーバー法)し、血漿中ファモチジン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された4)。
| Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | AUC0-12hr (ng・hr/mL) | |
| ファモチジン錠10「サワイ」 | 38.4±10.0 | 2.6±0.9 | 2.9±0.4 | 233.4±47.3 |
| ガスター錠10mg | 35.7±10.0 | 2.5±1.3 | 3.1±0.4 | 211.7±47.4 |
<ファモチジン錠20「サワイ」>
ファモチジン錠20「サワイ」とガスター錠20mgを健康成人男子にそれぞれ1錠(ファモチジンとして20mg)空腹時単回経口投与(クロスオーバー法)し、血漿中ファモチジン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された4)。
| Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | AUC0-12hr (ng・hr/mL) | |
| ファモチジン錠20「サワイ」 | 74.7±27.8 | 2.8±0.9 | 3.1±0.6 | 441.5±136.8 |
| ガスター錠20mg | 73.8±19.5 | 2.7±1.2 | 3.2±0.6 | 427.2±84.6 |
<ファモチジン細粒2%「サワイ」>
ファモチジン細粒2%「サワイ」とガスター散2%を健康成人男子にそれぞれ0.5g(ファモチジンとして10mg)空腹時単回経口投与(クロスオーバー法)し、血漿中ファモチジン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された5)。
| Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | AUC0-12hr (ng・hr/mL) | |
| ファモチジン細粒2%「サワイ」 | 39.9±9.8 | 2.3±1.0 | 2.9±0.4 | 238.3±52.9 |
| ガスター散2% | 37.4±12.5 | 2.3±1.0 | 2.9±0.5 | 209.3±58.9 |
<ファモチジン散10%「サワイ」>
ファモチジン散10%「サワイ」とガスター散10%を健康成人男子にそれぞれ0.2g(ファモチジンとして20mg)空腹時単回経口投与(クロスオーバー法)し、血漿中ファモチジン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された6)。
| Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | AUC0-24hr (ng・hr/mL) | |
| ファモチジン散10%「サワイ」 | 62.7±17.3 | 2.3±0.6 | 3.7±1.7 | 416.6±101.5 |
| ガスター散10% | 62.5±21.9 | 2.8±0.8 | 3.2±1.2 | 430.8±162.8 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
| 平均Ccr値 (mL/min/1.48m2) | t1/2β (h) | AUC (ng・h/mL) | Ctot (mL/min) | |
| 98.9 | n=7 | 2.59 | 857 | 412 |
| 73.8 | n=9 | 2.92 | 909 | 381 |
| 49.2 | n=5 | 4.72 | 1424 | 242 |
| 10.3 | n=10 | 12.07 | 4503 | 84 |
18. 薬効薬理
18.1 作用機序
胃粘膜壁細胞のH2受容体を遮断し、胃酸分泌を抑制することにより、胃・十二指腸潰瘍、胃炎等の治癒効果を示す7)。
18.2 ヒトでの作用
18.2.1 胃酸及びペプシン分泌抑制作用
(1)基礎及び各種刺激分泌
健康成人又は消化性潰瘍患者における、基礎及び各種刺激剤投与時の2時間胃酸及びペプシン分泌量は、20mg経口投与によりそれぞれ71.6〜99.6%、29.5〜96.9%抑制される。
(2)夜間分泌
健康成人又は消化性潰瘍患者の午後11時から午前6時までの7時間胃酸及びペプシン分泌量は、20mg経口投与によりそれぞれ91.8%、71.8%抑制される13)。
(3)24時間分泌・胃内pH
健康成人の胃酸分泌量は、20mg経口投与により、午後8時から12時間以上にわたり抑制される。胃内pHは、投与12時間後まで4.2〜6.0の範囲で推移する14)。
(4)血中濃度と胃酸分泌抑制作用
血中濃度と胃酸分泌抑制率との間には正の相関関係がみられ、胃酸分泌量を50%抑制するときの血中濃度は13ng/mLである15)。
18.2.2 胃粘膜血流量に及ぼす影響
0.1〜0.2mg/kgの静脈内投与では健康成人の胃粘膜血流量を増加させる傾向が認められる16)。
18.2.3 胃粘液分泌に及ぼす影響
潰瘍患者の胃液中粘液物質濃度に影響を及ぼさない17)。
18.2.4 胃内容排出能に及ぼす影響
胃潰瘍、十二指腸潰瘍患者に20mg経口投与した場合、胃排出能に影響を及ぼさない18)。
18.2.5 肝血行動態に及ぼす影響
20mg静脈内投与は、健康成人の肝血流量、門脈血流量に影響を及ぼさない19)。
18.2.6 血中ガストリン値に及ぼす影響
胃潰瘍、十二指腸潰瘍患者に20mg1日2回、1〜2カ月経口投与した場合、血中ガストリン値に影響を及ぼさない20)。
18.2.7 血中プロラクチン等に及ぼす影響
20mg静脈内投与、20mg1日2回4週間経口投与は、健康成人、消化性潰瘍患者の血中プロラクチン、性腺刺激ホルモン、性ホルモン値に影響を及ぼさない21)。
18.3 動物での作用
19. 有効成分に関する理化学的知見
19.1. ファモチジン
22. 包装
<ファモチジン錠10「サワイ」>
PTP
100錠(10錠×10)、1,000錠(10錠×100)
バラ
1,000錠
<ファモチジン錠20「サワイ」>
PTP
100錠(10錠×10)、1,000錠(10錠×100)
バラ
1,000錠
<ファモチジン細粒2%「サワイ」>
バラ[乾燥剤入り]
100g、500g
<ファモチジン散10%「サワイ」>
バラ[乾燥剤入り]
100g
23. 主要文献
- 猪爪信夫他, Prog. Med., 16 (11), 2897-2903, (1996)
- 二木芳人, Today's Therapy, 18 (2), 42-45, (1994)
- Lim, S. G. et al., Aliment. Pharmacol. Ther., 7, 317-321, (1993) »PubMed
- 中川路桂他, 医学と薬学, 48 (1), 59-65, (2002)
- 社内資料:生物学的同等性試験(細粒2%)
- 社内資料:生物学的同等性試験(散10%)
- 第十八改正日本薬局方解説書, C-4521-4524, (2021), (廣川書店)
- 大江慶治他, 内科宝函, 30 (11), 365-378, (1983)
- 大江慶治他, 内科宝函, 31 (1), 11-24, (1984)
- 渡部洋三他, 薬理と治療, 11 (9), 3637-3650, (1983)
- 三好秋馬他, 基礎と臨床, 17 (9), 2909-2916, (1983)
- 三好秋馬他, 基礎と臨床, 17 (9), 2917-2927, (1983)
- 大江慶治他, 内科宝函, 31 (2), 51-62, (1984)
- 池添逸夫他, 日本消化器病学会雑誌, 80 (Suppl.), 694, (1983)
- Miwa, M. et al., Int. J. Clin. Pharmacol. Ther. Toxicol., 22 (4), 214-217, (1984) »PubMed
- 宮本二郎他, 薬理と治療, 11 (9), 3651-3658, (1983)
- 森治樹, 日本臨床, 42 (1), 150-157, (1984) »PubMed
- 原沢茂他, 診療と新薬, 20 (9), 1859-1864, (1983)
- 大西久仁彦他, 薬理と治療, 11 (10), 4301-4304, (1983)
- 三好秋馬他, 新薬と臨床, 32 (9), 1383-1395, (1983)
- 早川滉他, 臨床成人病, 14 (4), 571-577, (1984)
- 竹田正明他, 基礎と臨床, 17 (9), 2878-2882, (1983)
- Takeda, M. et al., Eur. J. Pharmacol., 91 (4), 371-376, (1983) »PubMed
- Takagi, T. et al., Arch. Int. Pharmacodyn. Ther., 256 (1), 49-58, (1982) »PubMed
- 竹田正明他, 基礎と臨床, 18 (12), 6125-6134, (1984)
- Takeda, M. et al., Arzneimittel-Forschung, 32 (7), 734-737, (1982) »PubMed
- 岡部進他, 応用薬理, 27 (3), 563-569, (1984)
- Ishihara, Y. et al., Digestion, 27 (1), 29-35, (1983) »PubMed
- 宮田桂司他, 基礎と臨床, 21 (16), 6063-6073, (1987)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30