医薬品情報
| 総称名 | スピリーバ |
|---|---|
| 一般名 | チオトロピウム臭化物水和物 |
| 欧文一般名 | Tiotropium Bromide Hydrate Tiotropium Bromide |
| 製剤名 | チオトロピウム臭化物水和物製剤 |
| 薬効分類名 | 長時間作用性吸入気管支拡張剤 |
| 薬効分類番号 | 2259 |
| ATCコード | R03BB04 |
| KEGG DRUG |
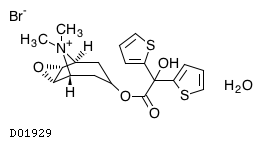
D01929
チオトロピウム臭化物水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年6月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| スピリーバ吸入用カプセル18μg | Spiriva Inhalation Capsules 18μg | 日本ベーリンガーインゲルハイム | 2259709G1027 | 99.6円/カプセル | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
本剤は慢性閉塞性肺疾患(慢性気管支炎、肺気腫)の維持療法に用いること。本剤は急性増悪の治療を目的として使用する薬剤ではない。
6. 用法及び用量
通常、成人には1回1カプセル(チオトロピウムとして18μg)を1日1回本剤専用の吸入用器具(ハンディヘラー)を用いて吸入する。
7. 用法及び用量に関連する注意
本剤は吸入用カプセルであり、必ず専用の吸入用器具(ハンディヘラー)を用いて吸入し、内服しないこと。[14.1.2参照]
8. 重要な基本的注意
8.1 用法及び用量どおり正しく使用しても効果が認められない場合には、本剤が適当ではないと考えられるので、漫然と投与を継続せず中止すること。
8.2 急性症状を緩和するためには、短時間作用性吸入β2刺激薬等の他の適切な薬剤を使用するよう患者に注意を与えること。
また、その薬剤の使用量が増加したり、あるいは効果が十分でなくなってきた場合には、疾患の管理が十分でないことが考えられるので、可及的速やかに医療機関を受診し医師の治療を求めるよう患者に注意を与えること。
また、その薬剤の使用量が増加したり、あるいは効果が十分でなくなってきた場合には、疾患の管理が十分でないことが考えられるので、可及的速やかに医療機関を受診し医師の治療を求めるよう患者に注意を与えること。
8.3 吸入薬の場合、薬剤の吸入により気管支痙攣が誘発される可能性があるので、異常が認められた場合には、投与を中止し、適切な処置を行うこと。
8.4 本剤の投与時に、本剤が眼に入らないように患者に注意を与えること。また、結膜の充血及び角膜浮腫に伴う赤色眼とともに眼痛、眼の不快感、霧視、視覚暈輪あるいは虹輪が発現した場合、急性閉塞隅角緑内障の徴候の可能性がある。これらの症状が発現した場合には、可及的速やかに医療機関を受診するように患者に注意を与えること。[2.1、11.1.3参照]
8.5 本剤は吸入製剤であり、消化管からの吸収率は低いため、内服しても期待する効果は得られない。したがって、内服しないよう患者に十分注意を与えること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心不全、心房細動、期外収縮の患者、又はそれらの既往歴のある患者
心不全、心房細動、期外収縮が発現することがある。[11.1.1参照]
9.1.2 前立腺肥大(排尿障害がある場合を除く)のある患者
排尿障害が発現するおそれがある。[2.2参照]
9.2 腎機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で胎児に移行することが認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
副作用の発現に注意すること。一般に腎クリアランス等の生理機能が低下しており、血中濃度が上昇するおそれがある。また、臨床試験で口渇は高齢者でより高い発現率が認められている。[16.6.2参照]
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 心不全(0.1%未満)、心房細動(0.2%)、期外収縮(0.1%未満)[9.1.1参照]
11.1.2 イレウス(頻度不明)
11.1.3 閉塞隅角緑内障(頻度不明)
11.1.4 アナフィラキシー(頻度不明)
アナフィラキシー(じん麻疹、血管浮腫、呼吸困難等)が発現することがある。
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 眼 | 霧視、眼圧上昇 | ||
| 皮膚 | 発疹、脱毛、そう痒 | じん麻疹 | |
| 中枢神経系 | 不眠、浮動性めまい | ||
| 感覚器 | 味覚倒錯、嗅覚錯誤 | ||
| 消化器 | 口渇(9.6%) | 便秘、消化不良、口内炎、舌炎 | |
| 代謝 | 高尿酸血症 | ||
| 循環器 | 頻脈、動悸 | 上室性頻脈 | |
| 血液 | 好酸球増多、白血球減少 | ||
| 呼吸器 | 呼吸困難、喘鳴、嗄声、鼻出血、咽頭炎、咳嗽 | 咽喉刺激感 | |
| 泌尿器 | 血尿、排尿障害、夜間頻尿、クレアチニン上昇、腎機能異常、尿閉 | ||
| 一般的全身障害 | 過敏症(血管浮腫を含む) |
13. 過量投与
13.1 症状
本剤を高用量投与した場合、抗コリン作動性の徴候及び症状が発現する可能性がある。しかし、健康成人(海外)に本剤282μgを単回吸入投与したとき、全身性の抗コリン作用による副作用は認められなかった。
また、海外の市販後において、過量投与例が報告されている。女性患者が2.5日間に30カプセル(540μg)を吸入したもので、精神状態の変化、振戦、腹痛及び重度の便秘が発現した。この患者は入院し、本剤の投与は中止された。便秘には浣腸処置が施された。患者は回復し、その日のうちに退院した。
なお、本剤の経口投与後の生物学的利用率は低いので、経口摂取による急性中毒の発現の可能性は低いと考えられる。
また、海外の市販後において、過量投与例が報告されている。女性患者が2.5日間に30カプセル(540μg)を吸入したもので、精神状態の変化、振戦、腹痛及び重度の便秘が発現した。この患者は入院し、本剤の投与は中止された。便秘には浣腸処置が施された。患者は回復し、その日のうちに退院した。
なお、本剤の経口投与後の生物学的利用率は低いので、経口摂取による急性中毒の発現の可能性は低いと考えられる。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 吸入前
(1)本剤を患者に交付する際には、正しい使用方法を必ず交付前に説明すること。
(2)患者には専用の吸入用器具(ハンディヘラー)及び使用説明書を渡し、使用方法を指導すること。
(3)1ブリスター(7カプセル)は2列で構成されており、列の間にミシン目が入っている。ミシン目以外の場所で切り離さないこと。
(4)カプセルを取り出す際は、ブリスターをミシン目にそって切り離し、吸入の直前に1カプセルだけブリスターから取り出すように指導すること。誤ってアルミシートを次のカプセルまではがしたときは、そのカプセルは廃棄するように指導すること(吸湿により吸入量の低下が起こる可能性がある)。また、カプセルを使い始めたブリスターは、残りのカプセルを続けて使い切るように指導すること。
(5)本剤のカプセル内容物は少量であり、カプセル全体に充填されていない。
14.1.2 吸入時
本剤は必ず専用の吸入用器具(ハンディヘラー)を用いて吸入させること。内服しても効果はみられない。[7.参照]
15. その他の注意
15.1 臨床使用に基づく情報
本剤と短時間作用型抗コリン性気管支拡張剤(イプラトロピウム臭化物水和物、オキシトロピウム臭化物等)との併用に関しては、臨床試験成績はなく、併用による有効性及び安全性は確立していないことから、併用は推奨できない。
16. 薬物動態
16.1 血中濃度
慢性閉塞性肺疾患患者(海外)にチオトロピウム18μgを1日1回反復吸入投与したとき、定常状態における最高血漿中濃度(Cmax)は17〜19pg/mLであり、最小血漿中濃度(Cmin)は3〜4pg/mLであった1)(外国人データ)。
16.2 吸収
健康成人にチオトロピウム108μg注)を吸入投与したときの生物学的利用率は19.5%であった2)。また、健康成人にチオトロピウム64μgを経口投与注)したときの生物学的利用率は2〜3%であり、消化管からほとんど吸収されなかった2)。
注)本剤の承認された用法及び用量は、チオトロピウムとして1日1回18μg吸入投与である。
16.3 分布
ヒト血漿蛋白との結合率(in vitro試験)は72%であった3)。
分布容積は32L/kgであった2)(外国人データ)。
14C-チオトロピウム10mg/kgを気管内投与注)した場合、肺、消化管の他に肝臓、腎臓、膵臓に高い放射能濃度が認められたが、脳には移行しなかった(ラット4))。また、乳汁中に移行した(ラット5))。
注)本剤の承認された用法及び用量は、チオトロピウムとして1日1回18μg吸入投与である。
16.4 代謝
健康成人にチオトロピウム14.4μgを静脈内投与注)したとき、尿中にみられたチオトロピウムの代謝物はわずかであった1)。主要代謝物として、血漿中において非酵素的にエステル結合が加水分解され、N-メチルスコピン及びジチニールグリコール酸の生成がみられた6)(外国人データ)。これらの代謝物はムスカリン受容体に親和性を示さなかった7)。また、ヒト肝ミクロソーム及びヒト肝細胞を用いた試験でチトクロームP-450によって酸化された代謝物及びそのグルタチオン抱合体がわずかにみられた8)9)。この代謝はCYP2D6及び3A4の阻害薬により抑制されたことから、チオトロピウムの消失のごく一部にCYP2D6及び3A4が関与していると考えられた8)。チオトロピウムは治療濃度以上であっても、CYP1A1、1A2、2B6、2C9、2C19、2D6、2E1及び3Aのいずれの活性に対しても影響を与えなかった10)(外国人データ)。
注)本剤の承認された用法及び用量は、チオトロピウムとして1日1回18μg吸入投与である。
16.5 排泄
吸入投与後の終末相における尿中未変化体排泄速度から算出した消失半減期は5〜6日であった2)11)(外国人データ)。血漿中濃度は投与開始後2〜3週間で定常状態に達し、その後の蓄積性はみられなかった1)11)(外国人データ)。
健康成人にチオトロピウム14.4μgを静脈内投与注)したとき、全身クリアランスは880mL/minであった。また、尿中未変化体排泄率は74%であった2)(外国人データ)。[9.2.1、16.6.1参照]
健康成人にチオトロピウム14.4μgを静脈内投与注)したとき、全身クリアランスは880mL/minであった。また、尿中未変化体排泄率は74%であった2)(外国人データ)。[9.2.1、16.6.1参照]
注)本剤の承認された用法及び用量は、チオトロピウムとして1日1回18μg吸入投与である。
16.6 特定の背景を有する患者
16.6.1 腎機能低下患者
他の腎排泄型の薬剤と同様、腎機能低下患者においては、チオトロピウムの静脈内投与注)12)及び吸入投与1)後の血漿中未変化体濃度は上昇し、腎クリアランスは低下した。軽度の腎機能低下患者(クレアチニンクリアランスが50〜80mL/minの患者)において、チオトロピウム4.8μgを静脈内投与注)後のAUC0-4hは健康成人に比較して39%高い値を示した12)。また、高度あるいは中等度の腎機能低下患者(クレアチニンクリアランスが50mL/min未満の患者)においては血漿中未変化体濃度は約2倍高い値を示した(AUC0-4hは82%高かった)12)。
健康成人及び腎機能低下患者における薬物動態パラメータは以下のとおりであった12)(外国人データ)。[9.2.1、16.5参照]
健康成人及び腎機能低下患者における薬物動態パラメータは以下のとおりであった12)(外国人データ)。[9.2.1、16.5参照]
| 例数 | クレアチニンクリアランス(mL/min) | Cmax(pg/mL) | AUC0-4h(pg・hr/mL) | 総尿中未変化体排泄率(% of dose) | 腎クリアランス(mL/min) | |
| 健康成人 | 6 | >80 | 147 (103〜186) | 55.5 (43.2〜69.4) | 60.1 (44.8〜76.5) | 435 (348〜497) |
| 腎機能低下患者 | 5 | 50〜80 | 200 (129〜287) | 77.1 (60.9〜105) | 59.3 (49.7〜74.0) | 246 (150〜341) |
| 7 | 30〜50 | 223 (162〜314) | 101 (69.4〜156) | 39.9 (25.9〜65.3) | 124 (98.3〜171) | |
| 6 | <30 | 223 (176〜269) | 108 (76.3〜145) | 37.4 (34.2〜41.7) | 85.7 (68.4〜128) |
注)本剤の承認された用法及び用量は、チオトロピウムとして1日1回18μg吸入投与である。
16.6.2 高齢者
高齢者では、チオトロピウム18μgを吸入投与後の腎クリアランスは低下した(腎クリアランスは58歳以下の慢性閉塞性肺疾患患者で326mL/min、69歳以上の慢性閉塞性肺疾患患者で163mL/min)が、これは加齢に伴う腎機能の低下によるものと考えられた。11)若年健康成人(平均年齢32.1歳)にチオトロピウム108μgを吸入投与注)したときの尿中未変化体排泄率は14%であったが2)、慢性閉塞性肺疾患患者(平均年齢63.8歳)にチオトロピウム18μgを吸入投与したときの尿中未変化体排泄率は7%であり1)、若年健康成人に比較して低い値であった。一方、高齢者にチオトロピウム18μgを1日1回反復吸入投与後のAUC0-4hは非高齢者に比較して43%高い値を示した。非高齢者及び高齢者における薬物動態パラメータは以下のとおりであり11)、個体間変動を考慮すると、血漿中未変化体濃度に加齢による大きな差はないと考えられた11)(外国人データ)。[9.8参照]
| 例数 | 投与後5分の血漿中未変化体濃度(pg/mL) | AUC0-4h(pg・hr/mL) | 投与後4時間までの尿中未変化体排泄率(% of dose) | 腎クリアランス(mL/min) | |
| 非高齢者(45〜58歳) | 12 | 9.63 (2.50〜47.5) | 18.2 (10.0〜61.7) | 1.97 (0.45〜5.67) | 326 (117〜724) |
| 高齢者(69〜80歳) | 13 | 15.3 (5.60〜34.8) | 26.1 (10.5〜56.0) | 1.42 (0.215〜4.51) | 163 (20.5〜477) |
注)本剤の承認された用法及び用量は、チオトロピウムとして1日1回18μg吸入投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
(1)肺機能検査値に対する成績
慢性閉塞性肺疾患患者27例を対象とした単回投与試験において、本剤は投与後速やかに肺機能検査値(FEV1)を上昇させ、その効果は投与後24時間持続した13)。
(2)安全性
27例中、副作用が報告された症例はなかった。
17.1.2 国内第III相試験
慢性閉塞性肺疾患患者201例(本剤1日1回18μg吸入群67例)を対象とした国内第III相二重盲検比較試験(4週投与)14)の結果、本剤の有用性が認められた。
(1)肺機能検査値に対する成績
本剤はオキシトロピウム臭化物に比し、肺機能検査値(トラフFEV1)を有意に上昇させた14)。
| 薬剤 | 症例数 | FEV1 投与前値(L) | トラフFEV1 変化量(L) | P値 (分散分析) |
| チオトロピウム | 63 | 0.99±0.04 | 0.12±0.02 | P=0.0001 |
| オキシトロピウム | 67 | 0.97±0.05 | 0.02±0.02 |
(2)呼吸困難に対する成績
本剤はオキシトロピウム臭化物に比し、呼吸困難(息切れの程度を点数化して評価)を有意に改善した14)。
(3)安全性
副作用は本剤1日1回18μg吸入群67例中5例(7.5%)で報告され、口渇、高尿酸血症、呼吸困難、喘鳴、発疹、嗅覚錯誤、血尿、夜間頻尿、NPN上昇、好酸球増多が各1例(1.5%)であった。
17.1.3 国内第III相試験(長期投与試験)
慢性閉塞性肺疾患患者161例(本剤1日1回18μg吸入群110例)を対象とした国内第III相長期投与試験(1年投与)15)の結果、本剤の有用性が認められた。
(1)肺機能検査値に対する成績
本剤はオキシトロピウム臭化物に比し、肺機能検査値(トラフFEV1)を有意に上昇させた15)。
| 薬剤 | 症例数 | FEV1 投与前値(L) | トラフFEV1 変化量(L) | P値 (分散分析) |
| チオトロピウム | 100 | 0.96±0.04 | 0.09±0.02 | P=0.0005 |
| オキシトロピウム | 46 | 0.94±0.05 | −0.02±0.03 |
(2)呼吸困難に対する成績
本剤はオキシトロピウム臭化物に比し、呼吸困難(息切れの程度を点数化して評価)を有意に改善した15)。
(3)急性増悪に対する成績
(4)生活の質(QOL)に関する成績
St.George's Respiratory QuestionnaireによるQOLに関する調査において、本剤はオキシトロピウム臭化物に比し、QOLを有意に改善した15)。
(5)安全性
本剤1日1回18μg吸入群110例中、副作用が報告された症例は30例(27.3%)であった。主な副作用は、口渇17例(15.5%)、アレルギー反応3例(2.7%)、便秘、消化不良、心房細動が各2例(1.8%)であった。
17.1.4 海外第III相試験(プラセボ対照1年投与)
慢性閉塞性肺疾患患者921例(本剤1日1回18μg吸入投与550例)を対象とした1年投与プラセボ対照二重盲検比較試験16)により、肺機能検査値、呼吸困難、急性増悪及び生活の質(QOL)について検討した。
(1)肺機能検査値に対する成績
本剤はプラセボに比し、肺機能検査値(トラフFEV1)を有意に改善した16)。
| 試験 | 薬剤 | 症例数 | FEV1 投与前値(L) | トラフFEV1 変化量(L) | P値 (分散分析) |
| プラセボ対照二重盲検比較試験 (1年投与) | チオトロピウム | 518 | 1.01±0.02 | 0.11±0.01 | P=0.0001 |
| プラセボ | 328 | 0.99±0.02 | −0.04±0.01 |
(2)呼吸困難に対する成績
本剤はプラセボに比し、呼吸困難(MahlerらのBaseline Dyspnea IndexとTransitional Dyspnea Indexを用いて評価)を有意に改善した16)。
(3)急性増悪に対する成績
本剤はプラセボに比し、急性増悪の回数を有意に減少し、最初の急性増悪が発現するまでの期間を有意に遅延させた16)。
(4)生活の質(QOL)に関する成績
St.George's Respiratory QuestionnaireによるQOLに関する調査において、本剤はプラセボに比し、QOLを有意に改善した16)。
(5)安全性
本剤1日1回18μg吸入群550例中、副作用が報告された症例は98例(17.8%)であった。主な副作用は、口渇71例(12.9%)、嗄声8例(1.5%)、めまい6例(1.1%)であった16)。
17.1.5 海外第III相試験(イプラトロピウム対照1年投与)
慢性閉塞性肺疾患患者535例(本剤1日1回18μg吸入投与356例)を対象とした1年投与によるイプラトロピウム臭化物水和物対照二重盲検比較試験17)により、肺機能検査値、呼吸困難、急性増悪及び生活の質(QOL)について検討した。
(1)肺機能検査値に対する成績
(2)呼吸困難に対する成績
本剤はイプラトロピウム臭化物水和物に比し、呼吸困難(MahlerらのBaseline Dyspnea IndexとTransitional Dyspnea Indexを用いて評価)を有意に改善した17)。
(3)急性増悪に対する成績
本剤はイプラトロピウム臭化物水和物に比し、急性増悪の回数を有意に減少し、最初の急性増悪が発現するまでの期間を有意に遅延させた17)。
(4)生活の質(QOL)に関する成績
St.George's Respiratory QuestionnaireによるQOLに関する調査において、本剤はイプラトロピウム臭化物水和物に比し、QOLを有意に改善した17)。
(5)安全性
本剤1日1回18μg吸入群356例中、副作用が報告された症例は66例(18.5%)であった。主な副作用は、口渇32例(9.0%)、頭痛5例(1.4%)、咽頭炎、咳各4例(1.1%)であった17)。
17.1.6 海外第III相試験(6ヵ月投与)
慢性閉塞性肺疾患患者1,207例(本剤1日1回18μg吸入投与402例)を対象とした6ヵ月投与によるサルメテロールキシナホ酸塩対照二重盲検比較試験18)19)20)により、肺機能検査値、呼吸困難、急性増悪及び生活の質(QOL)について検討した。
(1)肺機能検査値に対する成績
本剤はサルメテロールキシナホ酸塩と比較した場合、6ヵ月間の投与期間を通じトラフFEV1の改善がみられ、6ヵ月目で有意であった18)。投与後のFEV1の反応についても、本剤はサルメテロールキシナホ酸塩に比し有意に高い改善を示した18)。
| 試験 | 薬剤 | 症例数 | FEV1 投与前値(L) | トラフFEV1 変化量(L) | P値 (分散分析) |
| サルメテロール対照二重盲検比較試験 (6ヵ月投与) | プラセボ | 362 | 1.08±0.02 | −0.03±0.01 | P=0.0001 |
| チオトロピウム | 386 | 1.11±0.02 | 0.09±0.01 | ||
| P=0.0125 | |||||
| サルメテロール | 388 | 1.07±0.02 | 0.05±0.01 |
(2)呼吸困難に対する成績
本剤はサルメテロールキシナホ酸塩と比較して同程度の改善を示した18)。
(3)急性増悪に対する成績
本剤はサルメテロールキシナホ酸塩と比較しても急性増悪の回数や入院回数は少なかったが、有意差はなかった18)。
(4)生活の質(QOL)に関する成績
(5)安全性
本剤1日1回18μg吸入群402例中、副作用が報告された症例は44例(10.9%)であり、主な副作用は、口渇26例(6.5%)、頭痛5例(1.2%)、咳、呼吸困難が各4例(1.0%)であった18)。
17.1.7 海外第III相試験(朝投与と夜投与の肺機能に及ぼす影響)
慢性閉塞性肺疾患患者121例(本剤1日1回18μg吸入朝投与38例、夜投与43例)を対象とした6週投与二重盲検比較試験により、肺機能検査値について検討した。
(1)肺機能検査値に対する成績
本剤は本剤の朝投与と夜投与に差はみられず、いずれもプラセボに比べ、肺機能検査値(FEV1)を有意に改善した21)。
(2)安全性
本剤1日1回18μg吸入群81例(朝投与38例、夜投与43例)中、副作用が報告された症例は8例(9.9%)であった。主な副作用は、口渇4例(4.9%)、咳2例(2.5%)であった。
18. 薬効薬理
18.1 作用機序
チオトロピウムは長時間持続型の選択的ムスカリン受容体拮抗薬であり、気道においては、気道平滑筋のM3受容体に対するアセチルコリンの結合を阻害して気管支収縮抑制作用を発現する。
18.2 ムスカリン受容体に対する作用
18.3 気管支収縮抑制作用
18.4 作用持続時間
19. 有効成分に関する理化学的知見
19.1. チオトロピウム臭化物水和物
20. 取扱い上の注意
本剤は温度25度を超えるところに保存しないこと。冷凍しないこと。
22. 包装
14カプセル(7カプセル×2、ハンディヘラー1個)
28カプセル(7カプセル×4)
28カプセル(7カプセル×4、ハンディヘラー1個)
23. 主要文献
- 社内資料:海外1年間投与二重盲検比較試験(205.117試験)(2004年10月22日承認、申請資料概要ト 9.1.1)
- 社内資料:健康成人でのバイオアベイラビリティ試験(2004年10月22日承認、申請資料概要へ 3.1.2)
- 社内資料:薬物動態試験(分布:血漿蛋白結合)(2004年10月22日承認、申請資料概要ヘ 2.2.5)
- 社内資料:非臨床薬物動態試験(分布:全身オートラジオグラフィ)(2004年10月22日承認、申請資料概要ヘ 2.2.1)
- 社内資料:非臨床薬物動態試験(排泄:乳汁中移行)(2004年10月22日承認、申請資料概要ヘ 2.4.3)
- 社内資料:非臨床薬物動態試験(代謝:血漿中加水分解)(2004年10月22日承認、申請資料概要ヘ 2.3.2)
- 社内資料:薬効薬理試験(ヒト ムスカリン受容体への親和性)(2004年10月22日承認、申請資料概要ホ 1.5.7)
- 社内資料:薬物動態試験(代謝:肝ミクロソーム)(2004年10月22日承認、申請資料概要ヘ 2.3.2)
- 社内資料:薬物動態試験(代謝:肝細胞)(2004年10月22日承認、申請資料概要ヘ 2.3.2)
- 社内資料:薬物動態試験(代謝:チトクロームP450阻害)(2004年10月22日承認、申請資料概要ヘ 3.8.1)
- 社内資料:高齢者における薬物動態試験(2004年10月22日承認、申請資料概要ヘ 3.5)
- Tuerck D et al, J Clin Pharmacol., 44, 163-172, (2004)
- 平田一人ほか, 臨床医薬, 20 (9), 25-39, (2004)
- 福地義之助ほか, 臨床医薬, 20 (9), 41-60, (2004)
- 福地義之助ほか, 臨床医薬, 20 (9), 61-75, (2004)
- Casaburi R et al, Eur Respir J., 19, 217-24, (2002)
- Vincken W et al, Eur Respir J., 19, 209-16, (2002)
- Brusasco V et al, Thorax., 58, 399-404, (2003)
- 社内資料:海外サルメテロール対照二重盲検比較試験(205.130試験)(2004年10月22日承認、申請資料概要ト 12.1)
- 社内資料:海外サルメテロール対照二重盲検比較試験(205.137試験)(2004年10月22日承認、申請資料概要ト 12.1)
- Calverley P M A et al, Thorax., 58, 855-60, (2003)
- Takahashi T et al, Am J Respir Crit Care Med., 150 (6), 1640-5, (1994)
- 社内資料:薬効薬理試験(ヒト ムスカリン受容体サブタイプからの解離)(2004年10月22日承認、申請資料概要ホ 1.5.2)
- 社内資料:薬効薬理試験(抗コリン作用(モルモット))(2004年10月22日承認、申請資料概要ホ 1.1.4)
- 社内資料:薬効薬理試験(抗コリン作用(ウサギ、イヌ)など)(2004年10月22日承認、申請資料概要ホ 1.1.3)
- 大村剛史ほか, 医学と薬学, 51 (5), 711-6, (2004)
24. 文献請求先及び問い合わせ先
文献請求先
日本ベーリンガーインゲルハイム株式会社
DIセンター
〒141-6017
東京都品川区大崎2丁目1番1号 ThinkPark Tower
電話:0120-189-779 (受付時間)9:00〜18:00 (土・日・祝日・弊社休業日を除く)
製品情報問い合わせ先
日本ベーリンガーインゲルハイム株式会社
DIセンター
〒141-6017
東京都品川区大崎2丁目1番1号 ThinkPark Tower
電話:0120-189-779 (受付時間)9:00〜18:00 (土・日・祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
日本ベーリンガーインゲルハイム株式会社
東京都品川区大崎2丁目1番1号