医薬品情報
| 総称名 | ジオン |
|---|---|
| 一般名 | 硫酸アルミニウムカリウム水和物 タンニン酸 |
| 欧文一般名 | Aluminum Potassium Sulfate Hydrate Tannic Acid |
| 製剤名 | 硫酸アルミニウムカリウム水和物・タンニン酸注射液 |
| 薬効分類名 | 内痔核硬化療法剤 |
| 薬効分類番号 | 2559 |
| KEGG DRUG |
D04684
硫酸アルミニウムカリウム水和物・タンニン酸
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年3月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ジオン注無痛化剤付 | ZIONE INJECTION/LIDOCAINE | ジェイドルフ製薬 | 2559500A1023 | 4519円/瓶 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
脱出を伴う内痔核
6. 用法及び用量
本剤の投与に先立ち、局所麻酔により肛門括約筋を弛緩させる。
用時、ジオン注無痛化剤付1バイアル(10mL)に添付の希釈液10mLを加えて20mLとし、硫酸アルミニウムカリウム水和物として2%溶液に調製する。
通常、成人には、1つの主痔核あたり2%溶液として9〜13mLを分割して粘膜下に投与する。
なお、投与量は患者の病態により適宜増減することとし、1回の治療あたりの総投与量は2%溶液として60mL以内とする。
7. 用法及び用量に関連する注意
7.1 本剤の投与に先立ち、痔核を十分に観察するための前処置として、肛門周囲への局所麻酔を施行し、肛門括約筋を弛緩させること。
7.2 本剤は痔核を十分に露出させて観察するための前処置として、局所麻酔の施行を選択する場合に使用すること。前処置として腰椎麻酔あるいは仙骨硬膜外麻酔を選択する場合には、ジオン注生食液付を使用すること。
7.3 輸液点滴を行い、静脈路を確保するとともに利尿を図ること。
7.4 本剤は、硫酸アルミニウムカリウム水和物として4%溶液のまま使用せず、用時、添付の希釈液を用いて、必ず2%溶液に調製後、使用すること。
7.5 主痔核に投与する際には、以下の標準的投与量を参考に、投与手技に注意しながら投与すること。[8.4参照]
7.5.1 標準的投与量
痔核上極部の粘膜下層
3mL
痔核中央部の粘膜下層
2〜4mL
痔核中央部の粘膜固有層
1〜2mL
痔核下極部の粘膜下層
3〜4mL
7.5.2 投与手技(四段階注射法)
(1)痔核上極部の粘膜下層への投与
痔核上極部の上直腸動脈の拍動部(時として拍動が触れないことがある)に注射針を刺入し、粘膜下層深部に2mLを投与する。その後、針先を手元に引きながら1mLを投与する。
投与後は、粘膜表面がやや白っぽくなる。
投与後は、粘膜表面がやや白っぽくなる。
(2)痔核中央部の粘膜下層への投与
主痔核の中央部に注射針を刺入し、粘膜下層深部に痔核体積に1mLを加えた量を標準として投与する。
(3)痔核中央部の粘膜固有層への投与
「(2)痔核中央部の粘膜下層への投与」後、針先を少し手元に引いて粘膜固有層へ1〜2mLを投与する。
投与量が適当であれば粘膜の表面がやや隆起する。
投与量が適当であれば粘膜の表面がやや隆起する。
(4)痔核下極部の粘膜下層への投与
痔核の下極部(歯状線の上0.1〜0.2cmの部位)へ注射針を刺入し、粘膜下層深部に2〜3mL投与する。その後、針先を手元に引きながら1mLを投与する。
7.6 主痔核の体積が1cm3以下の場合、及び副痔核に投与する場合には、痔核上極部及び痔核下極部への投与は行わないこと。
7.7 筋層内には投与しないこと。誤って筋層内に刺入した場合には、針先を一度戻し、改めて刺入してから投与すること。
7.9 歯状線より下方への投与や、薬液が歯状線下に浸潤することにより、嵌頓痔核や肛門部疼痛があらわれるおそれがあるので注意すること。[8.4.4参照]
8. 重要な基本的注意
8.1 本剤の投与は、痔疾治療に精通し、本剤を用いた手技を理解した医師が四段階注射法を遵守して行うこと。
8.2 本剤は組織傷害性があることから、適切な場所に適量投与されなかった場合や原液を投与した場合、直腸筋層壊死、直腸狭窄等が発生する可能性があるので十分に注意すること。
8.3 本剤の投与中あるいは投与後に過度の血圧低下、徐脈があらわれることがあるので、本剤の投与に際しては、常時、血圧及び心拍数を観察し、直ちに適切な救急処置のとれる準備をしておくとともに、予め静脈路の確保を行うこと。[11.1.1参照]
8.4 本剤の投与手技上、以下の事象が発生する可能性があるので十分に注意すること。[7.5参照]
8.4.1 前立腺炎、副睾丸炎、睾丸炎、血精液症
男性の前側の痔核に注射する際、直腸壁全層を注射針が穿通し、前立腺・精嚢とその近傍に刺入・注射した場合に発生する。このような場合には、観察を十分に行い、導尿、抗生物質の投与等の適切な処置を行うこと。[7.8参照]
8.4.2 直腸腟瘻
8.4.3 痔核壊死
痔核中央部への投与において、投与部位が浅い場合、又は投与量が多く投与部位を十分にマッサージせず薬液が均一に分散しなかった場合に発生する。このような場合には、観察を十分に行い、抗生物質を投与するなど適切な処置を行うこと。痔核全体が壊死した場合、手術等の適切な処置を行うこと。[7.10参照]
8.4.4 嵌頓痔核、肛門部疼痛
歯状線及び肛門管皮下に投与した場合、又は肛門管皮下に薬液が浸潤した場合に発生する。このような場合には、坐浴や消炎鎮痛剤の投与等の適切な処置を行うこと。また、嵌頓痔核が回復しない場合には手術等の適切な処置を行うこと。[7.9参照]
8.4.5 硬結
投与量の過多、又は投与後に十分にマッサージせず痔核の一部に薬液が集中した場合に発生する。なお、痔核中央部の粘膜固有層への投与量が多く、粘膜下層への投与量が少なかった場合にも発生する。通常は自然に吸収され、肛門機能に影響を残さないが、硬結が著しく排便障害等が認められる場合には、観察を十分に行い、手術等の適切な処置を行うこと。[7.10参照]
8.4.6 直腸筋層壊死
針先が直腸の筋層まで達し、投与量が多い場合に発生する。このような場合には、観察を十分に行い、消炎鎮痛剤及び抗生物質の投与等の適切な処置を行うこと。
8.4.7 直腸狭窄
8.5 本剤投与後、少なくとも前処置の麻酔の影響がなくなるまで、医師の監督下で患者の全身状態の観察を十分に行うこと。
8.6 本剤投与2週間後までに一過性の発熱があらわれることがあるので、このような場合には、観察を十分に行い、解熱鎮痛剤を投与するなど適切な処置を行うこと。
8.7 本剤による治療後に重篤な直腸潰瘍や直腸狭窄等が発生する可能性があるので、治療後は定期的に経過観察を行うこと。また、投与に際しては、患者に対して本剤の副作用等について十分な説明を行うとともに、出血、肛門痛等の異常が認められた場合には速やかに主治医に連絡するように注意を与えること。[9.1.3、11.1.3、11.1.4参照]
8.8 添付の希釈液は、塩酸リドカインとして0.5%含有する。リドカインはショックあるいは中毒症状を起こすことがあるので、投与に際しては、十分な問診により患者の全身状態を把握するとともに、異常が認められた場合には、直ちに救急処置のとれるように、常時準備しておくこと。
8.9 塩酸リドカインの基準最高用量は、通常、成人1回200mg(0.5%の場合、40mL)であることに注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 全身状態が不良の患者
希釈液にリドカインが含まれており、生理機能の低下により麻酔に対する忍容性が低下していることがある。
9.1.2 心刺激伝導障害のある患者
希釈液に含まれるリドカインが症状を悪化させるおそれがある。
9.1.3 前立腺等の骨盤内癌に放射線治療歴のある患者
9.2 腎機能障害患者
9.2.1 透析療法を受けている患者
投与しないこと。本剤の有効成分である硫酸アルミニウムカリウム水和物に由来するアルミニウムは、主に腎臓から排泄されるため、アルミニウムの排泄が極端に遅延するおそれがある。[2.3参照]
9.2.2 腎機能障害のある患者(透析療法を受けている患者を除く)
尿量が十分に確保できることを確認してから投与すること。アルミニウムの排泄が遅延するおそれがある。また、重篤な腎機能障害のある患者では、希釈液に含まれるリドカインの中毒症状が発現しやすくなるおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
希釈液に含まれるリドカインの中毒症状が発現しやすくなるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(ラット)で胎児へのアルミニウムの移行が認められている。[2.1参照]
9.6 授乳婦
投与しないこと。動物実験(ラット)で乳汁中へのアルミニウムの移行が認められている。[2.2参照]
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
尿量が十分に確保されていることに注意すること。一般に腎機能が低下していることが多い。また、希釈液にリドカインが含まれており、生理機能の低下により麻酔に対する忍容性が低下していることがある。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 血圧低下、徐脈(いずれも頻度不明)[8.3参照]
11.1.2 アナフィラキシー(頻度不明)
血圧低下、呼吸困難、顔面浮腫、紅潮等が症状としてあらわれることがあり、アナフィラキシーショックに至った例も報告されている。
11.1.3 直腸潰瘍(頻度不明)
11.1.4 直腸狭窄(頻度不明)
11.1.5 直腸腟瘻(頻度不明)
本剤投与後は定期的に観察を行い、瘻孔が認められた場合には、手術等の適切な処置を行うこと。[8.4.2参照]
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 血液 | リンパ球減少、好中球増加、白血球数上昇 | 好酸球増加、APTT延長 | 単球増加、赤血球数低下、ヘモグロビン減少、プロトロンビン時間延長 | |
| 皮膚・粘膜 | 蕁麻疹 | |||
| 腎・泌尿器 | 尿中β2マイクログロブリン上昇 | 尿酸上昇、尿糖陽性化、尿潜血陽性化、尿中NAG上昇 | 頻尿、血尿、多尿、BUN上昇・減少、尿蛋白陽性化、尿ウロビリノゲン上昇、血清カリウム上昇 | 尿閉 |
| 循環器 | 徐脈、血圧低下 | |||
| 消化器 | 下痢、食欲不振、嘔気 | 不快感、胃潰瘍 | 下腹部痛、嘔吐 | |
| 肝臓 | 総ビリルビン上昇、AST上昇、ALT上昇、ALP上昇、γ-GTP上昇 | アルブミン低下、A/G比低下、トリグリセライド上昇、LDH上昇 | ||
| 精神神経系 | 頭痛 | |||
| その他 | 発熱、CRP上昇(12%) | 全身倦怠(感)、血栓形成性痔核 | 肛門不快感、頚肩痛、熱感 | 肛門周囲膿瘍、直腸周囲膿瘍、直腸炎、肛門浮腫、肛門周囲炎、肛門縁腫脹、肛門出血 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 添付の希釈液は、本剤の希釈以外の用途に使用しないこと。
14.1.2 本剤は添付の希釈液で調製後、速やかに使用すること。
14.1.3 細菌の汚染を避けるため、調製は投与直前に行い、使用後の残液は再使用しないこと。
14.1.4 バイアルの液目盛り線は、薬液調製後の液面のおよその目安として使用すること。
14.1.5 薬液の調製方法
本剤のバイアルのキャップを外し、ゴム栓表面をアルコール綿で清拭する。次いで、添付の希釈液10mLを注射筒に採り、ゴム栓の中心部に注射針を垂直に刺入してバイアル内に注入する。注入後、バイアルを軽く振盪し、均一に混和していることを確認した上で使用すること。
14.2 薬剤投与時の注意
14.2.1 注射針刺入時、血液の逆流のないことを確かめること。
14.2.2 粘膜下へ刺入した際の筋層抵抗をつかみやすいよう、細くて弾力のある注射針(長さ4cm程度、太さ25G程度)を使用することが望ましい。
16. 薬物動態
16.1 血中濃度
本剤を、局所麻酔剤を用いて硫酸アルミニウムカリウム水和物として2%溶液に調製し、内痔核患者に投与したときの血清中アルミニウムの薬物動態パラメータは以下のとおりである1)2)。
| 被験者a) | 投与液量b)(mL) | 投与量c)(mg/kg) | tmax(h) | Cmax(μg/mL) | t1/2(24-168h)(h) | AUC0-24h(μg・h/mL) | AUC0-∞(μg・h/mL) |
| 非高齢者d) | 33.5(27〜42) | 10.7(8.4〜13.7) | 0.71±0.37 | 1.80±0.51 | 49.7±9.9f) | 13.8±3.7 | 30.1±5.1f) |
| 高齢者e) | 37.8(34〜41) | 13.1(10.4〜16.3) | 0.25±0.00 | 2.09±0.33 | 48.8±5.1 | 16.0±2.6 | 33.7±5.9 |
本剤の2%溶液を内痔核患者に投与した際の血清中アルミニウム濃度推移
[平均値±標準偏差,非高齢者の投与終了後168時間はn=14]
16.2 吸収
本剤を痔核内に投与後、アルミニウムは血中に移行し、血清中濃度が一過性に上昇しその後減少するが、タンニン酸はほとんど血中に移行しないと考えられる。
16.3 分布
16.3.1 蛋白結合率
ヒト血清に硫酸アルミニウムカリウム水和物(最終アルミニウム濃度:1、5、20mg/mL)を添加し、アルミニウムの血清蛋白結合率を限外ろ過法により測定した結果、各濃度における結合率はそれぞれ91.6±2.6、94.9±0.8、99.1±0.3%(平均値±標準偏差、n=4)であった(in vitro)。
16.5 排泄
非高齢者において、投与後96時間までの尿中排泄率はアルミニウムが56.6±11.1%、タンニン酸が8.4±6.7%であった。また高齢者において、投与後96時間までのアルミニウムの尿中排泄率は48.7±4.8%であった。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内前期第II相試験
脱出を伴う内痔核(Goligherの内痔核分類第III、IV度)患者を対象として、15例の「脱出」、「排便時出血」及び「痔核の大きさ」の消失率について検討した結果は以下のとおりである1)。
| 評価項目 | 局所麻酔剤による調製注) |
| 1%プロカイン塩酸塩注射液※1 | |
| 脱出 | 100%(15/15) |
| 排便時出血 | 92%(11/12) |
| 痔核の大きさ※2 | 93%(14/15) |
自他覚症状の有害事象は40%(6/15例)に発現した。その内訳は、吐き気、血栓形成性痔核、上気道感染、血圧低下、かぜ症候群、血尿・頻尿・多尿が各7%(1/15例)であった。
臨床検査値異常は27%(4/15例)に認められた。その内訳は、CRP上昇20%(3/15例)、APTT延長13%(2/15例)、白血球数増加、アルブミン低下、A/G比低下、プロトロンビン時間延長、ALT上昇、尿糖陽性増悪、尿蛋白陽性化、尿沈渣・赤血球増多、尿潜血陽性化、尿中β2マイクログロブリン上昇が各7%(1/15例)であった。
投与後合併症(本剤の投与により発現することが予想された合併症)の発現率は、肛門部硬結100%(15/15例)、排便困難33%(5/15例)、肛門部疼痛27%(4/15例)、肛門部出血27%(4/15例)、排尿困難、肛門部壊死が各7%(1/15例)であった。
臨床検査値異常は27%(4/15例)に認められた。その内訳は、CRP上昇20%(3/15例)、APTT延長13%(2/15例)、白血球数増加、アルブミン低下、A/G比低下、プロトロンビン時間延長、ALT上昇、尿糖陽性増悪、尿蛋白陽性化、尿沈渣・赤血球増多、尿潜血陽性化、尿中β2マイクログロブリン上昇が各7%(1/15例)であった。
投与後合併症(本剤の投与により発現することが予想された合併症)の発現率は、肛門部硬結100%(15/15例)、排便困難33%(5/15例)、肛門部疼痛27%(4/15例)、肛門部出血27%(4/15例)、排尿困難、肛門部壊死が各7%(1/15例)であった。
17.1.2 国内第III相試験
脱出を伴う内痔核(Goligherの内痔核分類第II、III、IV度)患者を対象として、総症例103例の「脱出」、「排便時出血」及び「痔核の大きさ」の消失率について検討した結果は以下のとおりである3)。
| 評価項目 | 局所麻酔剤による調製 | 生理食塩液注)による調製 | 合計 |
| 0.5%リドカイン注射液 | |||
| 脱出 | 92%(44/48) | 96%(53/55) | 94%(97/103) |
| 排便時出血 | 88%(21/24) | 100%(30/30) | 94%(51/54) |
| 痔核の大きさ※1 | 56%(27/48) | 60%(33/55) | 58%(60/103) |
自他覚症状の有害事象は41%(43/105例)に発現し、本剤との因果関係「関連なし」を除いた副作用の発現率は19%(20/105例)であった。有害事象のうち発現頻度が3%以上のものは、発熱9%(9/105例)、嘔気6%(6/105例)、下痢、血圧低下、不眠症各4%(4/105例)、食欲不振、血栓形成性痔核、頭痛各3%(3/105例)であった。
発現頻度が5%以上の臨床検査値異常は、CRP上昇11%(12/105例)、尿中β2マイクログロブリン上昇10%(10/105例)、リンパ球減少9%(9/104例)、尿糖陽性8%(8/105例)、白血球数変動(増加7%(7/104例)、減少1%(1/104例))、好中球増加7%(7/99例)、AST上昇、ALT上昇各5%(5/105例)であった。
投与後合併症の発現率は、肛門部硬結74%(78/105例)、肛門部疼痛51%(54/105例)、腰椎麻酔後頭痛23%(9/39例)、排便困難19%(20/105例)、排尿困難18%(19/105例)、肛門部浮腫18%(19/105例)、皮垂8%(8/105例)、肛門部出血5%(5/105例)、肛門部壊死1%(1/105例)であった。
発現頻度が5%以上の臨床検査値異常は、CRP上昇11%(12/105例)、尿中β2マイクログロブリン上昇10%(10/105例)、リンパ球減少9%(9/104例)、尿糖陽性8%(8/105例)、白血球数変動(増加7%(7/104例)、減少1%(1/104例))、好中球増加7%(7/99例)、AST上昇、ALT上昇各5%(5/105例)であった。
投与後合併症の発現率は、肛門部硬結74%(78/105例)、肛門部疼痛51%(54/105例)、腰椎麻酔後頭痛23%(9/39例)、排便困難19%(20/105例)、排尿困難18%(19/105例)、肛門部浮腫18%(19/105例)、皮垂8%(8/105例)、肛門部出血5%(5/105例)、肛門部壊死1%(1/105例)であった。
17.1.3 国内高齢者薬物動態試験
脱出を伴う内痔核(Goligherの内痔核分類第III、IV度)高齢患者(65歳以上)を対象として、6例の「脱出」、「排便時出血」及び「痔核の大きさ」の消失率について検討した結果は以下のとおりである2)。
| 評価項目 | 局所麻酔剤による調製 |
| 0.5%リドカイン注射液 | |
| 脱出 | 100%(6/6) |
| 排便時出血 | 100%(3/3) |
| 痔核の大きさ※1 | 100%(6/6) |
自他覚症状の有害事象は17%(1/6例)に発現し、因果関係を否定できない副作用は認められなかった。有害事象1例の内訳は、頭痛、頭重感、血圧上昇が各17%(1/6例)であった。
臨床検査値異常は50%(3/6例)に認められた。その内訳は、好酸球上昇、赤血球数減少、ヘモグロビン減少、トリグリセライド上昇、総ビリルビン上昇、BUN上昇、CRP上昇、尿潜血陽性が各17%(1/6例)であり、尿中β2マイクログロブリン上昇が20%(1/5例)であった。
投与後合併症の発現率は、肛門部硬結83%(5/6例)、肛門部疼痛33%(2/6例)、排便困難17%(1/6例)、肛門部出血17%(1/6例)であった。
臨床検査値異常は50%(3/6例)に認められた。その内訳は、好酸球上昇、赤血球数減少、ヘモグロビン減少、トリグリセライド上昇、総ビリルビン上昇、BUN上昇、CRP上昇、尿潜血陽性が各17%(1/6例)であり、尿中β2マイクログロブリン上昇が20%(1/5例)であった。
投与後合併症の発現率は、肛門部硬結83%(5/6例)、肛門部疼痛33%(2/6例)、排便困難17%(1/6例)、肛門部出血17%(1/6例)であった。
注)「ジオン注無痛化剤付」の承認された用法は、「用時、ジオン注無痛化剤付1バイアル(10mL)に添付の希釈液10mLを加えて20mLとし、硫酸アルミニウムカリウム水和物として2%溶液に調製する」である。
18. 薬効薬理
18.1 作用機序
本剤を痔核に投与すると、投与局所に壊死を伴う急性炎症が惹起され、その後、組織修復過程である肉芽形成及び線維化を経て、痔核は硬化退縮する。また、急性炎症により投与局所では血管透過性が亢進し、局所血液が濃縮され、血流は停滞・停止する。この血流量減少作用により、痔核の出血症状が早期に改善される。
本剤の炎症惹起作用及び組織硬化作用は硫酸アルミニウムカリウム水和物による。また、タンニン酸は、硫酸アルミニウムカリウム水和物による急性期の白血球浸潤を抑制し、過度の急性炎症反応を制御することにより組織障害を防ぐ。
18.2 炎症惹起作用
本剤及び硫酸アルミニウムカリウム水和物の皮下投与は、血管透過性亢進作用(投与直後、マウス)、白血球浸潤促進作用(投与3日後、ラット)及び肉芽形成作用(投与14日後、ラット)を示した4)。
18.3 肉芽形成及び線維化による組織硬化・縮小
本剤をラットの背部皮下に投与し、投与部位の組織変化を経時的に検討した。その結果、投与後早期に壊死を伴う炎症が発現し、投与7日後頃から、その修復像として類上皮肉芽腫が発現し線維化が認められた。類上皮肉芽腫は投与14日後をピークに増大し、線維化のピークは投与28日後であった。類上皮肉芽腫は線維化の進行とともに投与56日後にかけて縮小した4)。
18.4 血流量減少作用
18.4.1 本剤をラットの腹部皮下に投与し、投与部位における血流量減少作用を検討した結果、投与部位において投与5分後から皮膚血流量を減少させ、その作用は投与120分後まで持続した5)。
18.4.2 本剤をラット腸間膜表面に灌流すると、血管透過性亢進及び静脈血液のヘマトクリット値上昇を呈するとともに、血流が停止した5)。
18.5 タンニン酸の炎症抑制作用
タンニン酸の配合は、ラット皮下投与部位における硫酸アルミニウムカリウム水和物による白血球浸潤促進作用(投与3日後)を抑制したが、肉芽形成作用(投与14日後)は抑制しなかった4)。
19. 有効成分に関する理化学的知見
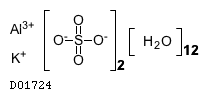
19.1. 硫酸アルミニウムカリウム水和物
19.2. タンニン酸
22. 包装
ジオン注無痛化剤付
10mL 1バイアル
希釈液 10mL 1バイアル添付
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
ジェイドルフ製薬株式会社
学術部 くすり相談窓口
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:06-7507-2532
FAX:06-7507-2528
製品情報問い合わせ先
ジェイドルフ製薬株式会社
学術部 くすり相談窓口
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:06-7507-2532
FAX:06-7507-2528
26. 製造販売業者等
26.1 製造販売元
ジェイドルフ製薬株式会社
滋賀県甲賀市土山町北土山2739-1番地
26.2 提携先
レキオファーマ株式会社
その他の説明
<薬液の調製方法>
ジオン注無痛化剤付バイアル
希釈液(無痛化剤入り)
[1]添付の希釈液10mLを注射筒に採る。
[2]ジオン注無痛化剤付バイアルのゴム栓の中心部に注射針を垂直に刺入して[1]の希釈液10mLを注入する。
[3]注入後、ジオン注無痛化剤付バイアルを軽く振盪し、均一に混和する。
[4]ジオン注無痛化剤付バイアルから[3]で調製した薬液を注射筒に採り、使用する。