医薬品情報
| 総称名 | フルダラ |
|---|---|
| 一般名 | フルダラビンリン酸エステル |
| 欧文一般名 | Fludarabine Phosphate |
| 製剤名 | フルダラビンリン酸エステル製剤 |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 薬効分類番号 | 4229 |
| ATCコード | L01BB05 |
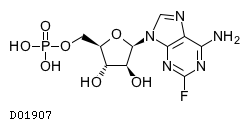
| KEGG DRUG |
D01907
フルダラビンリン酸エステル
|
| KEGG DGROUP |
DG02018
代謝拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| フルダラ静注用50mg | Fludara I.V.Infusion | サノフィ | 4229400D1033 | 26066円/瓶 | 劇薬, 処方箋医薬品 |
1. 警告
1.1 本剤は、緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に本剤の有効性及び危険性を十分説明し、同意を得てから投与すること。
同種造血幹細胞移植の前治療として本剤を使用する場合には、同種造血幹細胞移植に十分な知識・経験を持つ医師のもとで、適切と判断される症例についてのみ投与すること。
同種造血幹細胞移植の前治療として本剤を使用する場合には、同種造血幹細胞移植に十分な知識・経験を持つ医師のもとで、適切と判断される症例についてのみ投与すること。
1.2 骨髄抑制により感染症又は出血傾向等の重篤な副作用が増悪又は発現することがあるので、頻回に臨床検査(血液検査、肝機能・腎機能検査等)を行うなど、患者の状態を十分に観察すること。[8.1、9.1.1、11.1.1、11.1.5参照]
1.3 遷延性のリンパ球減少により、重症の免疫不全が増悪又は発現する可能性があるので、頻回に臨床検査(血液検査等)を行うなど、免疫不全の徴候について綿密な検査を行うこと。[8.2参照]
1.4 致命的な自己免疫性溶血性貧血が報告されているので、自己免疫性溶血性貧血の既往歴の有無、クームス試験の結果に拘わらず、溶血性貧血の徴候について綿密な検査を行うこと。[11.1.6参照]
1.5 放射線非照射血の輸血により移植片対宿主病(GVHD:graft versus host disease)があらわれることがあるので、本剤による治療中又は治療後の患者で輸血を必要とする場合は、照射処理された血液を輸血すること。[11.1.6参照]
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<貧血又は血小板減少症を伴う慢性リンパ性白血病>
本剤の対象は、未治療例の場合、原疾患の進展に起因する貧血又は血小板減少症を伴う慢性リンパ性白血病患者(Rai分類でハイリスク群又はBinet分類でB又はC期)であり、既治療例の場合、少なくとも一種類の標準的なアルキル化剤を含む治療に無効又は進行性の慢性リンパ性白血病患者である。
6. 用法及び用量
<貧血又は血小板減少症を伴う慢性リンパ性白血病、再発又は難治性の低悪性度B細胞性非ホジキンリンパ腫及びマントル細胞リンパ腫>
通常、成人にはフルダラビンリン酸エステルとして、1日量20mg/m2(体表面積)を5日間連日点滴静注(約30分)し、23日間休薬する。これを1クールとし、投薬を繰り返す。
なお、患者の状態により適宜増減する。
なお、患者の状態により適宜増減する。
<同種造血幹細胞移植の前治療>
フルダラビンリン酸エステルとして、1日量30mg/m2(体表面積)を6日間連日点滴静注(約30分)する。なお、患者の状態により、投与量及び投与日数は適宜減ずる。
<腫瘍特異的T細胞輸注療法の前処置>
再生医療等製品の用法及び用量又は使用方法に基づき使用する。
<再発又は難治性の急性骨髄性白血病>
他の抗悪性腫瘍剤等との併用において、通常、フルダラビンリン酸エステルとして、1日量30mg/m2(体表面積)を5日間連日点滴静注(約30分)する。なお、患者の状態により、投与量及び投与日数は適宜減ずる。
7. 用法及び用量に関連する注意
<慢性リンパ性白血病、低悪性度B細胞性非ホジキンリンパ腫及びマントル細胞リンパ腫>
7.1 腎機能が低下している患者(クレアチニンクリアランスが30〜70mL/分)では、腎機能の低下に応じて次のような目安により投与量を減量し、安全性を確認しながら慎重に投与すること。[9.2.2、16.6.1参照]
7.1.1 減量の目安
| クレアチニンクリアランス(mL/分) | 投与量(mg/m2) |
| 70 | 18 |
| 50 | 14 |
| 30 | 12 |
7.2 本剤投与にあたっては、好中球、血小板等の変動に十分留意し、前クールにおいて、高度の骨髄抑制が認められなかった場合に限り増量(最大25mg/m2/日)を考慮する。
<同種造血幹細胞移植の前治療>
7.3 他の抗悪性腫瘍剤や全身放射線照射と併用すること。
7.4 小児における本剤の有効性及び安全性は確立していない。使用経験が限られている。
8. 重要な基本的注意
<効能共通>
8.1 骨髄抑制により感染症又は出血傾向等の重篤な副作用が増悪又は発現することがあるので、頻回に臨床検査(血液検査、肝機能・腎機能検査等)を行うこと。また、使用が長期間にわたると副作用が強くあらわれ、遷延性に推移することがあるので、投与は慎重に行うこと。[1.2、9.1.1、11.1.1、11.1.5、11.1.9、11.1.10、15.1.3参照]
<同種造血幹細胞移植の前治療>
8.4 本剤を用いる際には、患者の状態及び臓器機能(心、肺、肝、腎等)を十分検討し、同種造血幹細胞移植を実施可能と判断される患者にのみ投与し、以下の事項について特に注意すること。
8.4.1 本剤の投与後は患者の状態を十分に観察し、致命的な感染症の発現を抑制するため、抗菌剤投与等の感染症対策を行い、適切な無菌管理を行うこと。
8.4.2 本剤の投与後は輸血及び造血因子の投与等適切な支持療法を行うこと。
<再発又は難治性の急性骨髄性白血病>
8.5 本剤を使用する際には、関連文献(「医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:フルダラビンリン酸エステル(再発又は難治性の急性骨髄性白血病)」等)を熟読すること1)。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 感染症を合併している患者
9.1.2 B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者(クレアチニンクリアランス<24時間蓄尿により測定>が30mL/分未満の患者)
投与しないこと。本剤は腎から排泄されるので、排泄遅延により副作用が強くあらわれるおそれがある。[2.1参照]
9.2.2 腎機能が低下している患者(クレアチニンクリアランスが30〜70mL/分の患者)
9.3 肝機能障害患者
症状を悪化させるおそれがある。
9.4 生殖能を有する者
9.5 妊婦
9.6 授乳婦
授乳を避けさせること。動物実験(ラット)で乳汁中に移行することが認められている。
9.7 小児等
<慢性リンパ性白血病、低悪性度B細胞性非ホジキンリンパ腫、マントル細胞リンパ腫及び同種造血幹細胞移植の前治療>
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
本剤投与前に患者の状態及び臓器機能を十分検討し確認すること。投与開始後は、患者の状態を慎重に観察すること。一般に生理機能が低下している。
10. 相互作用
10.1 併用禁忌
10.2 併用注意
| シタラビン | 骨髄抑制等の副作用が増強するおそれがある。 | in vivo試験及びin vitro試験において、シタラビンの活性代謝物であるara-CTPの細胞内濃度の上昇が認められている。 |
| 他の抗悪性腫瘍剤 | 骨髄抑制等の副作用が増強するおそれがある。 | ともに骨髄抑制作用を有する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制(頻度不明)
11.1.2 間質性肺炎(頻度不明)
呼吸困難、咳、発熱等の症状が認められた場合には速やかにX線検査を行い、本剤の投与を中止するとともに、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.3 精神神経障害(頻度不明)
錯乱、昏睡、興奮、けいれん発作、失明、末梢神経障害等の精神神経障害があらわれることがある。
11.1.4 腫瘍崩壊症候群(頻度不明)
初期症状として、側腹部痛、血尿があらわれることがある。この合併症は高尿酸血症、高リン酸血症、低カルシウム血症、代謝性アシドーシス、高カリウム血症、血尿及び腎不全を伴うことがある。本剤の治療効果が投与開始後1週間であらわれることがあるので、この合併症の危険性のある患者では予防措置を講じること。
11.1.5 重症日和見感染(頻度不明)
11.1.6 自己免疫性溶血性貧血(頻度不明)
11.1.7 自己免疫性血小板減少症(頻度不明)
11.1.8 赤芽球癆(頻度不明)
11.1.9 脳出血、肺出血、消化管出血(いずれも頻度不明)[8.1参照]
11.1.10 出血性膀胱炎(頻度不明)
血尿が認められた場合には減量、休薬等の適切な処置を行うこと。[8.1参照]
11.1.11 重篤な皮膚障害(頻度不明)
皮膚粘膜眼症候群(Stevens-Johnson症候群)、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)があらわれることがあるので、観察を十分に行い、発熱、口腔粘膜の発疹、口内炎等が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.12 心不全(頻度不明)
11.1.13 進行性多巣性白質脳症(PML)(頻度不明)
本剤の治療期間中及び治療終了後は患者の状態を十分に観察し、意識障害、認知障害、麻痺症状(片麻痺、四肢麻痺)、言語障害等の症状があらわれた場合には、MRIによる画像診断及び脳脊髄液検査を行うとともに、投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 5%以上注) | 0.1〜5%未満注) | 頻度不明 | |
| 呼吸器 | 咳、喘鳴、呼吸障害、呼吸困難、低酸素(症) | 上気道炎、鼻咽頭炎、咽頭炎、アレルギー性鼻炎 | |
| 消化器 | 悪心、嘔吐 | 便秘、口唇疱疹 | 食欲不振、下痢、口内炎、胃部不快感、腹痛、消化不良 |
| 精神神経系 | 脱力感 | 下肢知覚異常、手指感覚異常 | 視力障害、視神経炎、視神経障害、下垂手、頭痛、不眠、めまい、感覚減退(しびれ)、錯感覚 |
| 循環器 | 不整脈、脈拍数増加 | 浮腫、動悸 | |
| 代謝異常 | 代謝性アシドーシス、膵酵素変化 | ||
| 肝臓 | LDH上昇、AST上昇、ALT上昇、総ビリルビン上昇 | 黄疸、ALP上昇、γ-GTP上昇、血清総蛋白減少、血清アルブミン低下 | ウロビリン尿 |
| 皮膚 | 皮膚そう痒症 | 発疹、表皮剥離 | |
| 腎臓 | BUN上昇、蛋白尿 | クレアチニン上昇 | 高尿酸血症、高リン酸血症、低カルシウム血症、高カリウム血症、低ナトリウム血症 |
| 泌尿器 | 尿中結晶 | ||
| その他 | 発熱、疲労 | 疼痛、水痘、体重減少 | 悪寒、倦怠感、腰痛、CRP上昇、筋肉痛、神経痛、味覚異常、多汗、潮紅、無力症、インフルエンザ様症状、末梢性浮腫、四肢痛、粘膜障害 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は、通常2.5mLの注射用水にて溶解し(フルダラビンリン酸エステル20mg/mL)、体表面積より計算した必要量をとり、日局生理食塩液100mL以上に希釈する。
14.1.2 他の薬剤との混注を避けること。配合変化を起こす可能性がある。
14.1.3 本剤の取扱い及び調製にあたっては、手袋、防護メガネを使用するなど慎重に行うこと。本剤が皮膚又は粘膜に触れた場合には、直ちに石鹸でよく洗うこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 フルダラビンリン酸エステルと他の抗悪性腫瘍剤で治療された患者に、骨髄異形成症候群、急性白血病、エプスタイン・バーウイルス関連リンパ増殖性疾患が発生したとの報告がある。
15.1.2 本剤の治療中又は治療後に、皮膚癌の発生、悪化又は再燃が報告されている。
15.1.3 固形腫瘍患者を対象とした外国の第I相臨床試験で、顆粒球数が最低値を示すまでの平均期間(中央値)は、13日(範囲:3〜25日)であり、血小板については16日(範囲:2〜32日)であった。[8.1参照]
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与及び反復投与
16.3 分布
16.3.1 蛋白結合率
16.4 代謝
本剤は静脈内投与後血液中で速やかに2F-ara-Aに代謝される(マウス、イヌ)。
16.5 排泄
本剤は静脈内投与後血液中で速やかに2F-ara-Aに代謝され、2F-ara-Aとして主に尿中に排泄される(マウス、イヌ)。
日本人のCLL及びATL患者に本剤15、20、25mg/m2注)を1日1回30分点滴静注5日間連日投与したとき、投与1日後までに投与量の29〜42%が2F-ara-Aとして尿中に排泄された。また、5日間連日投与したとき、2F-ara-Aの尿中排泄率は1日当りの投与量の29〜64%であった2)。
日本人のCLL及びATL患者に本剤15、20、25mg/m2注)を1日1回30分点滴静注5日間連日投与したとき、投与1日後までに投与量の29〜42%が2F-ara-Aとして尿中に排泄された。また、5日間連日投与したとき、2F-ara-Aの尿中排泄率は1日当りの投与量の29〜64%であった2)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
注)本剤の慢性リンパ性白血病、低悪性度B細胞性非ホジキンリンパ腫及びマントル細胞リンパ腫に対する承認用量は1日量20mg/m2(体表面積)である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<慢性リンパ性白血病>
17.1.1 国内第II相臨床試験
総症例26例を対象に本剤20mg/m2/日5日間投与及び休薬23日間(計28日間)を1クールとして最大6クール実施する国内臨床試験が行われた。奏効率(完全寛解及び部分寛解)は40%(10/25例;95%信頼区間:21.1-61.3%)であった。
主な副作用は、発熱15.4%(4/26例)、悪心、疲労、脱力感、手指感覚異常が各7.7%(2/26例)であった。
主な副作用は、発熱15.4%(4/26例)、悪心、疲労、脱力感、手指感覚異常が各7.7%(2/26例)であった。
<低悪性度B細胞性非ホジキンリンパ腫及びマントル細胞リンパ腫>
17.1.2 海外第III相臨床試験
総症例47例を対象に本剤25mg/m2/日注)5日間投与及び休薬23日間(計28日間)を1クールとし、奏効後にさらに2クール繰り返して最大10クールを実施する海外臨床試験が行われた。奏効率(完全寛解及び部分寛解)は55.3%(26/47例;90%信頼区間:42.3-67.8%)であった。また、無増悪生存期間(治療開始から増悪が記録された日までの期間)の中央値は10.9ヵ月(95%信頼区間[8.8-19.3ヵ月])であった。
主なグレード3以上の有害事象は、白血球減少23.4%(11/47例)、好中球減少21.3%(10/47例)、血小板数減少及び感染が各10.6%(5/47例)であった。
主なグレード3以上の有害事象は、白血球減少23.4%(11/47例)、好中球減少21.3%(10/47例)、血小板数減少及び感染が各10.6%(5/47例)であった。
注)本剤の低悪性度B細胞性非ホジキンリンパ腫及びマントル細胞リンパ腫に対する承認用量は1日量20mg/m2(体表面積)である。
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
19.1. フルダラビンリン酸エステル
22. 包装
1バイアル
23. 主要文献
- 医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:フルダラビンリン酸エステル(再発又は難治性の急性骨髄性白血病)
- 有馬直道 他, 癌と化学療法, 26, 619-29, (1999) »PubMed
- Danhauser L,et al., Cancer Chemother Pharmacol., 18 (2), 145-52, (1986) »PubMed
- 社内資料:国内第I相試験(2007年1月26日承認、CTD2.5.3.1、2.7.2.3)
- Reichelova V,et al., J Liq Chromatogr., 18, 1123-35, (1995)
- Malspeis L,et al., Semin Oncol., 17, 18-32, (1990) »PubMed
- 社内資料:腎機能低下患者における試験(1999年9月29日承認、申請資料概要へ-3.4)
- Huang P,et al., J Biol Chem., 265, 16617-25, (1990) »PubMed
- Huang P,et al., Molecular Pharmacology., 39, 449-55, (1991) »PubMed
- Tseng W-C,et al., Molecular Pharmacology., 21, 474-7, (1982) »PubMed
- Sandoval A,et al., Clin Cancer Res., 2, 1731-41, (1996) »PubMed
- Rao V,et al., Clin Cancer Res., 9, 3204-12, (2003) »PubMed
- Yamauchi T,et al., Clin Cancer Res., 7, 3580-9, (2001) »PubMed
- 社内資料:in vitro抗腫瘍効果(2007年1月26日承認、CTD2.6.2.1)
- Clodi K,et al., Br J Haematol., 103, 217-9, (1998) »PubMed
- Di Gaetano N,et al., Br J Haematol., 114, 800-9, (2001) »PubMed
- Lathan B,et al., Eur J Cancer Clin Oncol., 24, 1891-5, (1988) »PubMed
- 社内資料:in vivo抗腫瘍効果(2007年1月26日承認、CTD2.6.2.1)
- Bai L,et al., Oncol Rep., 7, 33-8, (2000) »PubMed
- 社内資料:in vivo抗腫瘍効果(2007年1月26日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
サノフィ株式会社
コールセンター くすり相談室
〒163-1488
東京都新宿区西新宿三丁目20番2号
電話:フリーダイヤル 0120-109-905
製品情報問い合わせ先
サノフィ株式会社
コールセンター くすり相談室
〒163-1488
東京都新宿区西新宿三丁目20番2号
電話:フリーダイヤル 0120-109-905
26. 製造販売業者等
26.1 製造販売元
サノフィ株式会社
〒163-1488
東京都新宿区西新宿三丁目20番2号