医薬品情報
| 総称名 | ホスカビル |
|---|---|
| 一般名 | ホスカルネットナトリウム水和物 |
| 欧文一般名 | Foscarnet Sodium Hydrate |
| 製剤名 | ホスカルネットナトリウム水和物注射剤 |
| 薬効分類名 | 抗ウイルス化学療法剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AD01 |
| KEGG DRUG |
D02267
ホスカルネットナトリウム水和物
|
| KEGG DGROUP |
DG01937
抗サイトメガロウイルス薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年7月 改訂(第3版)
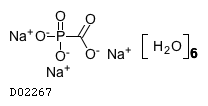
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| 点滴静注用ホスカビル注24mg/mL | Foscavir Infusion Solution 24mg/mL | クリニジェン | 6250403A1033 | 10655円/瓶 | 毒薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<造血幹細胞移植患者におけるサイトメガロウイルス血症及びサイトメガロウイルス感染症>
5.1 本剤は、先天性もしくは新生児サイトメガロウイルス感染症を効能・効果とはしていない。
5.2 本剤は、サイトメガロウイルス感染が確認された患者において、治療上の有益性が危険性を上まわると判断される場合にのみ投与すること。
5.3 本剤は、造血幹細胞移植患者におけるサイトメガロウイルス血症及びサイトメガロウイルス感染症において、他剤の治療効果が不十分又は忍容性に問題があると考えられる場合に投与すること。
5.4 本剤をサイトメガロウイルス非感染者に感染予防の目的で使用しないこと。
<後天性免疫不全症候群(エイズ)患者におけるサイトメガロウイルス網膜炎>
5.5 本剤の投与により重篤な副作用が報告されていること及び本剤ではサイトメガロウイルス網膜炎を完治できないことを念頭におき、患者の精神面も含めて治療の要否を慎重に考えること。
6. 用法及び用量
<後天性免疫不全症候群(エイズ)患者におけるサイトメガロウイルス網膜炎、造血幹細胞移植患者におけるサイトメガロウイルス感染症>
初期療法
通常、ホスカルネットナトリウム水和物として1回体重1kgあたり60mgを、1時間以上かけて8時間ごとに1日3回、又は1回体重1kgあたり90mgを、2時間以上かけて12時間ごとに1日2回、それぞれ点滴静注する。なお、初期療法は2〜3週間以上行う。
維持療法
初期療法に続く維持療法には、通常、ホスカルネットナトリウム水和物として1回体重1kgあたり90〜120mgを2時間以上かけて1日1回点滴静注する。
維持療法中に再発が認められた場合は、初期療法の用法・用量により再投与することができる。
維持療法中に再発が認められた場合は、初期療法の用法・用量により再投与することができる。
<造血幹細胞移植患者におけるサイトメガロウイルス血症>
初期療法
通常、ホスカルネットナトリウム水和物として1回体重1kgあたり60mgを、1時間以上かけて12時間ごとに1日2回点滴静注する。初期療法は1〜2週間以上行う。
維持療法
通常、ホスカルネットナトリウム水和物として1回体重1kgあたり90〜120mgを2時間以上かけて1日1回点滴静注する。
維持療法中に再発が認められた場合は、初期療法の用法・用量により再投与することができる。
維持療法中に再発が認められた場合は、初期療法の用法・用量により再投与することができる。
<造血幹細胞移植後のヒトヘルペスウイルス6脳炎>
通常、ホスカルネットナトリウム水和物として1回体重1kgあたり60mgを、1時間以上かけて8時間ごとに1日3回点滴静注する。
なお、本剤による腎障害を軽減するため、本剤による治療中には水分補給を十分に行い、利尿を確保すること。
<効能共通>
(投与法及び希釈調製法)
本剤を中心静脈より投与する場合は希釈せずに用いるが、末梢静脈より投与する場合には、血管への刺激を軽減するため、5%ブドウ糖注射液又は生理食塩液にて2倍に希釈して用いる(12mg/mL)こと。なお、本剤の血漿中濃度の過剰な上昇により、本剤の毒性が増強することがあるので、点滴速度に十分注意し、点滴静注以外では投与しないこと。
また、点滴速度を調節するため、点滴ポンプを使用することが望ましい。
また、点滴速度を調節するため、点滴ポンプを使用することが望ましい。
(用量の調節)
本剤の用量は、各患者の腎機能に応じて個別に調節すること。
7. 用法及び用量に関連する注意
<造血幹細胞移植患者におけるサイトメガロウイルス血症>
7.1 サイトメガロウイルス血症に対して本剤を投与する場合には、臓器特異的感染症状の出現に関し注意深く経過観察を行うこと。なお、感染症状が出現した場合には、速やかにサイトメガロウイルス感染症に対する本剤投与量への変更等、適切な処置を行うこと。
<効能共通>
7.2 本剤の投与により重度の腎障害を起こすことがあるので、本剤投与中は、血清クレアチニン値を初期療法期には少なくとも隔日に、維持療法期では週に一度は測定し、腎機能に応じて投与量を調節すること。
なお、本剤投与中にクレアチニンクリアランス値が0.4mL/分/kg以下になった場合には休薬し、腎機能が回復するまで投与しないこと。[1.1、2.2、9.2.1、11.1.2、16.5参照]
なお、本剤投与中にクレアチニンクリアランス値が0.4mL/分/kg以下になった場合には休薬し、腎機能が回復するまで投与しないこと。[1.1、2.2、9.2.1、11.1.2、16.5参照]
腎機能に応じた1回投与量調節ガイド
<後天性免疫不全症候群(エイズ)患者におけるサイトメガロウイルス網膜炎、造血幹細胞移植患者におけるサイトメガロウイルス感染症>
初期療法
| クレアチニンクリアランス(mL/分/kg) | 通常投与量180mg/kg/日 | |
| 点滴時間1時間以上 | 点滴時間2時間以上 | |
| 1日3回(8時間毎)1回投与量(mg/kg) | 1日2回(12時間毎)1回投与量(mg/kg) | |
| >1.4 | 60 | 90 |
| 1.4≧ >1 | 45 | 70 |
| 1≧ >0.8 | 35 | 50 |
| 1日2回(12時間毎)1回投与量(mg/kg) | 1日1回(24時間毎)1回投与量(mg/kg) | |
| 0.8≧ >0.6 | 40 | 80 |
| 0.6≧ >0.5 | 30 | 60 |
| 0.5≧ ≧0.4 | 25 | 50 |
| 0.4> | 投与しないこと | |
維持療法
| クレアチニンクリアランス(mL/分/kg) | 通常投与量90mg/kg/日 | 通常投与量120mg/kg/日 |
| 点滴時間2時間以上 | ||
| 1日1回(24時間毎)1回投与量(mg/kg) | ||
| >1.4 | 90 | 120 |
| 1.4≧ >1 | 70 | 90 |
| 1≧ >0.8 | 50 | 65 |
| 2日に1回(48時間毎)1回投与量(mg/kg) | ||
| 0.8≧ >0.6 | 80 | 105 |
| 0.6≧ >0.5 | 60 | 80 |
| 0.5≧ ≧0.4 | 50 | 65 |
| 0.4> | 投与しないこと | |
<造血幹細胞移植患者におけるサイトメガロウイルス血症>
初期療法
| クレアチニンクリアランス(mL/分/kg) | 通常投与量120mg/kg/日 |
| 点滴時間1時間以上 | |
| 1日2回(12時間毎)1回投与量(mg/kg) | |
| >1.4 | 60 |
| 1.4≧ >1 | 45 |
| 1≧ >0.8 | 35 |
| 0.8≧ >0.6 | 25 |
| 0.6≧ >0.5 | 20 |
| 0.5≧ ≧0.4 | 15 |
| 0.4> | 投与しないこと |
維持療法
| クレアチニンクリアランス(mL/分/kg) | 通常投与量90mg/kg/日 | 通常投与量120mg/kg/日 |
| 点滴時間2時間以上 | ||
| 1日1回(24時間毎)1回投与量(mg/kg) | ||
| >1.4 | 90 | 120 |
| 1.4≧ >1 | 70 | 90 |
| 1≧ >0.8 | 50 | 65 |
| 2日に1回(48時間毎)1回投与量(mg/kg) | ||
| 0.8≧ >0.6 | 80 | 105 |
| 0.6≧ >0.5 | 60 | 80 |
| 0.5≧ ≧0.4 | 50 | 65 |
| 0.4> | 投与しないこと | |
<造血幹細胞移植後のヒトヘルペスウイルス6脳炎>
| クレアチニンクリアランス(mL/分/kg) | 通常投与量180mg/kg/日 |
| 点滴時間1時間以上 | |
| 1日3回(8時間毎)1回投与量(mg/kg) | |
| >1.4 | 60 |
| 1.4≧ >1 | 45 |
| 1≧ >0.8 | 35 |
| 0.8≧ >0.6 | 25 |
| 0.6≧ >0.5 | 20 |
| 0.5≧ ≧0.4 | 15 |
| 0.4> | 投与しないこと |
本用量調節ガイドを使用するには、クレアチニンクリアランス実測値(mL/分)を体重(kg)で除すか、血清クレアチニン値(mg/100mL)を用いて下記の計算式により、推定クレアチニンクリアランス値を求める。ただし、あくまでも推定値であるので、重症の腎障害症例においては必ずクレアチニンクリアランスを測定すること。
[クレアチニンクリアランス計算式]
(男性)
クレアチニンクリアランス(mL/分/kg)=(140−年齢)/(72×血清クレアチニン[mg/100mL])
(女性)
クレアチニンクリアランス(mL/分/kg)=(140−年齢)×0.85/(72×血清クレアチニン[mg/100mL])
7.3 本剤の腎障害を軽減するため、本剤初回投与前及び毎回の点滴静注時には適切な水分補給を行うこと(通常、本剤初回投与前及びその後本剤を点滴静注する毎にあわせて生理食塩液0.5〜1L/回、最大2.5L/日までを点滴静注する)。
7.4 利尿薬を併用する場合にはチアジド系利尿薬を用いる。
7.5 体重別標準的投与量
| 体重 | 初期投与量 | 維持投与量 | |||||
| 1回投与量 | 投与時間 | 投与間隔 | 1回投与量 | 投与時間 | |||
| 原薬 | 製剤 | 原薬 | 製剤 | ||||
| 40kg | 2,400mg 3,600mg | 100mL 150mL | 1時間以上 2時間以上 | 8時間毎 12時間毎 | 3,600〜4,800mg | 150〜200mL | 2時間以上 |
| 50kg | 3,000mg 4,500mg | 125mL 187.5mL | 1時間以上 2時間以上 | 8時間毎 12時間毎 | 4,500〜6,000mg | 187.5〜250mL | 2時間以上 |
| 60kg | 3,600mg 5,400mg | 150mL 225mL | 1時間以上 2時間以上 | 8時間毎 12時間毎 | 5,400〜7,200mg | 225〜300mL | 2時間以上 |
| 70kg | 4,200mg 6,300mg | 175mL 262.5mL | 1時間以上 2時間以上 | 8時間毎 12時間毎 | 6,300〜8,400mg | 262.5〜350mL | 2時間以上 |
| 80kg | 4,800mg 7,200mg | 200mL 300mL | 1時間以上 2時間以上 | 8時間毎 12時間毎 | 7,200〜9,600mg | 300〜400mL | 2時間以上 |
| 90kg | 5,400mg 8,100mg | 225mL 337.5mL | 1時間以上 2時間以上 | 8時間毎 12時間毎 | 8,100〜10,800mg | 337.5〜450mL | 2時間以上 |
| 100kg | 6,000mg 9,000mg | 250mL 375mL | 1時間以上 2時間以上 | 8時間毎 12時間毎 | 9,000〜12,000mg | 375〜500mL | 2時間以上 |
8. 重要な基本的注意
<後天性免疫不全症候群(エイズ)患者におけるサイトメガロウイルス網膜炎>
8.1 使用に際しては、患者又はそれに代わる適切な者に、次の事項についてよく説明し同意を得た後、使用すること。
・国内で実施された臨床試験の科学的なデータは少ないこと。
・本剤は後天性免疫不全症候群(エイズ)患者におけるサイトメガロウイルス網膜炎の根治療法薬ではないことから、症状が進行・再発する可能性があるので、定期的に眼科学的検査を受ける必要があること。
・腎障害、電解質異常に伴う発作があらわれ重篤な転帰をとることがあるので、口周囲のヒリヒリ感、四肢のしびれ知覚異常等の症状があらわれた場合には、直ちに担当医に報告すること。
<効能共通>
8.2 本剤は体内の2価陽イオンとキレートを形成し、血清中のカルシウム、マグネシウム濃度の低下を来すとの報告がある。また、血清中カリウム濃度の低下を来すことが報告されているので、本剤投与中は、定期的に血清電解質を測定するなど観察を十分に行い、口周囲のヒリヒリ感、四肢のしびれ感、知覚異常等の発現又は電解質異常が認められた場合には、適切な処置を行うこと。[1.2、9.1.1-9.1.3、11.1.4参照]
8.3 ショック等の重篤な過敏反応の発現を予測するため、十分な問診を行うこと。また、このような症状があらわれた場合には、本剤の投与を中止し、適切な処置を行うこと。[2.1参照]
8.4 泌尿・生殖器に局所刺激性による刺激感、潰瘍があらわれることがあるので、排尿後は洗浄・清拭等により衛生状態に注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 低カルシウム血症、低マグネシウム血症、低カリウム血症等の電解質異常のある患者
本剤のキレート作用によりカルシウム及びマグネシウムの血清中濃度の低下をさらに増強することがある。また、血清中カリウム濃度をさらに低下させることがある。[8.2参照]
9.1.2 中枢神経系に合併、既往のある患者
(1)中枢神経系に異常のある患者では、慎重に観察を行い、血清電解質の補正など適切な処置を行うこと。本剤による電解質異常により症状を悪化させることがある。[8.2参照]
(2)中枢神経系疾患の既往歴のある患者では、精神神経系副作用の発現に注意すること。
9.1.3 心機能に異常のある患者
慎重に観察を行い、血清電解質の補正など適切な処置を行うこと。本剤による電解質異常により症状を悪化させることがある。[8.2参照]
9.2 腎機能障害患者
9.2.1 クレアチニンクリアランス値が、0.4mL/分/kg未満の腎機能障害患者
9.2.2 クレアチニンクリアランス値が、0.4mL/分/kg以上の腎機能障害患者
腎障害を増悪させることがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上まわると判断される場合にのみ投与すること。動物実験(ラット)で胎盤通過性が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラット(75mg/kg投与)の乳汁中薬物濃度が母体血中濃度の3倍に達したとの報告がある。
9.7 小児等
9.7.1 治療上の有益性が危険性を上まわると判断される場合にのみ投与すること。本剤の歯あるいは骨への沈着は、成熟動物より幼若・成長期の動物に多いことが報告されており、ヒトでも同様の作用が予想される。
9.7.2 低出生体重児、新生児、乳児、幼児又は小児を対象とした臨床試験は実施していない。
9.8 高齢者
腎機能に注意し、慎重に投与量を設定すること。一般に腎機能が低下している場合が多い。
10. 相互作用
10.1 併用禁忌
| ペンタミジンイセチオン酸塩 ベナンバックス [2.3参照] | 腎障害の増強、低カルシウム血症が起こることがある。なお、海外で本剤とペンタミジンイセチオン酸塩(静注)との併用により、重篤な低カルシウム血症が発現し死亡した症例が報告されている。 | 相加的に副作用(腎障害、低カルシウム血症)が増強する。 |
10.2 併用注意
| 血清カルシウム濃度に影響を及ぼす薬剤 ループ利尿薬 等 フロセミド 等 | 低カルシウム血症が起こることがある。 | 本剤のキレート作用により、低カルシウム血症を呈しやすくなる。 |
| 腎毒性を有する薬剤 アミノグリコシド系抗生物質 ゲンタマイシン硫酸塩 アミカシン硫酸塩 等 スルファメトキサゾール・トリメトプリム バンコマイシン塩酸塩 アムホテリシンB シクロスポリン タクロリムス水和物 メトトレキサート シスプラチン 等 | 腎障害を増強することがある。 | 相加的に副作用(腎障害)が増強する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常がみられた場合には、投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)
熱・悪寒、発疹等を初発症状とし、戦慄、顔面蒼白、チアノーゼ、呼吸困難等のショック様症状があらわれることがある。
11.1.2 急性腎障害(1〜10%)
11.1.3 心不全(1%未満)、心停止(1%未満)、血栓性静脈炎(1〜10%)
11.1.5 呼吸抑制(1%未満)
11.1.6 麻痺性イレウス(1%未満)
11.1.7 失語症(1%未満)、痴呆(1%未満)
11.1.8 横紋筋融解症(頻度不明)
11.1.9 敗血症(1〜10%)
11.2 その他の副作用
| 10%以上 | 1〜10%未満 | 1%未満 | 頻度不明 | |
| 血液 | 貧血(28.7%)、血中ヘモグロビン減少、顆粒球減少 | 白血球減少、血小板減少 | 血栓症 | 白血球増多 |
| 循環器 | 高血圧、心電図異常、心悸亢進、浮腫、潮紅 | 徐脈、期外収縮、低血圧 | 心室性不整脈、QT間隔の延長 | |
| 呼吸器 | 呼吸困難、喉頭炎 | |||
| 過敏症 | 発疹、そう痒 | |||
| 皮膚 | 皮膚潰瘍形成 | 皮膚障害、多汗 | ||
| 腎臓 | クレアチニンクリアランス低下、血清クレアチニン上昇(18.6%)等の腎機能異常 | 尿毒症、排尿困難、尿道障害、多尿 | 蛋白尿、中毒性ネフロパシー、腎尿細管障害、夜間頻尿、抗利尿ホルモン異常 | 腎臓痛、尿崩症 |
| 代謝異常 | アシドーシス、Al-P上昇 | 血液量過多、LDH上昇、体重減少、アミラーゼ上昇、CK上昇 | ||
| 電解質異常 | 低マグネシウム血症(14.4%)、低カリウム血症(13.8%)、低カルシウム血症(11.7%) | 低リン酸血症、高リン酸血症、低ナトリウム血症 | 高カルシウム血症 | |
| 消化器 | 悪心(30.9%)・嘔吐(17.0%) | 下痢、食欲不振、腹痛、便秘、消化不良、味覚倒錯 | 腸炎、膵炎、鼓腸放屁、口渇、口内乾燥 | |
| 精神神経系 | 知覚異常(12.2%)、頭痛(11.2%) | めまい・眩暈、不随意筋収縮、無力症、錯乱、知覚減退、神経障害、抑うつ、不安、疲労、倦怠感、精神病、神経過敏、興奮、攻撃性、振戦、運動失調 | 緊張亢進、ジスキネジア、末梢神経障害、反射亢進、昏迷、協調異常、EEG異常、傾眠、健忘 | |
| 泌尿・生殖器 | 局所刺激性による性器の刺激、陰茎潰瘍、外陰膣潰瘍 | |||
| 肝臓 | AST上昇、ALT上昇、γ-GTP上昇、A/G比異常 | |||
| 筋肉 | ミオパシー、筋炎、筋脱力、筋肉痛 | |||
| 注射部位 | 注射部位の疼痛 | 注射部位の炎症 | ||
| その他 | 発熱(10.6%) | 悪寒、感染症 | 視覚異常、疼痛、網膜剥離、複視、耳鳴、耳痛 |
13. 過量投与
13.1 症状
本剤の過量投与が、米国における189例の後天性免疫不全症候群(エイズ)患者におけるサイトメガロウイルス網膜炎を対象とした臨床試験において10例報告されている。1例は大発作、昏睡を起こし、呼吸停止、心停止により死亡した症例で、他の9例はそれぞれ推奨用量の1.14〜8倍(平均4倍)の投与を受け、3例に痙れん発作、3例に腎不全、4例に四肢や口周囲知覚異常、5例でカルシウム及びリン酸塩等の電解質異常が発現した。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は保存剤が添加されていないので、開封後は24時間以内に使用すること。
14.1.2 本剤は配合変化を起こすことが知られているので、希釈液には生理食塩液及び5%ブドウ糖注射液以外は使用しないこと。
14.2 薬剤投与時の注意
14.2.1 局所刺激性があるため、誤って薬液が皮膚や目に触れた場合は、局所刺激及び灼熱感が生じることがある。このような場合には、流水で十分に洗浄すること。
14.2.2 配合変化を起こすため、同一カテーテルを通じて、他剤や補液を同時に投与しないこと。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 変異原性試験
CHO細胞を用いた染色体異常試験、マウス培養細胞を用いた形質転換試験及びマウスを用いた小核試験で変異原性が認められた。
16. 薬物動態
16.1 血中濃度
16.3 分布
16.3.1 分布容積
16.3.2 血漿蛋白結合率
in vitro試験では、血漿中ホスカルネット濃度1〜1000μmol/Lで14〜17%が血漿蛋白と結合する(海外データ)。
16.3.3 脳脊髄液の移行
後天性免疫不全症候群患者に本剤を56〜213mg/kgの用量で静脈内注入時の脳脊髄液中のホスカルネット濃度は、ほぼ50〜250μmol/Lで、この濃度は血漿中濃度の10〜70%に相当した4)(海外データ)。
16.5 排泄
本剤を後天性免疫不全症候群患者に反復静脈内注入したときの血漿クリアランス(2臨床試験)は130±44(n=12)及び178±48mL/分(n=10)で、連続注入したときの血漿クリアランス(2臨床試験)は152±59(n=12)及び214±25mL/分(n=5)であった。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
本剤を後天性免疫不全症候群患者(n=6)の静脈内に3日間持続注入後の血漿中ホスカルネット濃度の半減期は、0.45±0.32時間(α相)、3.3±1.3時間(β相)であった。血漿中ホスカルネットの半減期は、腎障害の重症度に比例して長くなり、24時間のクレアチニンクリアランス値が44〜90mL/分の患者における半減期は2〜8時間と報告されている3)(海外データ)。
16.6.2 薬物暴露と腎機能低下との関連
本剤で初期療法を受けている患者データの解析から、ホスカルネットに対する累積暴露(血漿中ホスカルネット濃度−時間曲線下面積)と投与終了時における腎機能(血清クレアチニン)低下との関連性が示唆されている。
16.7 薬物相互作用
17. 臨床成績
17.1 有効性及び安全性に関する試験
<後天性免疫不全症候群患者におけるサイトメガロウイルス網膜炎>
17.1.1 国内第III相オープン試験
後天性免疫不全症候群患者(先天性免疫不全症候群患者1例を含む)におけるサイトメガロウイルス網膜炎計10例に、初期治療として1日体重1kgあたりホスカルネット180mgを1日2〜3回に分けて4週間点滴静注した。続く4週間を維持治療とし、1日1回体重1kgあたりホスカルネット90〜120mgを点滴静注した。初期療法期では11眼中8眼(9例)に有効(眼底所見改善度「不変」以上)であり、このうち「著明改善」(網膜炎スコアの減少率76%以上)は6眼であった。また、維持療法期では4眼中4眼(3例)に有効であった。継続観察期に移行した2例で、再燃・再発はみられなかった9)。
有害事象9)
10例中7例(70.0%)に28件の有害事象が発現し、うち、本剤との因果関係が否定されなかった有害事象(副作用)は5例(50.0%)に15件認められた。その内訳は、アナフィラキシーショック、頭部不快感、口唇のしびれ、四肢しびれ、こむら返り、喉頭浮腫、吃逆、白血球数減少、赤血球数減少、代謝性アシドーシス、低カルシウム血症、低マグネシウム血症、低カリウム血症、高リン血症、腎不全各1件(10.0%)であった。
17.1.2 海外第I・II相試験
第I相、第II相試験のうち有効性評価を行った4試験において、後天性免疫不全症候群患者に発症したサイトメガロウイルス網膜炎に対して、初期治療として1日体重1kgあたりホスカルネット180mgを1日2〜3回に分けて14〜21日間点滴静注した。続く12週間以上を維持治療とし、1日1回体重1kgあたりホスカルネット60〜120mgを点滴静注した。有効率は、初期療法期:87%(82/94例)、維持療法期:89%(40/45例)であった。
17.3 その他
17.3.1 水分補給による腎障害の軽減
(1)多施設共同臨床試験において、本剤初回投与前に0.75L及びその後本剤を点滴静注する毎にあわせて0.5〜0.75L/回の生理食塩液を点滴静注したところ、腎障害が軽減できたことが報告されている。
(2)本剤投与時に水分補給を行わなかった症例をレトロスペクティブに、1.5〜2.5L/日の水分補給を行った症例をプロスペクティブに調査したところ、前者では腎障害(投与前値に比して25%以上の血清クレアチニン上昇)が66%に発現したのに対し、後者では13%と有意に少なく、充分な水分補給により本剤による腎障害を軽減または予防できることが示唆された。
18. 薬効薬理
18.1 作用機序
ホスカルネットナトリウムは、DNAポリメラーゼのピロリン酸結合部位に直接作用して、DNAポリメラーゼ活性を抑制し10)、サイトメガロウイルス及びヒトヘルペスウイルス6の増殖を抑制する。
18.2 抗ウイルス作用
18.3 耐性
野生型サイトメガロウイルスをホスカルネットナトリウム添加培地で継代培養することにより、ウイルスDNAポリメラーゼ遺伝子の突然変異に基づくホスカルネット耐性サイトメガロウイルス株が分離されている。したがって、ホスカルネットナトリウムに対する臨床応答が認められない場合には、耐性変異株の出現する可能性があるので、臨床分離株のホスカルネットナトリウムに対する感受性試験を行うことが望ましい。
なお、サイトメガロウイルス網膜炎を発症した後天性免疫不全症候群患者でなされた薬剤耐性の検討において、ホスカルネットナトリウムに対する耐性株は分離されなかったとの報告がある。また、ガンシクロビル耐性サイトメガロウイルス株がホスカルネットナトリウムに対して感受性を示したとの報告14)もあり、これまでの報告ではホスカルネットナトリウムがヒトで薬剤耐性及び交叉耐性を生じにくいことが示されている。
なお、サイトメガロウイルス網膜炎を発症した後天性免疫不全症候群患者でなされた薬剤耐性の検討において、ホスカルネットナトリウムに対する耐性株は分離されなかったとの報告がある。また、ガンシクロビル耐性サイトメガロウイルス株がホスカルネットナトリウムに対して感受性を示したとの報告14)もあり、これまでの報告ではホスカルネットナトリウムがヒトで薬剤耐性及び交叉耐性を生じにくいことが示されている。
19. 有効成分に関する理化学的知見
19.1. ホスカルネットナトリウム水和物
20. 取扱い上の注意
20.1 8℃以下では結晶が析出することがあるので、このような場合には微温湯で加温すること。
22. 包装
250mL(1バイアル)
23. 主要文献
- Taburet,A.M.,et al., Antimicrob.Agents Chemother., 36 (9), 1821-1824, (1992) »PubMed
- Castelli,F.,et al., Eur.J.Clin.Pharmacol., 52, 397-401, (1997) »PubMed
- Sjovall,J.,et al., Clin.Pharmacol.Ther., 44 (1), 65-73, (1988) »PubMed
- Raffi,F.,et al., Antimicrob.Agents Chemother., 37 (9), 1777-1780, (1993) »PubMed
- Sjovall,J.,et al., Antimicrob.Agents Chemother., 37 (9), 1023-1031, (1989)
- Aweeka,F.T.,et al., J.Acquir.Immune Defic.Syndr.Hum.Retrovirol., 20 (4), 350-357, (1999) »PubMed
- Aweeka,F.T.,et al., Antimicrob.Agents Chemother., 36 (8), 1773-1778, (1992) »PubMed
- Aweeka,F.T.,et al., Clin.Pharmacol.Ther., 57 (4), 403-412, (1995) »PubMed
- 木村 哲 他, 化学療法の領域, 18 (10), 77-90, (2002)
- Derse,D.,et al., J.Biol.Chem., 257 (17), 10251-10260, (1982) »PubMed
- Wahren,B.,et al., Intervirology, 14, 7-15, (1980) »PubMed
- Kern,E.R.,et al., Antimicrob.Agents Chemother., 14 (6), 817-823, (1978) »PubMed
- Akesson-Johansson A.,et al., Antimicrob.Agents Chemother., 34 (12), 2417-2419, (1990) »PubMed
- Drew,W.L.,et al., Abstract Th.B.306 Presented at the XI International Congress on AIDS, (1996), (Vancouver,Canada July 7-12)
24. 文献請求先及び問い合わせ先
文献請求先
クリニジェン株式会社
カスタマーセンター
〒103-0022
東京都中央区日本橋室町1-5-5
電話:0120-192-109(フリーダイアル)
製品情報問い合わせ先
クリニジェン株式会社
カスタマーセンター
〒103-0022
東京都中央区日本橋室町1-5-5
電話:0120-192-109(フリーダイアル)