医薬品情報
| 総称名 | キロサイド |
|---|---|
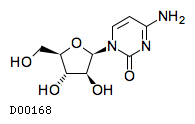
| 一般名 | シタラビン |
| 欧文一般名 | Cytarabine |
| 製剤名 | シタラビン注射液 |
| 薬効分類名 | 代謝拮抗性抗悪性腫瘍剤 |
| 薬効分類番号 | 4224 |
| ATCコード | L01BC01 |
| KEGG DRUG |
D00168
シタラビン
|
| KEGG DGROUP |
DG00686
シタラビン
DG02018
代謝拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年5月 改訂(用法変更、用量変更)(第4版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| キロサイド注20mg | Cylocide Injection | 日本新薬 | 4224401A1035 | 242円/管 | 劇薬, 処方箋医薬品注) |
| キロサイド注40mg | Cylocide Injection | 日本新薬 | 4224401A2031 | 480円/管 | 劇薬, 処方箋医薬品注) |
| キロサイド注60mg | Cylocide Injection | 日本新薬 | 4224401A3038 | 663円/管 | 劇薬, 処方箋医薬品注) |
| キロサイド注100mg | Cylocide Injection | 日本新薬 | 4224401A4034 | 1237円/管 | 劇薬, 処方箋医薬品注) |
| キロサイド注200mg | Cylocide Injection | 日本新薬 | 4224401A5030 | 1872円/管 | 劇薬, 処方箋医薬品注) |
1. 警告
本剤は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与すること。また、本剤による治療開始に先立ち、患者又はその家族に有効性及び危険性を十分に説明し、同意を得てから投与を開始すること。
2. 禁忌
次の患者には投与しないこと
本剤に対する重篤な過敏症の既往歴のある患者
4. 効能または効果
○急性白血病(赤白血病、慢性骨髄性白血病の急性転化例を含む)。
○消化器癌(胃癌、膵癌、肝癌、結腸癌等)、肺癌、乳癌、女性性器癌(子宮癌等)等。ただし他の抗腫瘍剤(フルオロウラシル、マイトマイシンC、シクロホスファミド水和物、メトトレキサート、ビンクリスチン硫酸塩、ビンブラスチン硫酸塩等)と併用する場合に限る。
○膀胱腫瘍
6. 用法及び用量
<急性白血病>
(1)寛解導入
急性白血病の寛解導入には、シタラビンとして通常1日小児0.6〜2.3mg/kg、成人0.8〜1.6mg/kgを250〜500mLの5%ブドウ糖液あるいは生理食塩液に混合して、点滴で静脈内投与するか、又は20mLの20%ブドウ糖液あるいは生理食塩液に混合して、ワンショットで静脈内投与する。通常2〜3週間連続投与を行う。
(2)維持療法
寛解が得られた場合は、維持療法として上記用量を1週1回そのまま皮下、筋肉内投与するか、あるいは上記用法に従い静脈内投与する。
(3)シタラビン少量療法
通常、成人にはシタラビンとして以下の用量を10〜14日間皮下又は静脈内投与する。
・1回10〜20mgを1日2回
・1回20mg/m2を1日1回
(4)シタラビン標準量療法
他の抗悪性腫瘍剤との併用において、通常、成人及び小児には、シタラビンとして1日100〜200mg/m2を5〜7日間点滴で静脈内投与する。
(5)髄腔内化学療法
通常、成人にはシタラビンとして1回25〜40mgを1週間に1〜2回髄腔内に投与する。小児に投与する場合には、下記を参考に年齢・体格等に応じて投与量を調節する。
なお、併用する他の抗腫瘍剤及び患者の状態により投与間隔は適宜延長すること。髄液に異常所見を認める場合は、正常化するまで投与を継続すること。
なお、併用する他の抗腫瘍剤及び患者の状態により投与間隔は適宜延長すること。髄液に異常所見を認める場合は、正常化するまで投与を継続すること。
| 1歳 | 2歳 | 3歳以上 |
| 15〜20mg | 20〜30mg | 25〜40mg |
年齢、症状により適宜増減する。
併用する薬剤の組合せ、併用量等は医師の判断による。
併用する薬剤の組合せ、併用量等は医師の判断による。
<消化器癌、肺癌、乳癌、女性性器癌等>
(1)静脈内注射
消化器癌、肺癌、乳癌、女性性器癌等に他の抗腫瘍剤(フルオロウラシル、マイトマイシンC、シクロホスファミド水和物、メトトレキサート、ビンクリスチン硫酸塩等)と併用するときは、シタラビンとして通常1回0.2〜0.8mg/kgを1週間に1〜2回点滴で静脈内投与するか、又はワンショットで静脈内投与する。
(2)局所動脈内注射
局所動脈内注入の場合は、シタラビンとして通常1日0.2〜0.4mg/kgを他の抗腫瘍剤(フルオロウラシル、シクロホスファミド水和物、ビンクリスチン硫酸塩、ビンブラスチン硫酸塩等)と併用して持続注入ポンプで投与する。
年齢、症状により適宜増減する。
併用する薬剤の組合せ、併用量等は医師の判断による。
併用する薬剤の組合せ、併用量等は医師の判断による。
<膀胱腫瘍>
膀胱腫瘍に単独膀胱内注入を行う場合は、シタラビンとして通常200〜400mgを、また、他の抗腫瘍剤と併用し、膀胱内注入を行う場合は、シタラビンとして通常100〜300mgを10〜40mLの生理食塩液又は注射用蒸留水に混合して1日1回又は週2〜3回膀胱内に注入する。
年齢、症状により適宜増減する。
併用する薬剤の組合せ、併用量等は医師の判断による。
併用する薬剤の組合せ、併用量等は医師の判断による。
7. 用法及び用量に関連する注意
<急性白血病>
シタラビン標準量療法又は髄腔内化学療法に対して本剤を使用する際には、国内外の最新のガイドライン等を参考にすること。
8. 重要な基本的注意
8.1 骨髄機能抑制等の重篤な副作用が起こることがあるので、頻回に臨床検査(血液検査、肝機能・腎機能検査等)を行うなど、患者の状態を十分に観察すること。また、使用が長期間にわたると副作用が強くあらわれ、遷延性に推移することがあるので、投与は慎重に行うこと。[9.1.1、11.1.1参照]
8.2 感染症・出血傾向の発現又は増悪に十分注意すること。[9.1.2参照]
8.3 本剤に特有な副作用として眼症状、皮膚症状が知られている。眼症状は結膜炎、眼痛、羞明、眼脂、結膜充血、角膜潰瘍等が発現する。これらの症状は副腎皮質ホルモン点眼剤により予防及び軽減することができる。皮膚症状は四肢末端に発疹、発赤、紅斑(しばしば高度の痛みを伴う)等が発現する。これらの症状は副腎皮質ホルモン剤により軽減することができる。[11.1.7参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
副作用が強くあらわれるおそれがある。
9.3 肝機能障害患者
副作用が強くあらわれるおそれがある。
9.4 生殖能を有する者
9.4.1 妊娠可能な女性に対しては、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.4.2 パートナーが妊娠する可能性のある男性に対しては、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[15.2参照]
9.4.3 小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。催奇形性を疑う症例報告があり、また、動物実験(マウス、ラット)で催奇形作用が報告されている。[9.4.1参照]
9.6 授乳婦
授乳しないことが望ましい。本剤が乳汁に移行する可能性があり、乳児が乳汁を介して本剤を摂取した場合、乳児に重篤な副作用が発現するおそれがある。[15.2参照]
9.7 小児等
副作用の発現に特に注意すること。髄腔内化学療法の場合、低出生体重児、新生児又は乳児(1歳未満)に対する臨床試験は実施していない。
9.8 高齢者
用量及び投与間隔に留意するなど患者の状況を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| 他の抗腫瘍剤 放射線照射 | 骨髄機能抑制等の副作用が増強することがあるので、併用療法を行う場合には患者の状態を観察しながら、減量するなど慎重に行うこと。 | 骨髄機能抑制等の相加・相乗作用による。 |
| 他剤併用療法 フルオロウラシル マイトマイシンC 副腎皮質ホルモン等 | 副作用の項に記載したもの以外に、静脈炎、脱毛があらわれることがある。 | |
| フルシトシン | 骨髄機能抑制の副作用が増強することがあるので、患者の状態を観察しながら、減量するなど慎重に投与すること。 | 骨髄機能抑制の相加・相乗作用による。 |
| フルシトシン | フルシトシンの効果を減弱させるとの報告がある。 | フルシトシンの血中濃度の低下による。 |
| フルダラビン | 骨髄機能抑制等の副作用が増強するおそれがある。 | in vivo試験及びin vitro試験において、シタラビンの活性代謝物であるAra-CTPの細胞内濃度の上昇が認められている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄機能抑制に伴う血液障害
11.1.2 ショック(頻度不明)
呼吸困難、全身潮紅、血管浮腫、蕁麻疹等のアナフィラキシーを伴うことがある。異常が認められた場合は投与を中止し、血圧の維持、体液の補充管理、気道の確保等の適切な処置を行うこと。
11.1.3 消化管障害(頻度不明)
消化管潰瘍、出血、好中球減少性腸炎等の消化管障害があらわれたとの報告がある。
11.1.4 急性呼吸促迫症候群、間質性肺炎(いずれも頻度不明)
11.1.5 急性心膜炎、心のう液貯留(いずれも頻度不明)
11.1.6 中枢神経系障害(頻度不明)
脳症(白質脳症を含む)、麻痺、痙攣、小脳失調、意識障害(意識消失を含む)等の中枢神経系障害があらわれることがある。
11.1.7 シタラビン症候群(頻度不明)
シタラビン症候群として発熱、筋肉痛、骨痛、ときに斑状丘疹性皮疹、胸痛、結膜炎及び倦怠感があらわれることがある。この症候群は通常薬剤投与後6〜12時間で発現する。なお、このような症状があらわれた場合には副腎皮質ホルモン剤の投与等、適切な処置を行うこと。[8.3参照]
注)発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 10〜20%未満 | 5〜10%未満 | 5%未満 | 頻度不明 | |
| 皮膚 | 発疹 | 脱毛(症)、有痛性紅斑 | ||
| 消化器 | 悪心・嘔吐、食欲不振 | 腹痛・下痢 | 口内炎 | |
| 精神神経系 | 倦怠感、頭痛 | |||
| 肝臓 | 肝障害 | |||
| 腎臓 | 腎機能異常 | |||
| 泌尿器 | 膀胱内注入療法の場合、頻尿、排尿痛、膀胱炎、血尿等の膀胱刺激症状 | |||
| その他 | 発熱 | 結膜炎、血栓性静脈炎 |
14. 適用上の注意
14.1 薬剤調製時の注意
本剤は細胞毒性を有するため、調製時には手袋を着用することが望ましい。皮膚に薬液が付着した場合は、直ちに多量の流水でよく洗い流すこと。
14.2 皮下・筋肉内投与時の注意
14.2.1 本剤の皮下・筋肉内投与後、神経麻痺又は硬結等を来すことがあるので、下記のことに注意すること。なお、乳児、小児、高齢者、衰弱者においては特に注意すること。
・注射部位については、神経走行部位(特に橈骨神経、尺骨神経、坐骨神経等)を避けて慎重に投与すること。
・繰り返し注射する場合には、同一注射部位を避けること。なお、乳児・小児においては連用しないことが望ましい。
・注射針刺入時、激痛を訴えたり、血液の逆流をみた場合は、直ちに針を抜き、部位を変えて注射すること。
14.3 膀胱内注入時の注意
14.3.1 カテーテルで十分に導尿し、膀胱内を空にすること。
14.3.2 単独注入の場合はシタラビンとして200〜400mgを、また、他の抗腫瘍剤との併用注入の場合は100〜300mgを10〜40mLの生理食塩液又は注射用蒸留水で5〜20mg/mLになるよう混合すること。
14.3.3 この液を前記のカテーテルより膀胱内に注入し、1〜2時間排尿を我慢させること。
15. その他の注意
15.1 臨床使用に基づく情報
本剤と他の抗腫瘍剤を併用した患者に、白血病、肺腺癌等の二次性悪性腫瘍が発生したとの報告がある。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
3H-シタラビン67〜3000mg/m2注)を癌患者に単回静脈内注射した場合、血漿中のシタラビン濃度は二相性を示し、第一相10〜20分、第二相2〜3時間の半減期で消失した3)(外国人データ)。
16.1.2 持続投与
シタラビン20mg/m2/日を非定型性白血病患者3例に14日間持続点滴静脈内注射した場合の血漿中濃度推移を示す4)(外国人データ)。
16.2 吸収
ウサギ膀胱内注入時シタラビンは安定であり、膀胱粘膜からの吸収率は0.2%であった5)。
16.4 代謝
シタラビン(Ara-C)を癌患者に静脈内注射あるいは持続点滴静脈内注射すると90%以上が肝臓、血液中等でuracil arabinoside(Ara-U)に代謝される3)(外国人データ)。
16.5 排泄
大部分が24時間以内に尿中に排泄される3)(外国人データ)。
| 投与経路 | 投与量(mg/m2) | 患者数 | 24時間累積尿中排泄(%、平均値) | ||
| 合計 | Ara-C | Ara-U | |||
| 静脈内注射 | 47〜3000注) | 8 | 78.0 | 7.1 | 70.9 |
| 持続点滴静脈内注射 | 100〜400注) | 4 | 83.8 | 7.8 | 76.0 |
注)本剤の承認された1回用量は5.9〜200mg/m2である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<急性白血病>
17.1.1 国内臨床試験
<消化器癌、肺癌、乳癌、女性性器癌等>
17.1.2 国内臨床試験
<膀胱腫瘍>
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍作用
18.3 併用効果
シタラビンはマイトマイシンC、フルオロウラシル、メルカプトプリン水和物、ダウノルビシン塩酸塩、ドキソルビシン塩酸塩と相乗的、メトトレキサート、ビンクリスチン硫酸塩、ビンブラスチン硫酸塩、シクロホスファミド水和物と相加的抗腫瘍効果を示す25)29)。更にマイトマイシンC、フルオロウラシルとの3剤併用MFC29)30)及びダウノルビシン塩酸塩、メルカプトプリン水和物との3剤併用DPC30)31)は相乗効果を示す(L1210マウス白血病)。また、シタラビンはドキソルビシン塩酸塩と併用することにより、ラット膀胱腫瘍株BC-50に対して抗腫瘍効果を増強する32)。株化ヒト結腸癌細胞を用いた実験で、シスプラチンと相乗効果のあることも認められている33)。
19. 有効成分に関する理化学的知見
19.1. シタラビン
22. 包装
<キロサイド注20mg>
10管、50管
<キロサイド注40mg>
10管
<キロサイド注60mg>
10管
<キロサイド注100mg>
10管
<キロサイド注200mg>
10管
23. 主要文献
- Benedict WF,et al., Science., 171 (3972), 680-2, (1971) »PubMed »DOI
- Kouri RE,et al., Cancer Res., 35 (9), 2413-9, (1975) »PubMed
- Ho DHW,et al., Clin Pharmacol Ther., 12 (6), 944-54, (1971) »PubMed »DOI
- Spriggs D,et al., Blood., 65 (5), 1087-9, (1985) »PubMed
- 小野泰道ほか, 基礎と臨床, 10 (12), 3268-72, (1976)
- 天木一太ほか, 最新医学, 25 (9), 1928-37, (1970)
- 喜多島康一ほか, 新薬と臨床, 18 (12), 1646-52, (1969)
- 壇 和夫ほか, 臨床血液, 25 (10), 1600-5, (1884)
- 田嶌政郎ほか, 日本臨床, 44 (2), 388-94, (1986) »PubMed
- 椿 和央ほか, 癌と化学療法, 13 (4), 996-1003, (1986)
- 社内資料:急性白血病に対する臨床成績(承認年月日:1971年3月2日、申請資料概要)
- 中尾 功ほか, 癌の臨床, 18 (2), 138-43, (1972) »PubMed
- 太田和雄ほか, 日本癌治療学会誌, 6 (2), 267-76, (1971)
- 須賀昭二ほか, 癌の臨床, 18 (3), 209-13, (1972) »PubMed
- 社内資料:固形癌に対する臨床成績(承認年月日:1973年4月24日、一変申請資料概要)
- 吉田英機ほか, 泌尿紀要, 23 (1), 51-7, (1977)
- 今村一男ほか, 癌と化学療法, 7 (7), 1244-9, (1980)
- 加藤廣海ほか, 泌尿紀要, 24 (7), 595-608, (1978)
- 佐藤 仁ほか, 癌と化学療法, 7 (7), 1250-5, (1980)
- 社内資料:膀胱腫瘍に対する臨床試験(承認年月日:1984年2月15日、一変申請資料概要)
- 徳永 毅ほか, 泌尿紀要, 26 (2), 229-38, (1980)
- Kimball AP,et al., Proc Soc Exp Biol Med., 127 (2), 429-32, (1968) »PubMed
- Smets LA,et al., Cancer Res., 45 (7), 3113-7, (1985) »PubMed
- Chomienne C,et al., Semin.Oncol., 12 (2 Suppl 3), 60-4, (1985) »PubMed
- 太田和雄ほか, 薬物療法, 2 (9), 1437-43, (1969)
- Evans JS,et al., Proc Soc Exp Biol Med., 106, 350-3, (1961) »PubMed
- 社内資料:ラット腹水肝癌に及ぼす影響(承認年月日:1971年3月2日、申請資料概要)
- 田崎 寛ほか, Chemotherapy., 24 (8), 1597-601, (1976) »DOI
- 星野 章ほか, 日化学療会誌, 18 (4), 384-5, (1970)
- 星野 章, 最新医学, 28 (5), 844-9, (1973)
- 星野 章ほか, 日血会誌, 33 (6/7), 781-2, (1970)
- 宇山 健ほか, 西日泌尿, 39 (6), 916-24, (1977)
- Bergerat JP,et al., Cancer Res., 41 (1), 25-30, (1981) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル 0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
製品情報問い合わせ先
日本新薬株式会社
製品情報担当
〒601-8550
京都市南区吉祥院西ノ庄門口町14
電話:フリーダイヤル 0120-321-372
075-321-9064
075-321-9064
FAX:075-321-9061
26. 製造販売業者等
26.1 製造販売元
日本新薬株式会社
京都市南区吉祥院西ノ庄門口町14