医薬品情報
| 総称名 | ダントリウム |
|---|---|
| 一般名 | ダントロレンナトリウム水和物 |
| 欧文一般名 | Dantrolene Sodium Hydrate |
| 製剤名 | 注射用ダントロレンナトリウム水和物 |
| 薬効分類名 | 悪性高熱症治療剤 悪性症候群治療剤 |
| 薬効分類番号 | 1229 |
| ATCコード | M03CA01 |
| KEGG DRUG |
D02274
ダントロレンナトリウム水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年11月 改訂(第1版)

|
4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ダントリウム静注用20mg | Dantrium 20mg for Intravenous Injection | オーファンパシフィック | 1229402D1039 | 9039円/瓶 | 処方箋医薬品注) |
4. 効能または効果
○麻酔時における悪性高熱症
6. 用法及び用量
<麻酔時における悪性高熱症>
通常、ダントロレンナトリウム水和物として、初回量1mg/kgを静脈内投与し、症状の改善が認められない場合には、1mg/kgずつ静脈内に追加投与する。
なお、症状により適宜増減できるが、投与総量は7mg/kgまでとする。
なお、症状により適宜増減できるが、投与総量は7mg/kgまでとする。
<悪性症候群>
通常、成人にはダントロレンナトリウム水和物として、初回量40mgを静脈内投与し、症状の改善が認められない場合には、20mgずつ追加投与する。年齢、症状により適宜増減するが、1日総投与量は200mgまでとする。通常7日以内の投与とする。
<溶液調製法>
通常、1バイアルに日局 注射用水60mLを加え、振り混ぜ、溶液が澄明になったことを確認の後、使用する。
7. 用法及び用量に関連する注意
<悪性症候群>
静脈内投与後、継続投与が必要でかつ経口投与が可能な場合には、ダントロレンナトリウム水和物カプセル剤を投与すること。
8. 重要な基本的注意
<効能共通>
8.1 投与開始後は肝機能検査(AST、ALT、アルカリフォスファターゼ、総ビリルビン等)を定期的に行うこと。
なお、救命を最優先とすることから、異常がみられた場合には治療上の有益性が危険性を上回ると判断される場合にのみ慎重に投与すること。
なお、救命を最優先とすることから、異常がみられた場合には治療上の有益性が危険性を上回ると判断される場合にのみ慎重に投与すること。
<悪性症候群>
8.2 過量にならないように注意すること。2日目40mg投与で過量のために呼吸不全を生じたとの報告がある。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 肺機能障害、特に閉塞性肺疾患の患者
本剤の筋弛緩作用により、症状が悪化するおそれがある。
9.1.2 心筋疾患による重篤な心機能障害の患者
本剤の筋弛緩作用により、症状が悪化するおそれがある。
9.1.3 筋無力症状のある患者
本剤の筋弛緩作用により、症状が悪化するおそれがある。
9.1.4 イレウスのある患者
本剤の筋弛緩作用により、症状が悪化するおそれがある。[11.1.3参照]
9.3 肝機能障害患者
肝障害を増悪させることがある。
9.4 生殖能を有する者
9.4.2 男性には、本剤投与中及び最終投与後3カ月間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。[15.2.2参照]
9.5 妊婦
9.6 授乳婦
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| カルシウム拮抗剤 ベラパミル等 | 高カリウム血症に伴う心室細動、循環虚脱等があらわれることがある。 | 高カリウム血症を来すと考えられる。 |
| 向精神薬 | 呼吸中枢抑制作用を増強する可能性がある。 | 薬理学的(呼吸中枢抑制作用)な相加作用による。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 呼吸不全(0.1〜5%未満)
呼吸不全が疑われた場合には臨床症状及び血液ガス等のデータを参考に、呼吸管理を実施しながら本剤を投与すること。[8.2参照]
11.1.2 ショック、アナフィラキシー(0.1〜5%未満)
顔面蒼白、血圧低下、呼吸困難等があらわれることがある。
11.1.3 イレウス(0.1〜5%未満)[9.1.4参照]
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | |||
| 肝臓 | 肝機能障害(AST上昇、ALT上昇、LDH上昇) | |||
| 血液 | 血小板減少 | |||
| 精神神経系 | 強直性痙攣、眠気、頭痛 | |||
| 消化器 | 食欲不振、悪心、嘔吐、消化管出血 | |||
| 循環器 | 静脈炎 | 血圧低下 | ||
| 呼吸器 | 胸水貯留 | |||
| その他 | 発熱、脱力感 | 悪寒 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤の溶解に際しては、日局 注射用水以外を使用しないこと。
14.1.2 溶解後の溶液を保存する場合は、光を避け、5℃から30℃の温度条件にて保存し、6時間以内に使用すること。
14.2 薬剤投与時の注意
14.2.1 本剤使用に際しては、混注を避け、単独投与すること。
14.2.2 本剤は、溶解時pHが高く(約9.5)、血管外に漏出した場合に壊死、腫脹、発赤等を起こすおそれがあるので、静脈内投与に際しては溶液が血管外の組織へ漏れないよう厳重に注意すること。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
健康成人6名にダントロレンナトリウム水和物25mg注)を静脈内投与したとき、血漿中未変化体濃度は投与15分値で約0.77μg/mLに達したのち漸減傾向を示し、半減期は6.08時間、AUCは7.09μg・h/mLであった2)。
16.4 代謝
健康成人6名にダントロレンナトリウム水和物25mg注)を静脈内投与したとき、投与後24時間までに尿中に排泄された未変化体は投与量の0.2%と少なく、主代謝物の5-ヒドロキシダントロレンは13.1%であり、投与後いずれの時間においてもダントロレンに比べて低値であった2)。
16.5 排泄
14C-ダントロレンナトリウム水和物25mg注)を静脈内投与したとき、放射能は尿中に投与量の51.6%(0〜72時間)、糞便中に32.9%(0〜120時間)が排泄された3)。
注)本剤の承認された用量は、麻酔時における悪性高熱症に対しては、通常、初回量1mg/kgを静脈内投与し、症状の改善が認められない場合には、1mg/kgずつ静脈内に追加投与する。なお、症状により適宜増減できるが、投与総量は7mg/kgまでとする。
悪性症候群に対しては、通常、成人には、初回量40mgを静脈内投与し、症状の改善が認められない場合には、20mgずつ追加投与する。年齢、症状により適宜増減するが、1日総投与量は200mgまでとする。通常7日以内の投与とする。
悪性症候群に対しては、通常、成人には、初回量40mgを静脈内投与し、症状の改善が認められない場合には、20mgずつ追加投与する。年齢、症状により適宜増減するが、1日総投与量は200mgまでとする。通常7日以内の投与とする。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
<麻酔時における悪性高熱症>
悪性高熱症患者23例についての臨床試験の概要は次のとおりであった。
有効率(有効以上)は82.6%(19例/23例)であり、やや有効以上は95.7%(22例/23例)で、無効例は1例のみであった。
本邦における悪性高熱症による死亡は、従来の治療では約50%(59例/118例:1980年10月31日までの全症例)に認められているのに対し、本剤使用例では8.7%(2例/23例)と明らかな低下が認められた。
本剤使用例23例の投与量は、最低0.71mg/kg、最高6.3mg/kg、平均2.32mg/kgであった。
<悪性症候群>
悪性症候群患者27例についての臨床試験の概要は次のとおりであった。
最終全般改善度における改善率(改善以上)は55.6%(やや改善以上:77.8%(21例/27例))であった4)。
18. 薬効薬理
18.1 作用機序
ダントロレンナトリウム水和物は骨格筋において筋小胞体からのカルシウムイオン遊離を抑制する。また、中枢神経系において細胞内カルシウムイオン濃度上昇を抑制し神経伝達物質の遊離亢進を抑制する。
18.2 筋弛緩作用
<麻酔時における悪性高熱症>
マウスのモルヒネによる挙尾反応を顕著に抑制し、協調運動には影響を与えず、自発運動を軽度に抑制した。
18.3 悪性高熱に関する作用
<麻酔時における悪性高熱症>
ハロタンによる悪性高熱症ブタ摘出骨格筋の収縮を抑制した5)。悪性高熱症の主な原因として、骨格筋細胞内に存在する筋小胞体からのカルシウムイオン遊離亢進が推定されている。
18.4 悪性症候群モデルにおける改善作用
18.5 細胞内カルシウム動態に対する作用
<悪性症候群>
18.5.1 カエルの骨格筋において、急速冷却による拘縮を抑制した8)。
18.5.4 ドパミン-セロトニン神経活性の不均衡を改善し、体温上昇及び筋硬直を抑制する可能性も推定されている。
悪性症候群の原因として、骨格筋における筋小胞体からのカルシウムイオン遊離亢進並びに中枢神経系における細胞内カルシウムイオン濃度上昇に伴うドパミン-セロトニン神経活性の不均衡が推定されている。
悪性症候群の原因として、骨格筋における筋小胞体からのカルシウムイオン遊離亢進並びに中枢神経系における細胞内カルシウムイオン濃度上昇に伴うドパミン-セロトニン神経活性の不均衡が推定されている。
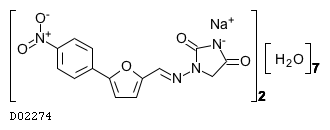
19. 有効成分に関する理化学的知見
19.1. ダントロレンナトリウム水和物
22. 包装
5バイアル
23. 主要文献
- 黒沢 敏 ほか, 基礎と臨床, 11, 3101-3120, (1977)
- 浅利 遥 ほか, 麻酔と蘇生, 20, 255-266, (1984)
- 社内資料:健康成人・薬物動態(昭和60年4月16日承認、申請資料概要ヘ.6)
- 山脇 成人 ほか, 基礎と臨床, 27, 1045-1066, (1993)
- 井田 昶 ほか, 基礎と臨床, 18, 2418-2422, (1984)
- 小山 司 ほか, 神経化学, 27, 308-309, (1988)
- 小澤 由紀子 ほか, 基礎と臨床, 28, 2349-2354, (1994)
- Homma,I.et al., Jpn.J.Physiol., 26, 53-61, (1976) »PubMed
- 林 輝男 ほか, 麻酔と蘇生, 29, 21-24, (1993)
- 加藤 匡宏 ほか, 麻酔と蘇生, 24, 301-307, (1988)
- 加藤 匡宏 ほか, 麻酔と蘇生, 24, 179-185, (1988)
- 山脇 成人 ほか, 麻酔と蘇生, 23, 159-163, (1987)
24. 文献請求先及び問い合わせ先
文献請求先
株式会社オーファンパシフィック
DIセンター
〒105-0023
東京都港区芝浦1-1-1
電話:0120-889-009 受付時間 9:00〜17:30(土・日・祝日・社休日を除く)
製品情報問い合わせ先
株式会社オーファンパシフィック
DIセンター
〒105-0023
東京都港区芝浦1-1-1
電話:0120-889-009 受付時間 9:00〜17:30(土・日・祝日・社休日を除く)
26. 製造販売業者等
26.1 製造販売元
株式会社オーファンパシフィック
〒105-0023
東京都港区芝浦1-1-1