医薬品情報
| 総称名 | ユナシン−Sキット |
|---|---|
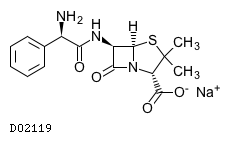
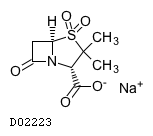
| 一般名 | アンピシリンナトリウム スルバクタムナトリウム |
| 欧文一般名 | Ampicillin Sodium Sulbactam Sodium |
| 薬効分類名 | β-ラクタマーゼ阻害剤配合抗生物質製剤 |
| 薬効分類番号 | 6139 |
| ATCコード | J01CA51 J01CR01 J01RA01 |
| KEGG DRUG |
D02065
アンピシリンナトリウム・スルバクタムナトリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ユナシン−Sキット静注用1.5g | UNASYN-S KIT for Intravenous Use 1.5g | ファイザー | 6139504G1028 | 943円/キット | 処方箋医薬品注) |
| ユナシン−Sキット静注用3g | UNASYN-S KIT for Intravenous Use 3g | ファイザー | 6139504G2024 | 1175円/キット | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 伝染性単核症の患者[アンピシリンの投与により発疹が高頻度に発現したとの報告がある。]
4. 効能または効果
6. 用法及び用量
<肺炎、肺膿瘍、腹膜炎の場合>
通常成人にはスルバクタムナトリウム・アンピシリンナトリウムとして、1日6g(力価)を2回に分け、用時添付の溶解液にて溶解し、静脈内に点滴注入する。なお、重症感染症の場合は必要に応じて適宜増量することができるが、1回3g(力価)1日4回(1日量として12g(力価))を上限とする。
<膀胱炎の場合>
通常成人にはスルバクタムナトリウム・アンピシリンナトリウムとして、1日3g(力価)を2回に分け、用時添付の溶解液にて溶解し、静脈内に点滴注入する。
<効能共通>
通常小児にはスルバクタムナトリウム・アンピシリンナトリウムとして、1日60〜150mg(力価)/kgを3〜4回に分け、用時添付の溶解液にて溶解し、静脈内に点滴注入する。
7. 用法及び用量に関連する注意
本剤の使用にあたっては、耐性菌の発現等を防ぐため、β-ラクタマーゼ産生菌、かつアンピシリン耐性菌を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8. 重要な基本的注意
8.1 本剤によるショック、アナフィラキシーの発生を確実に予知できる方法がないので、次の措置をとること。[11.1.1参照]
8.1.1 事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。
8.1.2 投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
8.1.3 投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に、投与開始直後は注意深く観察すること。
8.2 無顆粒球症、貧血(溶血性貧血を含む)、血小板減少等の重篤な血液障害があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.3参照]
8.3 急性腎障害、間質性腎炎等の重篤な腎障害があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.4参照]
8.4 肝機能障害があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.6参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 ペニシリン系抗生物質に対し過敏症の既往歴のある患者(ただし、本剤に対し過敏症の既往歴のある患者には投与しないこと)
治療上やむを得ないと判断される場合を除き、投与しない。
9.1.2 セフェム系抗生物質に対し過敏症の既往歴のある患者
9.1.3 本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー反応を起こしやすい体質を有する患者
9.1.4 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
観察を十分に行うこと。ビタミンK欠乏による出血傾向があらわれることがある。
9.1.5 心臓、循環器系機能障害のある患者
循環血液量を増やすことから心臓に負担をかけ、悪化するおそれがある。
9.1.6 ナトリウム摂取制限患者
本剤1.5g製剤及び3g製剤の上室(薬剤部分)にナトリウムがそれぞれ115mg(5mEq)及び230mg(10mEq)含まれていることに留意すること。
9.2 腎機能障害患者
9.2.1 高度の腎障害のある患者
(1)本剤の投与量及び投与間隔を調節する等、慎重に投与すること。[16.6.1参照]
(2)水分、ナトリウムの過剰投与に陥りやすく、悪化するおそれがある。
9.2.2 軽度又は中等度の腎障害のある患者
水分、ナトリウムの過剰投与に陥りやすく、悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。アンピシリンの大量(3,000mg/kg/日)投与でラットに催奇形性が報告されている。アンピシリン及びスルバクタムは胎盤を通過することが報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中へ移行することが報告されている1)。
9.7 小児等
9.7.1 低出生体重児及び新生児を対象とした臨床試験は実施していない。
9.7.2 1歳以下の乳児では慎重に投与すること。下痢・軟便の発現頻度が高い。
9.8 高齢者
次の点に注意し、用量並びに投与間隔に留意するなど患者の状態を観察しながら慎重に投与すること。
9.8.1 一般的に生理機能が低下していることが多く副作用が発現しやすい。
9.8.2 ビタミンK欠乏による出血傾向があらわれることがある。
10. 相互作用
10.2 併用注意
| アロプリノール | アンピシリンとの併用により、発疹の発現が増加するとの報告がある2)。 | 機序不明だが薬剤性の発疹がアロプリノールとアンピシリンを併用していた67例の入院患者のうち22.4%に認められ、アンピシリン単独服用例の1,257例では7.5%に認められた。またアンピシリンを併用しないアロプリノール服用患者283例のうち2.1%が薬剤性発疹を経験したという報告がある。 |
| 抗凝血薬 | ペニシリン注射液が血小板の凝集・凝固に影響を与え、出血傾向を増強するおそれがある。 | 抗凝血作用とペニシリン注射液の血小板凝集抑制作用により相加的に出血傾向が増強される可能性がある。 |
| 経口避妊薬 | アンピシリンとの併用により避妊効果が減弱したとの報告がある。 | 本剤は腸内細菌叢を変化させる可能性があり、それにより経口避妊薬の腸肝循環による再吸収を抑制すると考えられている。 |
| メトトレキサート | ペニシリンとの併用により、メトトレキサートのクリアランスが減少するおそれがある。 | メトトレキサートの尿細管分泌が阻害され、体内からの消失が遅延し、メトトレキサートの毒性が増強する可能性がある。 |
| プロベネシド | 併用により、本剤の血中濃度上昇、血中濃度半減期の延長、本剤の持つ毒性リスクの上昇のおそれがある。 | プロベネシドの尿細管分泌抑制作用により本剤の排泄が遅延するおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)[8.1参照]
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、急性汎発性発疹性膿疱症(頻度不明)
11.1.3 血液障害
無顆粒球症(頻度不明)、貧血(溶血性貧血を含む)(0.38%)、血小板減少(0.19%)等の重篤な血液障害があらわれることがある。[8.2参照]
11.1.4 急性腎障害(0.1%未満)、間質性腎炎(頻度不明)
急性腎障害、間質性腎炎等の重篤な腎障害があらわれることがある。[8.3参照]
11.1.5 出血性大腸炎(頻度不明)、偽膜性大腸炎(頻度不明)
出血性大腸炎、偽膜性大腸炎等の血便を伴う重篤な大腸炎があらわれることがあるので、腹痛、頻回の下痢があらわれた場合には直ちに投与を中止するなど適切な処置を行うこと。
11.1.6 肝機能障害(0.10%)[8.4参照]
11.1.7 間質性肺炎(0.1%未満)、好酸球性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、好酸球性肺炎があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.2 その他の副作用
| 1%以上 | 0.1〜1%未満 | 0.1%未満 | 頻度不明 | |
| 皮膚 | 発疹、そう痒感 | 蕁麻疹 | 多形紅斑 | |
| 血液 | 好酸球増多 | 白血球減少 | ||
| 代謝及び栄養障害 | 低カリウム血症 | |||
| 肝臓 | AST上昇、ALT上昇 | Al-P上昇、LAP上昇、ビリルビン値上昇、γ-GTP上昇 | 黄疸 | |
| 消化器 | 下痢・軟便、悪心・嘔吐 | 腹部不快感 | 黒毛舌 | |
| 中枢神経 | 痙攣等の神経症状 | |||
| 菌交代 | 口内炎、カンジダ症 | |||
| 筋骨格系及び結合組織障害 | 関節痛 | |||
| その他 | 発熱 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等) | ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等) |
12. 臨床検査結果に及ぼす影響
12.1 本剤の投与により、ベネディクト試薬、あるいはフェーリング試薬による尿糖検査では偽陽性を呈することがあるので注意すること。
12.2 妊婦へのアンピシリン投与により、総結合型エストリオール、エストリオール−グルクロニド、結合型エストロン、エストラジオールの一時的な血清中濃度の減少を呈することがあるので注意すること。
13. 過量投与
13.1 症状
β-ラクタム系抗生物質製剤の脳脊髄液中濃度が高くなると、痙攣等を含む神経系の副作用を引き起こすことが考えられる。
13.2 処置
腎機能障害患者に過量投与された場合は血液透析を用いて体内から除去すること。
14. 適用上の注意
14.1 薬剤調製時の注意
本剤の使用にあたっては、完全に溶解したことを確認し、溶解後は速やかに使用すること。残液は決して使用しないこと。
14.2 薬剤投与時の注意
14.2.1 静脈内投与により、血管痛、血栓又は静脈炎を起こすことがあるので、注射部位、注射方法等に十分注意し、注射速度をできるだけ遅くすること。
14.2.2 配合変化としてアンピシリンとアミノグリコシド系抗生物質製剤(ジベカシン硫酸塩、アルベカシン硫酸塩等)を混合すると力価が低下したとの報告がある。
併用に際しては投与部位を変える及び1時間以上投与間隔をあけるなど投与方法に注意すること。
併用に際しては投与部位を変える及び1時間以上投与間隔をあけるなど投与方法に注意すること。
16. 薬物動態
16.1 血中濃度
本剤での臨床試験は実施していないが、本剤はユナシン-S静注用注)と有効成分が同一であるため、ユナシン-S静注用注)の成績について以下に示す。
16.1.1 成人
健常成人6名に0.75g(力価)又は1.5g(力価)をクロスオーバー法により静注した時のスルバクタム及びアンピシリンの血清中濃度の推移(平均値)は下図のとおりであり、静注後5分で、0.75g(力価)投与時スルバクタム18.7μg/mL、アンピシリン39.2μg/mL、1.5g(力価)投与時スルバクタム40.0μg/mL、アンピシリン78.8μg/mLであった。
スルバクタムとアンピシリンの濃度半減期(t1/2)はいずれも約1時間であり、両薬物の血中動態は良く近似していた3)。
スルバクタムとアンピシリンの濃度半減期(t1/2)はいずれも約1時間であり、両薬物の血中動態は良く近似していた3)。
16.1.2 小児
小児患者16例に30mg(力価)/kgを静注した時の血清中濃度推移は下図のとおりであり、スルバクタム及びアンピシリンのt1/2は約1時間と、小児の場合の血中動態も成人の場合とほぼ同様であった4)。
成人に静注時の血清中濃度
小児患者に静注時の血清中濃度
16.3 分布
本剤での臨床試験は実施していないが、本剤はユナシン-S静注用注)と有効成分が同一であるため、ユナシン-S静注用注)の成績について以下に示す。
16.3.1 成人患者3例に1.5g(力価)を静注した時のスルバクタム及びアンピシリンの胆汁中濃度は、静注後1時間でそれぞれ平均3.6μg/mL、19.8μg/mLであった5)。
16.5 排泄
本剤での臨床試験は実施していないが、本剤はユナシン-S静注用注)と有効成分が同一であるため、ユナシン-S静注用注)の成績について以下に示す。
16.6 特定の背景を有する患者
本剤での臨床試験は実施していないが、本剤はユナシン-S静注用注)と有効成分が同一であるため、ユナシン-S静注用注)の成績について以下に示す。
16.6.1 腎機能障害患者
(2)日本人市中肺炎患者47例(クレアチニンクリアランス(CLcr):34.6〜176mL/min)から得られた222点の血漿中スルバクタム及びアンピシリン濃度データを用いて、母集団薬物動態解析を行った。その結果、腎機能(CLcr)はスルバクタム及びアンピシリンのクリアランスの有意な変動因子であり、腎機能(CLcr)の低下によりスルバクタム及びアンピシリンのt1/2は延長し、濃度−時間曲線下面積(AUC)が上昇する傾向が認められた。腎機能が異なる患者に対して下表のとおり投与間隔を調整したとき、いずれの腎機能障害患者においても同様の最高濃度(Cmax)及びAUCの推定値が得られた14)。[9.2.1参照]
| CLcr(mL/min) | 投与間隔 | スルバクタム | アンピシリン | ||||
| Cmax(μg/mL) | AUC0-48(μg・h/mL) | t1/2(h) | Cmax(μg/mL) | AUC0-48(μg・h/mL) | t1/2(h) | ||
| 90〜60 | 1日4回、6時間ごと | 68.6〜74.2 | 650〜861 | 1.09〜1.33 | 139〜151 | 1260〜1670 | 1.20〜1.42 |
| 59〜30 | 1日4回、6時間ごと | 74.4〜85.1 | 872〜1380 | 1.34〜1.96 | 151〜173 | 1690〜2690 | 1.43〜2.02 |
| 59〜30 | 1日3回、8時間ごと | 73.3〜81.5 | 655〜1050 | 1.34〜1.96 | 149〜166 | 1270〜2030 | 1.43〜2.02 |
| 29〜15 | 1日2回、12時間ごと | 79.5〜86.4 | 718〜1120 | 2.00〜3.03 | 162〜176 | 1400〜2190 | 2.06〜3.06 |
| 14〜5 | 1日1回、24時間ごと | 83.1〜90.7 | 599〜1190 | 3.16〜6.28 | 170〜185 | 1160〜2310 | 3.20〜6.27 |
注)ユナシン-S静注用は承認整理済である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
本剤での臨床試験は実施していないが、本剤はユナシン-S静注用注)と有効成分が同一であるため、ユナシン-S静注用注)の成績について以下に示す。
17.1.1 国内臨床試験
一般臨床試験及び比較臨床試験が実施され、疾患別臨床効果は下記のとおりである。
これらの症例のうちブドウ球菌属、大腸菌、プロテウス属、インフルエンザ菌によるβ-ラクタマーゼ高度産生菌検出症例における臨床効果は、肺炎・肺化膿症96.7%(29/30)、腹膜炎88.9%(8/9)、膀胱炎89.2%(33/37)であった。
また、12g/日投与時の肺炎に対する有効率は94.6%(35/37)であった。検出菌別の臨床効果は、肺炎球菌で92.3%(12/13)、モラクセラ(ブランハメラ)・カタラーリスで87.5%(7/8)であった4)15)16)。
これらの症例のうちブドウ球菌属、大腸菌、プロテウス属、インフルエンザ菌によるβ-ラクタマーゼ高度産生菌検出症例における臨床効果は、肺炎・肺化膿症96.7%(29/30)、腹膜炎88.9%(8/9)、膀胱炎89.2%(33/37)であった。
また、12g/日投与時の肺炎に対する有効率は94.6%(35/37)であった。検出菌別の臨床効果は、肺炎球菌で92.3%(12/13)、モラクセラ(ブランハメラ)・カタラーリスで87.5%(7/8)であった4)15)16)。
| 疾患名 | 成人 | 小児 | ||
| 3g/日 | 4.5〜6g/日 | 12g/日 | 60〜150mg/kg/日 | |
| 肺炎・肺化膿症 | 162/196(82.7%) | 71/84(84.5%) | 35/37a)(94.6%) | 212/215(98.6%) |
| 膀胱炎 | 141/200(70.5%) | − | − | 2/2(100%) |
| 腹膜炎 | 30/36(83.3%) | 2/2(100%) | − | − |
細菌学的検討が行われた1,289株の菌消失率は84.1%(1,084/1,289)でこれを適応菌種に限ると86.9%(423/487)a)の菌消失率、さらにβ-ラクタマーゼ高度産生株に限ると84.2%(123/146)とほぼ同じ消失率であった。
また、12g/日投与時において細菌学的検討が行われた33株の菌消失率は84.8%(28/33)で、適応菌種に限ると82.8%(24/29)b)、さらにβ-ラクタマーゼ高度産生株に限ると87.5%(7/8)の菌消失率であった。
すなわち、β-ラクタマーゼ高度産生株に対しても低度産生株や非産生株に対するのと同程度の効果を発揮することが示された4)15)16)。
また、12g/日投与時において細菌学的検討が行われた33株の菌消失率は84.8%(28/33)で、適応菌種に限ると82.8%(24/29)b)、さらにβ-ラクタマーゼ高度産生株に限ると87.5%(7/8)の菌消失率であった。
すなわち、β-ラクタマーゼ高度産生株に対しても低度産生株や非産生株に対するのと同程度の効果を発揮することが示された4)15)16)。
| 3〜6g/日 | 12g/日 | |
| 全分離菌 | 1,084/1,289(84.1%) | 28/33(84.8%) |
| 適応菌種 | 423/487(86.9%)a) | 24/29(82.8%)b) |
| β-ラクタマーゼ高度産生株 | 123/146(84.2%) | 7/8(87.5%) |
a:ブドウ球菌属、大腸菌、プロテウス属、インフルエンザ菌
b:aに加えて肺炎球菌、モラクセラ(ブランハメラ)・カタラーリス
注)ユナシン-S静注用は承認整理済である。
18. 薬効薬理
18.1 作用機序
18.2 抗菌作用
19. 有効成分に関する理化学的知見
19.1. アンピシリンナトリウム
19.2. スルバクタムナトリウム
20. 取扱い上の注意
20.1 製品の品質を保持するため、本品を包んでいる外袋は使用時まで開封しないこと。
20.2 次の場合には使用しないこと。
20.2.1 外袋が破損しているときや溶解液が漏出しているとき。
20.2.2 隔壁の開通前に薬剤が溶解しているとき。
20.2.3 薬剤が変色しているときや溶解液が着色しているとき。
20.3 容器の液目盛りはおよその目安として使用すること。
22. 包装
<ユナシン-Sキット静注用1.5g>
10キット
<ユナシン-Sキット静注用3g>
10キット
23. 主要文献
- Matsuda,S., Biol Res Pregnancy Perinatol., 5 (2), 57-60, (1984) »PubMed
- N Engl J Med., 286 (10), 505-507, (1972) »PubMed
- 柴 孝也ほか, Chemotherapy(Tokyo)., 36 (Suppl.8), 149-159, (1988)
- Jpn J Antibiot., 42 (3), (1989), (SULBACTAM/AMPICILLIN特集Iを中心に集計)
- 由良 二郎ほか, Chemotherapy(Tokyo)., 36 (Suppl.8), 324-333, (1988)
- 林 泉ほか, Chemotherapy(Tokyo)., 36 (Suppl.8), 120-125, (1988)
- 菊山 成博ほか, Chemotherapy(Tokyo)., 36 (Suppl.8), 317-323, (1988)
- 張南 薫ほか, Chemotherapy(Tokyo)., 36 (Suppl.8), 466-489, (1988)
- 関口 隆憲ほか, Jpn J Antibiot., 42 (3), 733-742, (1989) »PubMed
- 佐藤 吉壮ほか, Jpn J Antibiot., 42 (3), 579-593, (1989) »PubMed
- 下岡 釿雄ほか, Chemotherapy(Tokyo)., 36 (Suppl.8), 66-80, (1988)
- Blum,R.A.et al., Antimicrob Agents Chemother., 33 (9), 1470-1476, (1989) »PubMed
- Wright,N.et al., J Antimicrob Chemother., 11 (6), 583-587, (1983) »PubMed
- 社内資料:市中肺炎患者における母集団薬物動態(2012年8月10日承認、CTD2.7.2.3.5)
- Chemotherapy(Tokyo)., 36 (Suppl.8), (1988), (SULBACTAM・AMPICILLIN論文特集号を集計)
- 社内資料:市中肺炎に対する注射用スルバクタムナトリウム・アンピシリンナトリウム高用量投与の多施設共同、非盲検、非対照試験(2012年8月10日承認、CTD2.7.3A、2.7.6)
- 横田 健ほか, Chemotherapy(Tokyo)., 32 (Suppl.4), 11-19, (1984)
- 横田 健ほか, Chemotherapy(Tokyo)., 33 (Suppl.2), 10-22, (1985)
- 横田 健ほか, Chemotherapy(Tokyo)., 36 (Suppl.8), 1-12, (1988)
- 五島 瑳智子ほか, Chemotherapy(Tokyo)., 36 (Suppl.8), 13-33, (1988)
- 川崎 賢二ほか, Chemotherapy(Tokyo)., 36 (Suppl.8), 34-57, (1988)
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
製品情報問い合わせ先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7
その他の説明
溶解操作方法
(1)使用直前に外袋を開封する。
(2)本キットを展開し、アルミカバーを剥がす。
(3)溶解液部分を手で押して隔壁を開通させ、更に溶解液部分を繰り返し押すことで薬剤を完全に溶解させる。
(4)溶解完了を確認し、輸液セットを装着する。このとき針を真っ直ぐ刺す。