医薬品情報
| 総称名 | エリスロマイシン |
|---|---|
| 一般名 | エリスロマイシン |
| 欧文一般名 | Erythromycin |
| 薬効分類名 | マクロライド系抗生物質製剤 |
| 薬効分類番号 | 6141 |
| ATCコード | D10AF02 J01FA01 S01AA17 |
| KEGG DRUG |
D00140
エリスロマイシン
|
| KEGG DGROUP |
DG00436
エリスロマイシン
DG01551
マクロライド系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エリスロマイシン錠200mg「サワイ」 | ERYTHROMYCIN Tablets[SAWAI] | 沢井製薬 | 6141002F2078 | 19.3円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミンメシル酸塩、ピモジド、ロミタピドメシル酸塩、クリンダマイシン(注射剤、経口剤)、リンコマイシン塩酸塩水和物を投与中の患者[10.1参照]
4. 効能または効果
<適応菌種>
<適応症>
5. 効能または効果に関連する注意
<咽頭・喉頭炎、扁桃炎(扁桃周囲炎を含む)、急性気管支炎、感染性腸炎、中耳炎、副鼻腔炎>
「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
6. 用法及び用量
通常、成人にはエリスロマイシンとして1日800〜1200mg(力価)を4〜6回に分割経口投与する。
小児には1日体重1kgあたり25〜50mg(力価)を4〜6回に分割経口投与する。
なお、年齢、症状により適宜増減する。ただし、小児用量は成人量を上限とする。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.2 急性腎障害(急性間質性腎炎)があらわれることがあるので、定期的に検査を行うこと。[11.1.5参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心疾患のある患者
QT延長、心室頻拍(Torsade de pointesを含む)を起こすことがある。[11.1.2参照]
9.3 肝機能障害患者
血中濃度が上昇するおそれがある。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中へ移行することが報告されている。
9.7 小児等
嘔吐等の症状に注意すること。新生児、乳児で、肥厚性幽門狭窄があらわれたとの報告がある。
9.8 高齢者
用量に留意するなど慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
相互作用序文
本剤はCYP3Aで代謝される。また、本剤はCYP3A、P-糖蛋白質を阻害する。
薬物代謝酵素用語
CYP3A
薬物代謝酵素用語
P-糖蛋白質
10.1 併用禁忌
| エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン (クリアミン) ジヒドロエルゴタミンメシル酸塩 [2.2参照] | 四肢の虚血、血管攣縮等が報告されている。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| ピモジド [2.2参照] | QT延長、心室性不整脈(Torsade de pointesを含む)等が発現するおそれがある。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| ロミタピドメシル酸塩 (ジャクスタピッド) [2.2参照] | ロミタピドメシル酸塩の血中濃度が著しく上昇するおそれがある。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| クリンダマイシン(注射剤、経口剤) (ダラシンS注射液、ダラシンカプセル) リンコマイシン塩酸塩水和物 (リンコシン) [2.2参照] | 併用してもこれらの薬剤の効果があらわれないと考えられる。 | 本剤の細菌のリボゾーム50S Subunitへの親和性がこれらの薬剤より高いと考えられる。 |
10.2 併用注意
| ジソピラミド キニジン硫酸塩水和物 | QT延長、心室性不整脈(Torsade de pointesを含む)等が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| テオフィリン アミノフィリン水和物 | 悪心・嘔吐、不整脈、痙攣等が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| シクロスポリン タクロリムス水和物 | 腎障害等が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| ワルファリンカリウム | 出血傾向、プロトロンビン時間延長等が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| イリノテカン塩酸塩水和物 | 骨髄機能抑制、下痢等の副作用を増強するおそれがあるため、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| ビンカアルカロイド ビンブラスチン硫酸塩 ビノレルビン酒石酸塩等 | 好中球減少、筋肉痛等が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| バルプロ酸ナトリウム | 傾眠、運動失調等が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| フェロジピン | 降圧作用の増強が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| ベラパミル塩酸塩 | 血圧低下、徐脈性不整脈、乳酸アシドーシス等が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| ミダゾラム トリアゾラム | 鎮静作用の増強が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| カルバマゼピン | めまい、運動失調等が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| コルヒチン | 下痢、腹痛、発熱、筋肉痛、汎血球減少、呼吸困難等が報告されているので、減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| シンバスタチン アトルバスタチンカルシウム水和物 | シンバスタチン、アトルバスタチンカルシウム水和物との併用により、筋肉痛、脱力感、CK上昇、血中および尿中ミオグロビン上昇を特徴とし、急激な腎機能悪化を伴う横紋筋融解症があらわれたとの報告がある。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| ピタバスタチンカルシウム水和物 | シンバスタチン、アトルバスタチンカルシウム水和物との併用により、筋肉痛、脱力感、CK上昇、血中および尿中ミオグロビン上昇を特徴とし、急激な腎機能悪化を伴う横紋筋融解症があらわれたとの報告がある。 | 本剤がピタバスタチンの肝臓への取り込みを阻害するためと考えられる。 |
| ブロモクリプチンメシル酸塩 ドセタキセル水和物 パクリタキセル セレギリン塩酸塩 シルデナフィルクエン酸塩 バルデナフィル塩酸塩水和物 タダラフィル シロスタゾール | 減量するなど慎重に投与すること。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| ブロナンセリン クロザピン ゾピクロン アルプラゾラム エプレレノン エレトリプタン臭化水素酸塩 エベロリムス サキナビルメシル酸塩 | これらの薬剤の作用が増強するおそれがある。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| ドンペリドン | ドンペリドンの血中濃度が上昇する。また、ドンペリドンとの併用により、QT延長が報告されている。 | 本剤はCYP3Aと結合し、複合体を形成するため、これらの薬剤の代謝を抑制し、血中濃度が上昇することがある。 |
| 副腎皮質ホルモン剤 メチルプレドニゾロン等 | これらの薬剤の消失半減期が延長するとの報告があるので、減量するなど慎重に投与すること。 | 本剤はこれらの薬剤の代謝を抑制することがある。 |
| エバスチン | エバスチンの代謝物カレバスチンの血中濃度が上昇するとの報告がある。 | 本剤はこれらの薬剤の代謝を抑制することがある。 |
| エドキサバントシル酸塩水和物 | 出血のリスクを増大させるおそれがある。併用する場合、エドキサバントシル酸塩水和物の用量は、エドキサバントシル酸塩水和物の電子添文を参照すること。 | 本剤がP-糖蛋白質を阻害し、エドキサバンの血中濃度を上昇させるためと考えられる。 |
| ジゴキシン | ジゴキシンの作用増強による嘔気、嘔吐、不整脈等の中毒症状が報告されているので、減量するなど慎重に投与すること。 | 本剤の腸内細菌叢への影響により、ジゴキシンの代謝が抑制される。 |
| ザフィルルカスト | ザフィルルカストの血中濃度が低下するとの報告がある。 | 機序は不明である。 |
| シメチジン | 難聴が報告されているので、減量するなど慎重に投与すること。 | これらの薬剤のCYP3A阻害作用により、本剤の代謝が抑制され、血中濃度が上昇すると考えられる。 |
| リトナビル | 本剤のAUCが上昇することが予想される。 | これらの薬剤のCYP3A阻害作用により、本剤の代謝が抑制され、血中濃度が上昇すると考えられる。 |
| クリンダマイシン(外用剤) | 併用してもクリンダマイシンの効果があらわれないと考えられる。 | 本剤の細菌のリボゾーム50S Subunitへの親和性がクリンダマイシンより高いと考えられる。 |
| リバーロキサバン | リバーロキサバンの血中濃度が上昇したとの報告がある。 | 本剤がCYP3A4及びP-糖蛋白質を阻害することによりリバーロキサバンのクリアランスが減少する。 |
| フェキソフェナジン塩酸塩 | フェキソフェナジンの血漿中濃度を上昇させるとの報告がある。 | P-糖蛋白質の阻害によるフェキソフェナジンのクリアランスの低下及び吸収率の増加に起因するものと推定される。 |
| CYP3A4誘導作用を有する薬剤 リファンピシン、リファブチン、フェニトイン、フェノバルビタール等 セイヨウオトギリソウ(St.John's Wort,セント・ジョーンズ・ワート)含有食品 | 本剤の作用が減弱するおそれがある。 | これらの薬剤のCYP3A誘導作用により、本剤の代謝を促進し、本剤の血中濃度を低下させる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 偽膜性大腸炎等の血便を伴う重篤な大腸炎(頻度不明)
腹痛、頻回の下痢があらわれた場合には、直ちに投与を中止するなど適切な処置を行うこと。
11.1.2 心室頻拍(Torsade de pointesを含む)、QT延長(いずれも頻度不明)[9.1.1参照]
11.1.3 ショック、アナフィラキシー(いずれも頻度不明)
呼吸困難、胸内苦悶、血圧低下等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.4 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.5 急性腎障害(急性間質性腎炎)(頻度不明)[8.2参照]
11.1.6 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、Al-Pの上昇等を伴う肝機能障害や黄疸があらわれることがある。
11.2 その他の副作用
| 頻度不明 | |
| 過敏症 | 発疹、血管性浮腫 |
| 消化器 | 食欲不振、悪心・嘔吐、胃痛、下痢、鼓腸、胃部不快感、便秘、腹部痙攣 |
| 眼 | 視力低下、霧視 |
13. 過量投与
13.1 症状
胃腸症状、過敏症等がみられる。また、可逆性の難聴、一過性かつ軽症の急性膵炎があらわれたとの報告がある。
13.2 処置
エリスロマイシンは腹膜透析、血液透析では除去されない。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 本剤は腸溶錠なので、噛まずに服用させること。
14.1.2 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
外国で重症筋無力症が悪化したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人に、エリスロマイシン錠300mg(力価)を経口投与したとき、血中濃度は2時間後に最高血中濃度1.1μg/mLを示し、6時間後には0.2μg/mLを示した2)。
16.1.2 生物学的同等性試験
エリスロマイシン錠200mg「サワイ」とアイロタイシン錠(200mg)を健康成人男子にそれぞれ2錠[エリスロマイシンとして400mg(力価)]空腹時単回経口投与(クロスオーバー法)し、血清中エリスロマイシン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
| Cmax[μg(力価)/mL] | Tmax(hr) | T1/2(hr) | AUC0-9hr[μg(力価)・hr/mL] | |
| エリスロマイシン錠200mg「サワイ」 | 1.29±0.31 | 3.8±0.6 | 2.0±0.7 | 4.44±0.80 |
| アイロタイシン錠(200mg) | 1.27±0.28 | 3.7±0.6 | 2.8±1.6 | 4.36±1.10 |
血清中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.4 代謝
16.5 排泄
主に胆汁中へ排泄されるが、一部尿中にも排泄される。
胆のう炎患者(1例)に200mg(力価)単回投与時の胆汁中濃度、尿中濃度の最高値は各々10.76μg/mL(投与8時間後)、32.68μg/mL(投与5時間後)であった10)。
胆のう炎患者(1例)に200mg(力価)単回投与時の胆汁中濃度、尿中濃度の最高値は各々10.76μg/mL(投与8時間後)、32.68μg/mL(投与5時間後)であった10)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
エリスロマイシン500mg(力価)注1)を肝障害患者及び健康成人に空腹時単回経口投与したとき、健康成人に比べて、肝障害患者はTmaxが短く、Cmaxも高値を示した11)(外国人データ)。[9.3参照]
注1)本剤の承認された用法及び用量は「1日800〜1200mg(力価)を4〜6回に分割経口投与する。」である。
| 対象 | n | 年齢(歳) | Cmax(μg/mL) | Tmax(hr) | AUC0-24hr(μg・hr/mL) | T1/2α(hr) | T1/2β(hr) |
| 肝障害患者注2) | 8 | 57.2 | 2.04 | 4.1 | 11.6[6] | 1.6[4] | 4.5[6] |
| 健康成人 | 6 | 30.0 | 1.50 | 6.3 | 9.0 | 1.3[5] | 6.6 |
18. 薬効薬理
18.1 作用機序
細菌のタンパク質合成阻害であり、70S系リボソームの50Sサブユニットに結合し作用する12)。
18.2 抗菌作用
グラム陽性菌、グラム陰性球菌、マイコプラズマ、梅毒トレポネーマ、クラミジアに対して強く作用し、作用は静菌的であるが、高濃度では殺菌的に作用する場合がある12)。
19. 有効成分に関する理化学的知見
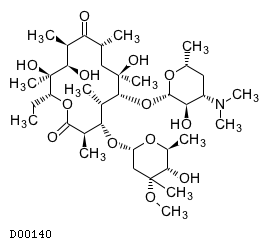
19.1. エリスロマイシン
22. 包装
PTP
100錠(10錠×10)
23. 主要文献
- 厚生労働省健康・生活衛生局感染症対策部感染症対策課編:抗微生物薬適正使用の手引き
- 日本薬局方 医薬品情報, 220-224, (2001), (じほう)
- 社内資料:生物学的同等性試験
- 黒田善雄, Chemotherapy, 6 (6), 343-360, (1958) »DOI
- 深谷一太他, Chemotherapy, 18 (3), 252-258, (1970) »DOI
- Bergogne-Berezin,E.et al., Int.J.Clin.Pharmacol.Res., 5 (5), 341-344, (1985) »PubMed
- Watkins,P.B.et al., Proc.Natl.Acad.Sci., 82 (18), 6310-6314, (1985) »PubMed
- Brian,W.R.et al., Biochemistry, 29, 11280-11292, (1990) »PubMed
- Wells,J.S.et al., Antibiot.Annu., 1954/1955, 291-294, (1955)
- 小野一男, モダンテラピー, 6, 8-13, (1953)
- Kroboth,P.D.et al., Antimicrob.Agents Chemother, 21 (1), 135-140, (1982) »PubMed
- 第十八改正日本薬局方解説書, C-1078-1085, (2021), (廣川書店)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30