医薬品情報
| 総称名 | カタプレス |
|---|---|
| 一般名 | クロニジン塩酸塩 |
| 欧文一般名 | Clonidine Hydrochloride Clonidine |
| 製剤名 | クロニジン塩酸塩製剤 |
| 薬効分類名 | 高血圧症治療剤 |
| 薬効分類番号 | 2149 |
| ATCコード | C02AC01 |
| KEGG DRUG |
D00604
クロニジン塩酸塩
|
| KEGG DGROUP |
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| カタプレス錠75μg | Catapres Tablets75μg | Medical Parkland | 2149001F1034 | 6.1円/錠 | 処方箋医薬品注) |
| カタプレス錠150μg | Catapres Tablets150μg | Medical Parkland | 2149001F2065 | 6.1円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
カタプレス錠75μg
通常1回1〜2錠(クロニジン塩酸塩として0.075mg〜0.150mg)を1日3回経口投与する。なお、症状により適宜増減する。重症の高血圧症には1回4錠を1日3回投与する。
カタプレス錠150μg
通常1回1/2〜1錠(クロニジン塩酸塩として0.075mg〜0.150mg)を1日3回経口投与する。なお、症状により適宜増減する。重症の高血圧症には1回2錠を1日3回投与する。
8. 重要な基本的注意
8.1 ときに起立性低血圧があらわれることがあるので、臥位のみならず、立位又は坐位で血圧測定を行い、体位変換による血圧変化を考慮し、坐位にて血圧をコントロールすること。
8.2 本剤を投与している患者で急に投与を中止すると、まれに血圧の上昇、神経過敏、頻脈、不安感、頭痛等のリバウンド現象があらわれることがあるので、投与を中止しなければならない場合には、高血圧治療で、一般に行われているように、投与量を徐々に減らすこと。
8.3 鎮静作用により反射運動等が減弱されることがあるので、高所作業、自動車の運転等危険を伴う作業に注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 虚血性心疾患又は高血圧以外の原因による心不全のある患者
急激な降圧により心機能を悪化させることがある。
9.1.2 虚血性心疾患及びうっ血性心不全の既往歴のある患者
急激な降圧により心機能を悪化させることがある。
9.1.3 脳梗塞又は脳血管障害のある患者
急激な降圧により症状を悪化させることがある。
9.1.4 高度の徐脈(著しい洞性徐脈)のある患者
症状を悪化させることがある。
9.1.5 発熱のある患者
血圧、心機能等に著明な変化を来すおそれがある。
9.2 腎機能障害患者
9.2.1 腎障害のある患者
急激な降圧により腎機能を悪化させることがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。本剤は胎盤を通過することが報告されている。
9.6 授乳婦
9.7 小児等
小児等を対象とした国内臨床試験は実施していない。
9.8 高齢者
低用量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。脳梗塞等が起こるおそれがあるため一般に過度の降圧は好ましくないとされている。
10. 相互作用
10.2 併用注意
| 中枢神経抑制剤 アルコール | 鎮静作用が増強されることがある。 | 本剤との併用により相加的に鎮静作用が増強される。 |
| β遮断剤 | 本剤の投与中止後のリバウンド現象が強められる可能性があるので、本剤の投与を中止する場合には、β遮断剤を先に中止し、数日間経過を観察した後、本剤の投与を中止すること。 | 本剤はノルエピネフリンの遊離を抑制するため、急激な中止により血中ノルエピネフリンの上昇が起こる。β遮断剤の併用時は、β受容体が遮断されているため、ノルエピネフリンのα受容体刺激作用が増強され、血圧が急激に上昇する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと注)。
11.1.1 幻覚(頻度不明)
11.1.2 錯乱(頻度不明)
注)発現頻度は再評価調査結果を含む
11.2 その他の副作用
| 5%以上又は頻度不明 | 0.1〜5%未満 | 0.1%未満 | |
| 精神神経系 | 眠気、鎮静作用、疲労感 | 不安、めまい、倦怠感 | 見当識障害 |
| 循環器 | 徐脈 | 起立性低血圧、蒼白・レイノー様症状 | |
| 消化器 | 口渇(19.0%) | 悪心、食欲不振、下痢、便秘、心窩部膨満感、胸やけ | 腹痛 |
| 泌尿・生殖器 | 陰萎 | ||
| 過敏症 | 発疹、そう痒 | ||
| その他 | 鼻閉、血管神経性浮腫 | 眼の乾燥、血糖値の上昇 |
13. 過量投与
13.1 症状
過量投与した場合、交感神経抑制によって一般的に認められる瞳孔収縮、嗜眠、徐脈、低血圧、低体温、昏睡、無呼吸等の症状が発現する。また、末梢のα1受容体の刺激による血圧上昇が起こる可能性もある。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
高血圧症患者5例にクロニジン塩酸塩0.3mgを経口投与した場合、90分で最高血中濃度約1.3ng/mLに達する。血中濃度の半減期は約10時間である(外国人のデータ)3)。
16.3 分布
クロニジン塩酸塩0.1mg/kgを経口投与した場合、消化管から吸収後、全組織に均等に分布し、吸収及び排泄に関係のある臓器以外に特定の臓器に集中する傾向は認められなかった(ラット)4)。
16.4 代謝
一部は肝臓においてイミダゾリン環の開裂、フェニル環の水酸化を受けるが、大部分は未変化体である(外国人のデータ)5)。
16.5 排泄
健康成人にクロニジン塩酸塩を0.39mg又は1.44mg経口投与した場合、24時間後までに尿中に約45%、96時間後までに尿中に約65%及び糞中に約22%が排泄される(外国人のデータ)4)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
承認された効能・効果に対する本剤の臨床効果が認められた。
18. 薬効薬理
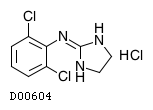
19. 有効成分に関する理化学的知見
19.1. クロニジン塩酸塩
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて保存すること。
22. 包装
<カタプレス錠 75μg>
100錠[10錠(PTP)×10]
<カタプレス錠 150μg>
100錠[10錠(PTP)×10]
23. 主要文献
- Hartikainen-Sorri AL et al., Dept Obstet & Gynaecol & Paediat., 69 (4), 598-600, (1987)
- Asher Ornoy, Pharm Res., (35), 46, (2018)
- Wing L M H et al., Eur J Clin Pharmacol., 12, 463-469, (1977)
- Rehbinder D et al., Arzneim-Forsch/Drug Res., 19, 169-176, (1969)
- Darda S et al., Arzneim-Forsch/Drug Res., 28, 255-259, (1978)
- Kobinger W, Chest., 83, 296-299, (1983) »PubMed
- 大島研三ほか, 綜合臨牀, 19, 1237, (1970)
- Cohen I M et al., Clin Pharmacol Ther., 26, 572-577, (1979)
- Morgan T, Chest., 83, 383-386, (1983) »PubMed
- 浜本 肇ほか, 臨牀と研究, 54, 308-312, (1977)
24. 文献請求先及び問い合わせ先
文献請求先
株式会社Medical Parkland
カスタマーセンター
〒152-0035
東京都目黒区自由が丘3丁目2番17号202
電話:0120-689-610 (受付時間)9:00〜17:00(土・日・祝日・弊社休業日を除く)
製品情報問い合わせ先
株式会社Medical Parkland
カスタマーセンター
〒152-0035
東京都目黒区自由が丘3丁目2番17号202
電話:0120-689-610 (受付時間)9:00〜17:00(土・日・祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
株式会社Medical Parkland
東京都目黒区自由が丘3丁目2番17号202