医薬品情報
| 総称名 | ミニプレス |
|---|---|
| 一般名 | プラゾシン塩酸塩 |
| 欧文一般名 | Prazosin Hydrochloride |
| 製剤名 | プラゾシン塩酸塩錠 |
| 薬効分類名 | 高血圧・排尿障害治療剤 |
| 薬効分類番号 | 2149 |
| ATCコード | C02CA01 |
| KEGG DRUG |
D00609
プラゾシン塩酸塩
|
| KEGG DGROUP |
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年4月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ミニプレス錠0.5mg | Minipress Tablets 0.5mg | ファイザー | 2149002F1128 | 6.1円/錠 | 処方箋医薬品注) |
| ミニプレス錠1mg | Minipress Tablets 1mg | ファイザー | 2149002F2159 | 7.9円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
<前立腺肥大症に伴う排尿障害>
本剤による治療は原因療法ではなく、対症療法であることに留意し、本剤投与により期待する効果が得られない場合には手術療法等、他の適切な処置を考慮すること。
6. 用法及び用量
<本態性高血圧症、腎性高血圧症>
プラゾシンとして通常、成人1日1〜1.5mg(1回0.5mg 1日2〜3回)より投与を始め、効果が不十分な場合は1〜2週間の間隔をおいて1.5〜6mgまで漸増し、1日2〜3回に分割経口投与する。まれに1日15mgまで漸増することもある。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
<前立腺肥大症に伴う排尿障害>
プラゾシンとして通常、成人1日1〜1.5mg(1回0.5mg 1日2〜3回)より投与を始め、効果が不十分な場合は1〜2週間の間隔をおいて1.5〜6mgまで漸増し、1日2〜3回に分割経口投与する。
なお、症状により適宜増減する。
なお、症状により適宜増減する。
8. 重要な基本的注意
8.1 起立性低血圧があらわれることがあるので、臥位のみならず立位又は座位で血圧測定を行い、体位変換による血圧変化を考慮し、座位にて血圧をコントロールすること。
8.2 本剤の投与初期又は用量の急増時などに、ときに急激な血圧低下によると考えられる失神・意識喪失を起こすことがある。
一般に本症状は、本剤投与後短時間で起こり、めまい、脱力感、発汗、動悸等の前駆症状を伴うのでその際は仰臥位をとらせるなどの適切な措置を講ずる。また、必要に応じて対症療法を行うこと。[11.1.1参照]
一般に本症状は、本剤投与後短時間で起こり、めまい、脱力感、発汗、動悸等の前駆症状を伴うのでその際は仰臥位をとらせるなどの適切な措置を講ずる。また、必要に応じて対症療法を行うこと。[11.1.1参照]
8.3 本剤の投与初期又は用量の急増時等に、起立性低血圧に基づくめまい等があらわれることがあるので、高所作業、自動車の運転等危険を伴う作業に従事する場合には注意させること。
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
主として肝臓で代謝されるため血中濃度が上昇するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中へ移行することが報告されている1)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
低用量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。一般に過度の降圧は脳梗塞等が起こるおそれがある。
10. 相互作用
10.2 併用注意
| 利尿剤、他の降圧剤 ニフェジピン等 | 相互に作用を増強することがあるので、減量するなど注意すること。 | 相互に作用を増強することがある。 |
| ホスホジエステラーゼ5阻害作用を有する薬剤 バルデナフィル塩酸塩水和物 タダラフィル シルデナフィルクエン酸塩 | 併用によりめまい等の自覚症状を伴う症候性低血圧を来したとの報告がある。 | 血管拡張作用による降圧作用を有するため、本剤の降圧作用を増強することがある。 |
11. 副作用
11.1 重大な副作用
11.2 その他の副作用
| 1%以上注1) | 0.1〜1%未満注1) | 0.1%未満注1) | 頻度不明 | |
| 肝臓 | ALT、ASTの上昇、肝機能異常 | |||
| 循環器 | 動悸・心悸亢進、頻脈、起立性めまい、起立性低血圧、低血圧、ほてり | 潮紅 | 徐脈 | |
| 精神・神経系 | めまい、頭痛・頭重 | 眠気、眩暈 | 不眠、耳鳴、四肢のしびれ | 抑うつ、幻覚、神経過敏(症) |
| 消化器 | 食欲不振、下痢、便秘、腹痛、口渇、悪心・嘔吐 | 膵炎 | ||
| 泌尿・生殖器 | 頻尿、陰萎、尿失禁 | 持続勃起、女性化乳房 | ||
| 過敏症 | 発疹 | 蕁麻疹、そう痒感 | 扁平苔癬、血管炎 | |
| 呼吸器 | 鼻閉 | 息苦しさ | 呼吸困難、鼻出血、鼻充血 | |
| 眼 | かすみ目 | 強膜変色、眼痛、術中虹彩緊張低下症候群(IFIS) | ||
| その他 | 浮腫、胸痛、倦怠感、脱力感 | 発汗、疲労 | 脱毛、発熱、疼痛、関節痛、異常感覚、抗核因子試験陽性 |
13. 過量投与
13.1 症状
過量投与により低血圧を起こす可能性がある。
13.2 処置
本剤は蛋白結合率が高いため、透析による除去は有効ではない。
また、2歳の小児がプラゾシンを少なくとも50mg服用した事故では、深い眠気及び反射の低下を招いたが、血圧の低下はみられず、回復は順調であった。
その他、下表の報告もある4)。
また、2歳の小児がプラゾシンを少なくとも50mg服用した事故では、深い眠気及び反射の低下を招いたが、血圧の低下はみられず、回復は順調であった。
その他、下表の報告もある4)。
| 年齢、性 | 投与量 | 症状、徴候 | 処置 | 転帰 |
| 19歳、男性 | 200mg | 頻脈 | 36時間臥床 | 回復 |
| 25歳、男性 | 150mg | 持続勃起 | 亀頭陰茎海綿体シャント | 回復 |
| 75歳、男性 | 80mg | 嗜眠状態、低血圧 | 胃洗浄、活性炭、輸液 | 18時間後回復 |
| 72歳、男性 | 120mg | 昏睡、低血圧、チェーンストークス型呼吸、呼吸不全、アシドーシス、肺水腫 | ドパミン、アンジオテンシン、集中治療室に搬入後換気、膠質輸液、アトロピン | 48時間後回復 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 腎及びその他の動脈狭窄症、脚部及びその他の動脈瘤等の血管障害のある高血圧患者で、本剤の投与により急性熱性多発性関節炎がみられた報告がある。
15.1.2 α1遮断薬を服用中又は過去に服用経験のある患者において、α1遮断作用によると考えられる術中虹彩緊張低下症候群(Intraoperative Floppy Iris Syndrome)があらわれるとの報告がある。
16. 薬物動態
16.1 血中濃度
健常成人6名にプラゾシン錠2mgを経口投与した場合、1.2時間後に最高血中濃度21.1ng/mLを示し、その半減期は約2時間であった5)。
16.2 吸収
16.2.1 食事の影響
健常成人18名にプラゾシン錠2mgをクロスオーバー法により空腹時又は食後に単回経口投与したときの血中濃度・時間曲線下面積(AUC)に有意差は認められず、本剤の吸収に及ぼす食事の影響は少ないものと考えられる6)。
16.3 分布
健常成人6名にプラゾシン錠2mgを経口投与したときの血中濃度から求めた分布容積は平均75.3Lであり組織への移行性は高いと考えられる5)。
16.5 排泄
健常成人6名にプラゾシン錠2mgを経口投与したときの24時間迄の尿中排泄率は2.4%であった5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<本態性高血圧症、腎性高血圧症>
17.1.1 二重盲検比較試験を含む臨床試験
単独投与時、利尿降圧剤併用投与時ともに大部分の症例が投与開始後1〜2週間は初期投与量を固定して投与され、以降は症例ごとに血圧の変動に応じ1〜2週間の間隔をおいて、多くは漸増しながら投与量の調節が行われた。血圧降下は徐々に始まり、4週目以降には収縮期血圧、拡張期血圧ともにすぐれた降圧効果が得られ、投与開始後8〜10週時までにはほぼ投与量の調節が終わり、安定した降圧効果が維持された。また6ヵ月以上の長期投与においても良好な降圧効果が持続し、長期療法に耐え得る有用な薬剤と評価されている。
プラゾシン単独投与及び利尿降圧剤又はその他の降圧剤併用時の臨床効果は下表に示すとおりである7)。
プラゾシン単独投与及び利尿降圧剤又はその他の降圧剤併用時の臨床効果は下表に示すとおりである7)。
| 投与方法\効果判定 | 改善以上 | 軽度改善以上 |
| 単独投与 | 51.1%(204/399) | 73.2%(292/399) |
| 併用投与 | 55.7%(123/221) | 79.6%(176/221) |
| 計 | 52.7%(327/620) | 75.5%(468/620) |
<前立腺肥大症に伴う排尿障害>
17.1.2 一般臨床試験及び二重盲検比較試験
17.3 その他
18. 薬効薬理
18.1 作用機序
<本態性高血圧症、腎性高血圧症>
末梢血管にあるα1受容体を選択的に遮断することにより、末梢血管を拡張させ、全末梢抵抗を減少させる。
<前立腺肥大症に伴う排尿障害>
α1受容体を選択的に遮断することにより後部尿道・前立腺・膀胱三角部平滑筋を弛緩させ、尿道抵抗を減少させる。
18.2 降圧作用
プラゾシンは高血圧自然発症ラット、腎性高血圧ラット、DOCA高血圧ラットのいずれにおいても優れた降圧作用が認められている13)。
プラゾシンの降圧作用はα受容体を遮断することにより末梢血管を拡張させ、その抵抗を減少させることによるが、従来のα遮断薬と異なり、シナプス後α受容体を選択的に遮断し、シナプス前α受容体にはほとんど作用しない。このためシナプス前α受容体を介するノルアドレナリン放出の負のフィードバック機構を抑制せず、過剰のノルアドレナリン放出をおこさないことがin vitroにおけるウサギ肺動脈の試験で認められている14)。シナプス後α受容体に対するプラゾシンの選択的な作用は本態性高血圧症患者に反射性頻脈をほとんどきたさないこと、レニン活性に及ぼす影響が少ないこと、長期連用による耐性発現がみられないことなどの特性に関連するものと考えられている10)15)。
プラゾシンの降圧作用はα受容体を遮断することにより末梢血管を拡張させ、その抵抗を減少させることによるが、従来のα遮断薬と異なり、シナプス後α受容体を選択的に遮断し、シナプス前α受容体にはほとんど作用しない。このためシナプス前α受容体を介するノルアドレナリン放出の負のフィードバック機構を抑制せず、過剰のノルアドレナリン放出をおこさないことがin vitroにおけるウサギ肺動脈の試験で認められている14)。シナプス後α受容体に対するプラゾシンの選択的な作用は本態性高血圧症患者に反射性頻脈をほとんどきたさないこと、レニン活性に及ぼす影響が少ないこと、長期連用による耐性発現がみられないことなどの特性に関連するものと考えられている10)15)。
18.3 循環動態
18.4 腎機能
腎機能が正常な本態性高血圧症患者に対して、プラゾシン投薬前後の糸球体濾過量などを測定し、降圧後の腎機能の変動を検討したが、有意の変動を認めず、降圧効果に伴う腎血流量の低下はないものと推測される。またBUN、クレアチニン、PSPにも有意の変動はみられていない18)。
18.5 前立腺、尿道及び膀胱平滑筋に対する作用
プラゾシンはウサギ摘出前立腺、尿道及び膀胱三角部平滑筋標本でのノルアドレナリン収縮を用量依存的に抑制し、その作用はフェントラミンの約2.5〜3.1倍である。プラゾシンは麻酔イヌの下腹部神経刺激による尿道内圧の上昇を著明に抑制し、その作用はフェントラミンの約10倍であった。
また、プラゾシンはラット排尿反射による膀胱収縮を抑制し、膀胱容量増加が示唆される19)。
また、プラゾシンはラット排尿反射による膀胱収縮を抑制し、膀胱容量増加が示唆される19)。
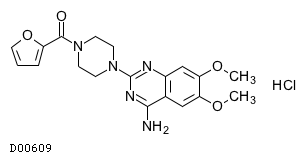
19. 有効成分に関する理化学的知見
19.1. プラゾシン塩酸塩
22. 包装
<ミニプレス錠0.5mg>
100錠[10錠(PTP)×10]
<ミニプレス錠1mg>
100錠[10錠(PTP)×10]
23. 主要文献
- 竹田省ほか, 産科と婦人科, 56 (12), 2516-2520, (1989)
- 厚生省薬務局, 医薬品副作用情報, (94), 17-19, (1989)
- 厚生省薬務局, 医薬品研究, 26 (1), 37-43, (1995)
- Lip GYH,et al., J Hum Hypertens., 9 (7), 523-526, (1995)
- 林正弘ほか, 臨床薬理, 9 (4), 385-394, (1978) »DOI
- Verbesselt R,et al., Acta Ther., 2 (1), 27-39, (1976)
- 社内資料:高血圧症に対する臨床効果
- 社内資料:一般臨床試験の成績に関する資料
- 山口脩ほか, 医学と薬学, 19 (2), 411-429, (1988)
- 高畠利一ほか, 医学と薬学, 9 (3), 873-880, (1983)
- 国府達郎ほか, 循環器科, 12 (4), 396-404, (1982)
- 西澤芳男, 医学と薬学, 7 (7), 1899-1909, (1982)
- 大槻勲夫ほか, 応用薬理, 17 (3), 403-422, (1979)
- Cambridge D,et al., Med J Aust., 2 (Specl.Suppl.), 2-6, (1977)
- 築山久一郎ほか, 臨床成人病, 8 (2), 227-233, (1978)
- 新谷冨士雄ほか, 臨牀と研究, 55 (2), 629-633, (1978)
- 後藤哲也ほか, 臨床成人病, 7 (6), 926-935, (1977)
- 篠田知璋, 診療と新薬, 15 (12), 3111-3118, (1978)
- 社内資料:実験動物における尿道、前立腺および膀胱に対するPrazosinの作用
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
製品情報問い合わせ先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7