医薬品情報
| 総称名 | アリクストラ |
|---|---|
| 一般名 | フォンダパリヌクスナトリウム |
| 欧文一般名 | Fondaparinux Sodium |
| 製剤名 | フォンダパリヌクスナトリウム注射液 |
| 薬効分類名 | 合成Xa阻害剤 |
| 薬効分類番号 | 3339 |
| ATCコード | B01AX05 |
| KEGG DRUG |
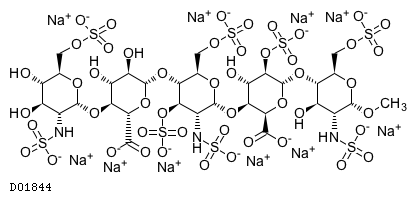
D01844
フォンダパリヌクスナトリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年9月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アリクストラ皮下注1.5mg | Arixtra Injection | サンドファーマ | 3339400G1029 | 956円/筒 | 処方箋医薬品注) |
| アリクストラ皮下注2.5mg | Arixtra Injection | サンドファーマ | 3339400G2025 | 1079円/筒 | 処方箋医薬品注) |
1. 警告
脊椎・硬膜外麻酔あるいは腰椎穿刺等との併用により、穿刺部位に血腫が生じ、神経の圧迫による麻痺があらわれるおそれがある。併用する場合には神経障害の徴候及び症状について十分注意し、異常が認められた場合には直ちに適切な処置を行うこと。[7.3参照]
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
静脈血栓塞栓症の発現リスクの高い、次の患者における静脈血栓塞栓症の発症抑制
○下肢整形外科手術施行患者
○腹部手術施行患者
5. 効能または効果に関連する注意
腹部手術のうち帝王切開術施行患者における有効性・安全性は確立していないため、これらの患者に投与する場合には、リスクとベネフィットを十分考慮すること(使用経験は少ない)。
6. 用法及び用量
通常、成人には、フォンダパリヌクスナトリウムとして2.5mgを1日1回皮下投与する。なお、腎障害のある患者に対しては、腎機能の程度に応じて1.5mg1日1回に減量する。
7. 用法及び用量に関連する注意
7.1 本剤は皮下注射のみに使用し、筋肉内投与はしないこと。
7.2 本剤の初回投与は、手術後24時間を経過し、手術創等からの出血がないことを確認してから行うこと。また、投与後に患者の状態を十分に観察できるよう、夜間等に初回投与がなされないように配慮することが望ましい。なお、海外臨床試験において手術後6時間以内に本剤を投与したとき、出血の危険性が増大したとの報告がある。
7.3 本剤の初回投与は、硬膜外カテーテル抜去あるいは腰椎穿刺から少なくとも2時間を経過してから行うこと。また、初回投与以降にこれらの処置を行う場合には、前回投与から十分な時間をあけ、かつ、予定した次回の投与の少なくとも2時間以上前に実施すること。[1.参照]
7.4 2回目以降の投与は、1日1回ほぼ一定の時刻に投与することが望ましいが、投与時刻を変更する場合には、前回の投与から少なくとも12時間以上の間隔をあけて投与すること。
7.5 本剤投与中は、臨床症状の観察や超音波検査等により、血栓塞栓症の有無を観察し、十分な歩行が可能となり静脈血栓塞栓症のリスクが減少するまで本剤を継続投与すること。なお、下肢整形外科手術施行患者では15日間以上、腹部手術施行患者では9日間以上投与した場合の有効性及び安全性は、国内臨床試験においては検討されていない。
8. 重要な基本的注意
8.1 プロトロンビン時間(PT-INR)及び活性化部分トロンボプラスチン時間(APTT)等の通常の凝固能検査は、本剤に対する感度が比較的低く、薬効をモニタリングする指標とはならないので、臨床症状を注意深く観察し、出血等がみられた場合には投与を中止するなど適切な処置を行うこと。[18.5参照]
8.2 本剤の使用にあたっては、個々の患者の出血リスク、体重、年齢、症状(手術後の腎機能の低下、血行動態等の心機能、尿量等)を踏まえ、観察を十分に行い、出血等の異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
8.3 出血等の副作用を生じることがあるので、必要に応じて血算(ヘモグロビン値及び血小板数)及び便潜血検査等の臨床検査を実施することが望ましい。[11.1.1参照]
8.4 血小板減少症が起こることがあるので、1週間に1回程度は臨床検査を実施するなど観察を十分に行い、急激な血小板数の減少がみられた場合には、投与を中止すること。
8.5 「高リスク」以上の婦人科手術施行患者に対する使用経験が少ないため、これらの患者に投与する場合には、患者の状態を十分に観察すること。
8.6 本剤の注射針カバーは天然ゴムラテックスを含み、アレルギー反応を起こすことがあるので、投与に際し、問診を行うこと。また、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 出血する可能性が高い患者(出血傾向のある患者、消化管潰瘍の患者、頭蓋内出血後又は脳脊髄や眼の手術後日の浅い患者等)
出血を生じるおそれがある。
9.1.2 低体重の患者
本剤の全身クリアランスは体重の低下に伴って低下する傾向がみられるため、低体重の患者に投与する場合には本剤の血中濃度が上昇し、出血の危険性が増大するおそれがある。海外臨床試験において、体重50kg未満の患者に出血の危険性が増大したとの報告がある。なお、国内臨床試験においては、体重40kg未満の患者への使用経験がほとんどない。
9.1.3 ヘパリン起因性血小板減少症(HIT)II型の既往のある患者
HIT抗体との交差反応性は認められていないが、使用経験が少なく、安全性は確立していない。[18.4参照]
9.2 腎機能障害患者
9.2.1 重度の腎障害のある患者(クレアチニンクリアランス20mL/min未満)
9.2.2 中等度又は軽度の腎障害のある患者
9.3 肝機能障害患者
9.3.1 重度の肝障害のある患者
凝固因子の産生が低下していることがあるので、出血の危険性が増大するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ヒト胎盤を用いたin vitro試験では胎盤通過性はみられていないものの、妊娠ラットの反復静脈内投与試験では、わずかに胎児への移行が確認されている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラットにおいて乳汁への移行が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に腎機能が低下し本剤の血中濃度が上昇する可能性がある。
10. 相互作用
10.2 併用注意
| 抗凝固剤 ヘパリン 低分子ヘパリン ワルファリン等 血小板凝集抑制作用を有する薬剤 アスピリン ジピリダモール チクロピジン塩酸塩等 血栓溶解剤 ウロキナーゼ t-PA製剤等 | これらの薬剤との併用により、出血の危険性を増大させるおそれがある。併用する場合には、患者の状態を十分に観察するなど注意すること。 | 相互に抗凝固作用を増強することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 出血(5.8%)
まれに後腹膜出血、頭蓋内・脳内出血を生じるおそれがある。[8.3参照]
11.1.2 肝機能障害(10.0%)、黄疸(頻度不明)
AST、ALTの上昇等を伴う肝機能障害や黄疸があらわれることがある。
11.1.3 ショック(頻度不明)、アナフィラキシー(頻度不明)
血圧低下、頻脈、蕁麻疹等があらわれることがある。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 血液 | 血小板数増加 | 貧血 | 凝固障害、血小板減少症 | 紫斑、血小板異常 |
| 肝臓 | 肝機能障害 | 高ビリルビン血症 | ||
| 精神神経系 | 頭痛、めまい、不安、傾眠 | 錯乱 | ||
| 循環器 | 低血圧 | |||
| 消化器 | 便秘、消化不良、下痢、嘔気、腹痛、嘔吐、胃炎 | |||
| 皮膚 | 発疹 | そう痒 | ||
| 注射部位 | 局所反応 | |||
| 全身症状 | 発熱 | 浮腫、胸痛、下肢痛、潮紅、疲労 | 失神 | |
| その他 | 咳嗽、創部分泌、手術部位感染、低カリウム血症 | アレルギー反応、呼吸困難 |
14. 適用上の注意
14.1 薬剤調製時の注意
本剤は1回投与分の規定量を充填したプレフィルドシリンジである。シリンジから気泡を除去する際に薬液を減じるおそれがあるので、気泡を除去しないことが望ましいが、もし除去する場合には、薬液を減じないよう注意すること。
14.2 薬剤投与時の注意
連日皮下注射する場合には、例えば左右の前側腹部と後側腹部に交互に投与するなど、注射部位を変えて行うこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人にフォンダパリヌクスナトリウム0.75、2.5、8mg注)を単回皮下投与した時の薬物動態パラメータ及び血中濃度推移は以下のとおりであった。フォンダパリヌクスは皮下投与後速やかに吸収され、投与後約2時間で最高血中濃度に達し、消失半減期は約14〜17時間であった。
| 投与量 | Cmax (mg/L) | tmax (hr) | AUC0-∞ (mg・hr/L) | t1/2 (hr) |
| 0.75mg | 0.127±0.015 | 1.8(1.5-2.5) | −a) | 17.4±4.47 |
| 2.5mg | 0.335±0.030 | 2.0(1.5-2.5) | 6.62±1.10b) | 16.1±2.50 |
| 8mg | 0.971±0.125 | 2.0(1.5-2.0) | 16.8±1.54 | 13.8±0.660 |
単回皮下投与した時の血中フォンダパリヌクス濃度推移 (Mean±SD、n=6)
フォンダパリヌクスナトリウム0.75〜8mg注)の単回皮下投与において、フォンダパリヌクスの薬物動態はほぼ線形性を示した2)。
16.1.2 反復投与
健康高齢者にフォンダパリヌクスナトリウム0.75〜3mg注)を1日1回反復皮下投与した結果、フォンダパリヌクスは投与3日目に定常状態に到達し、反復投与による薬物動態の変化はみられなかった2)。
16.2 吸収
健康成人男性にフォンダパリヌクスナトリウムを8mg注)まで皮下投与した時の吸収は速やかで、2.5mgを単回皮下投与した時のtmaxは約2時間、Cmaxは0.335mg/L、AUC0-∞は6.62mg・hr/Lであった。tmaxは各用量でほぼ類似しており、8mg注)でCmaxは用量比例値よりわずかに低い値を示したが、Cmax及びAUCは用量の増加にほぼ比例して増加した。2.5mgを単回皮下投与した時の絶対的生物学的利用率は101%であった2)。
16.3 分布
16.4 代謝
フォンダパリヌクスナトリウムはCYP1A2、2A6、2C9、2C19、2D6、2E1及び3A4活性を阻害しない4)(in vitro)。
16.5 排泄
フォンダパリヌクスナトリウムは皮下投与後、投与量の大部分が未変化体のまま尿中に排泄される。健康成人に単回皮下投与した時の投与後120時間までのフォンダパリヌクスの尿中排泄率(投与量に対する%)は、約80%であった。
下肢整形外科手術施行患者を対象とした海外臨床試験における母集団薬物動態解析の結果、フォンダパリヌクスの全身クリアランスは体重の低下に伴って低下する傾向がみられた2)。
下肢整形外科手術施行患者を対象とした海外臨床試験における母集団薬物動態解析の結果、フォンダパリヌクスの全身クリアランスは体重の低下に伴って低下する傾向がみられた2)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害患者にフォンダパリヌクスナトリウム4mgを単回静脈内投与注)した結果、クレアチニンクリアランスの低下に伴いフォンダパリヌクスのAUC0-∞が増加し、消失半減期は延長した2)(外国人データ)。
| クレアチニンクリアランス(mL/min)(被験者数) | >90 (n=5) | 61-90 (n=5) | 31-60 (n=5) | 10-30 (n=5) |
| Cmax(mg/L) | 0.914±0.207 | 1.063±0.240 | 1.052±0.179 | 1.009±0.175 |
| AUC0-∞(mg・hr/L) | 7.6±1.2 | 11.5±2.0 | 18.3±4.7 | 43.8±8.7 |
| t1/2(hr) | 13.1±3.6 | 17.9±0.94 | 28.7±7.5 | 71.5±11.7 |
| CL(mL/min) | 7.82±1.21 | 5.22±1.15 | 3.35±0.85 | 1.37±0.29 |
| CLr(mL/min) | 5.51±0.54 | 3.77±1.24 | 2.16±0.59 | 0.54±0.27 |
16.6.2 肝機能障害患者
中等度肝機能障害患者にフォンダパリヌクスナトリウム7.5mg注)を単回皮下投与した時の薬物動態は、肝機能による影響を受けなかった2)(外国人データ)。
16.6.3 高齢者
健康高齢者にフォンダパリヌクスナトリウム2.5mgを単回皮下投与した時の薬物動態は、健康成人とほぼ類似していた2)。
16.7 薬物相互作用
ワルファリン、アスピリン、ピロキシカム(NSAID)、又はジゴキシンと併用投与した時、フォンダパリヌクスナトリウムはいずれの併用薬物の血液凝固系の薬力学活性パラメータにも影響を及ぼさず、またジゴキシンの薬物動態にも影響を与えなかった。また、フォンダパリヌクスの薬物動態は、いずれの併用薬物による影響も受けなかった2)(外国人データ)。
注)本剤の承認された用法・用量は、2.5mgを1日1回皮下投与、腎障害のある患者に対しては、腎機能の程度に応じて1.5mgを1日1回皮下投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<下肢整形外科手術施行患者>
17.1.1 国内第II/III相試験
待機的膝関節全置換術施行患者426例を対象として、フォンダパリヌクスナトリウム0.75、1.5、2.5、3.0mg注)又はプラセボを1日1回10〜14日間皮下投与した。各投与群における静脈血栓塞栓症の発現頻度は、フォンダパリヌクスナトリウム0.75mg群で34.2%、1.5mg群で21.3%、2.5mg群で16.2%、3.0mg群で9.5%、プラセボ群で65.3%であり、フォンダパリヌクスナトリウム群ではプラセボ群に比べて有意に静脈血栓塞栓症の発現頻度が減少した。
| 項目 | プラセボ群 | フォンダパリヌクスナトリウム群 | |||
| 0.75mg | 1.5mg | 2.5mg | 3.0mg | ||
| 発現頻度 (例数) | 65.3% (49/75) | 34.2% (27/79) | 21.3% (16/75) | 16.2% (12/74) | 9.5% (7/74) |
| 95%信頼区間 | 53.5-76.0 | 23.9-45.7 | 12.7-32.3 | 8.7-26.6 | 3.9-18.5 |
| Cochran-Armitage傾向性検定(p) | 1×10−14 | ||||
| Fisherの直接確率検定(p)* | − | 0.0002 | 8×10−8 | 9×10−10 | 6×10−13 |
なお、Major bleedingはフォンダパリヌクスナトリウム2.5mg群で1例、3.0mg群で1例、プラセボ群で1例に認められたが、その内訳は、2単位以上の輸血を必要とした症例が2例(2.5mg群、3.0mg群各1例)、2単位以上の輸血を必要とし、かつヘモグロビン値が2g/dL以上低下した症例が1例(プラセボ群)であり、フォンダパリヌクスナトリウム群とプラセボ群に有意な差は認められなかった5)。
17.1.2 国内第II/III相試験
待機的股関節全置換術施行患者406例を対象として、フォンダパリヌクスナトリウム0.75、1.5、2.5、3.0mg注)又はプラセボを1日1回10〜14日間皮下投与した。各投与群における静脈血栓塞栓症の発現頻度は、フォンダパリヌクスナトリウム0.75mg群で24.2%、1.5mg群で4.6%、2.5mg群で7.4%、3.0mg群で14.3%、プラセボ群で33.8%であり、0.75mg群を除き、フォンダパリヌクスナトリウム群ではプラセボ群に比べて有意に静脈血栓塞栓症の発現頻度が減少した。
| 項目 | プラセボ群 | フォンダパリヌクスナトリウム群 | |||
| 0.75mg | 1.5mg | 2.5mg | 3.0mg | ||
| 発現頻度 (例数) | 33.8% (25/74) | 24.2% (15/62) | 4.6% (3/65) | 7.4% (5/68) | 14.3% (10/70) |
| 95%信頼区間 | 23.2-45.7 | 14.2-36.7 | 1.0-12.9 | 2.4-16.3 | 7.1-24.7 |
| Cochran-Armitage傾向性検定(p) | 0.0001 | ||||
| Fisherの直接確率検定(p)* | − | 0.26 | 1×10−5 | 0.0001 | 0.0069 |
なお、Major bleedingはフォンダパリヌクスナトリウム0.75mg群で1例、2.5mg群で2例に認められたが、その内訳は、2単位以上の輸血を必要とした症例が2例(0.75mg群、2.5mg群各1例)、ヘモグロビン値が2g/dL以上低下した症例が1例(2.5mg群)であり、フォンダパリヌクスナトリウム群とプラセボ群に有意な差は認められなかった6)。
17.1.3 国内第III相試験
待機的股関節全置換術施行患者114例を対象として、フォンダパリヌクスナトリウム1.5又は2.5mgを1日1回10〜14日間皮下投与した。各投与群における静脈血栓塞栓症の発現頻度は、フォンダパリヌクスナトリウム1.5mg群で8.3%、2.5mg群で2.2%であった。
| 項目 | フォンダパリヌクスナトリウム1.5mg群 | フォンダパリヌクスナトリウム2.5mg群 |
| 発現頻度 (例数) | 8.3% (4/48) | 2.2% (1/46) |
| 95%信頼区間 | 2.3-20.0 | 0.1-11.5 |
なお、Major bleedingが認められた症例はなかった7)。
17.1.4 国内第III相試験
股関節(大腿骨近位部)骨折手術施行患者48例を対象として、フォンダパリヌクスナトリウム2.5mgを1日1回10〜14日間皮下投与した。フォンダパリヌクスナトリウム2.5mg群における静脈血栓塞栓症の発現頻度は、21.6%であった。
| 項目 | フォンダパリヌクスナトリウム2.5mg群 |
| 発現頻度 (例数) | 21.6% (8/37) |
| 95%信頼区間 | 9.8-38.2 |
なお、Major bleedingが認められた症例はなかった8)。
<腹部手術施行患者>
17.1.5 国内第III相試験
腹部の癌の大手術又は骨盤内悪性腫瘍根治術施行患者120例を対象として、フォンダパリヌクスナトリウム2.5mgを1日1回4〜8日間皮下投与又は間欠的空気圧迫法を実施した。間欠的空気圧迫法は一律の使用規定を設けず各医療機関の通常の使用法に従った。各群における静脈血栓塞栓症の発現頻度は、フォンダパリヌクスナトリウム2.5mg群で10.8%、間欠的空気圧迫法群で17.6%であった。
| 項目 | フォンダパリヌクスナトリウム2.5mg群 | 間欠的空気圧迫法群* |
| 発現頻度 (例数) | 10.8% (7/65) | 17.6% (6/34) |
| 95%信頼区間 | 4.4-20.9 | 6.8-34.5 |
なお、Major bleedingが認められた症例はなかった。
78例中13例(16.7%)に臨床検査値異常を含む副作用が認められた。その主なものは、出血4例(5.1%)、肝機能障害3例(3.8%)、発疹3例(3.8%)であった。
78例中13例(16.7%)に臨床検査値異常を含む副作用が認められた。その主なものは、出血4例(5.1%)、肝機能障害3例(3.8%)、発疹3例(3.8%)であった。
注)本剤の承認された用法・用量は、2.5mgを1日1回皮下投与、腎障害のある患者に対しては、腎機能の程度に応じて1.5mgを1日1回皮下投与である。
18. 薬効薬理
18.1 作用機序
18.2 静脈血栓症モデルに対する効果
ラットのトロンボプラスチン誘発静脈血栓症モデルにおいて、フォンダパリヌクスナトリウムは皮下投与により大静脈内の血栓形成を抑制し、そのED50は0.20mg/kgであった。ラットの大静脈狭窄血栓症モデル及び大静脈非狭窄血栓症モデルにおいて、静脈内投与により血栓形成を抑制し、それらのED50は0.028mg/kg及び0.074mg/kgであった。ウサギのWesslerうっ血性血栓症モデルにおいて、0.17mg/kg以上の皮下投与により、頸静脈内の血栓形成を抑制した10)。
18.3 止血に及ぼす影響
ラットの皮下出血モデルにおいて、フォンダパリヌクスナトリウムはヘパリンより軽度の、用量依存性のない出血率の増加を示したが、ラットにおける治療係数(皮下出血率を3倍に増加させる用量/血栓形成を50%抑制する用量)はヘパリンや低分子ヘパリンより高値を示した。フォンダパリヌクスナトリウムはマウス及びラットの尾先端切断による出血を増大させたが、その作用はプロタミン硫酸塩の投与により、血栓形成抑制作用に影響することなく抑制された11)。
18.4 HIT抗体との交差反応性
18.5 ヒト血液凝固時間に及ぼす影響
19. 有効成分に関する理化学的知見
19.1. フォンダパリヌクスナトリウム
20. 取扱い上の注意
内容液に着色や浮遊物等の異常が認められないことを確認すること。
22. 包装
<アリクストラ皮下注1.5mg>
10シリンジ(0.3mL)[注射針:27ゲージ]
<アリクストラ皮下注2.5mg>
10シリンジ(0.5mL)[注射針:27ゲージ]
23. 主要文献
- Lagrange F,et al., Thromb Haemost., 87, 831-835, (2002) »PubMed
- 社内資料:薬物動態試験(2007年4月18日承認、CTD2.7.2.3.1)
- Paolucci F,et al., Clin Pharmacokinet., 41, 11-18, (2002) »PubMed
- Lieu C,et al., Clin Pharmacokinet., 41, 19-26, (2002) »PubMed
- 社内資料:待機的膝関節全置換術施行患者を対象とした第II/III相臨床試験(2007年4月18日承認、CTD2.7.6.3.1.1)
- 社内資料:待機的股関節全置換術施行患者を対象とした第II/III相臨床試験(2007年4月18日承認、CTD2.7.6.3.1.2)
- 社内資料:待機的股関節全置換術施行患者を対象とした第III相臨床試験(2007年4月18日承認、CTD2.7.6.3.1.10)
- 社内資料:股関節骨折手術施行患者を対象とした第III相臨床試験(2007年4月18日承認、CTD2.7.6.3.2.1)
- Olson ST,et al., J Biol Chem., 267, 12528-12538, (1992) »PubMed
- 社内資料:静脈血栓症モデルに対する効果(2007年4月18日承認、CTD2.6.2.2)
- 社内資料:止血に及ぼす影響(2007年4月18日承認、CTD2.6.2.3)
- 社内資料:PF4との結合親和性及びHIT抗体に対する交差反応性(2007年4月18日承認、CTD2.6.2.3)
- 社内資料:臨床薬力学試験(2007年4月18日承認、CTD2.7.2.3.2)
24. 文献請求先及び問い合わせ先
文献請求先
サンド株式会社
カスタマーケアグループ
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-982-001
FAX:03-6257-3633
製品情報問い合わせ先
サンド株式会社
カスタマーケアグループ
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-982-001
FAX:03-6257-3633
26. 製造販売業者等
26.1 製造販売
26.2 販売
その他の説明
その他の説明
参考注)
| リスクレベル | 一般外科 | 泌尿器科 | 婦人科 | 産科 | 予防法 | 整形外科 | 予防法 |
| 低リスク | 60歳未満の非大手術 40歳未満の大手術 | 60歳未満の非大手術 40歳未満の大手術 | 30分以内の小手術 | 正常分娩 | 早期離床および積極的な運動 | 上肢の手術 | 早期離床および積極的な運動 (特別な予防の必要なし) |
| 中リスク | 60歳以上、あるいは危険因子がある非大手術 40歳以上、あるいは危険因子がある大手術 | 60歳以上、あるいは危険因子がある非大手術 40歳以上、あるいは危険因子がある大手術 | 良性疾患手術(開腹、経膣、腹腔鏡) 悪性疾患で良性疾患に準じる手術 ホルモン療法中の患者に対する手術 | 帝王切開術(高リスク以外) | 弾性ストッキングあるいは間欠的空気圧迫法 | 脊椎手術 骨盤・下肢手術*(THR、TKR、股関節骨折手術を除く) | 弾性ストッキングあるいは間欠的空気圧迫法☆ |
| 高リスク | 40歳以上の癌の大手術 | 40歳以上の癌の大手術 | 骨盤内悪性腫瘍根治術(静脈血栓塞栓症の既往あるいは血栓性素因のある)良性疾患手術 | 高齢肥満妊婦の帝王切開術 | 間欠的空気圧迫法あるいは低用量未分画ヘパリン | THR TKR 股関節骨折手術** | 間欠的空気圧迫法あるいは抗凝固療法☆☆(低用量未分画ヘパリンなど) |
| 最高リスク | 静脈血栓塞栓症の既往あるいは血栓性素因のある大手術 | 静脈血栓塞栓症の既往あるいは血栓性素因のある大手術 | 静脈血栓塞栓症の既往あるいは血栓性素因のある大手術 | 静脈血栓塞栓症の既往あるいは血栓性素因のある帝王切開術 | (低用量未分画ヘパリンと間欠的空気圧迫法の併用)あるいは(低用量未分画ヘパリンと弾性ストッキングの併用) | 「高」リスクの手術を受ける患者に、静脈血栓塞栓症の既往、血栓性素因が存在する場合 | [抗凝固療法(低用量未分画ヘパリンなど)と間欠的空気圧迫法の併用]あるいは[抗凝固療法(低用量未分画ヘパリンなど)と弾性ストッキングの併用] |
総合的なリスクレベルは、予防の対象となる疾患や手術・処置や疾患のリスクに、付加的な危険因子を加味して決定される。例えば、強い付加的な危険因子をもつ場合にはリスクレベルを上げる必要があり、弱い付加的な危険因子の場合でも複数個重なればリスクレベルを上げることを考慮する。
婦人科・産科ではBMI、年齢、合併症等の他の危険因子により、全体のリスクを上げる必要がある。(BMI:body mass index)
リスクを高める付加的な危険因子:血栓性素因、静脈血栓塞栓症の既往、悪性疾患、癌化学療法、重症感染症、中心静脈カテーテル留置、長期臥床、下肢麻痺、下肢ギプス包帯固定、ホルモン療法、肥満、下肢静脈瘤など。(血栓性素因:先天性素因としてアンチトロンビン欠損症、プロテインC欠損症、プロテインS欠損症など、後天性素因として抗リン脂質抗体症候群などを示す。)
大手術の厳密な定義はないが、すべての腹部手術あるいはその他の45分以上要する手術を大手術の基本とし、麻酔法、出血量、輸血量、手術時間などを参考として総合的に評価する。
(低用量未分画ヘパリンと間欠的空気圧迫法の併用)や(低用量未分画ヘパリンと弾性ストッキングの併用)の代わりに、用量調節未分画ヘパリンや用量調節ワルファリンを選択してもよい。
婦人科・産科ではBMI、年齢、合併症等の他の危険因子により、全体のリスクを上げる必要がある。(BMI:body mass index)
リスクを高める付加的な危険因子:血栓性素因、静脈血栓塞栓症の既往、悪性疾患、癌化学療法、重症感染症、中心静脈カテーテル留置、長期臥床、下肢麻痺、下肢ギプス包帯固定、ホルモン療法、肥満、下肢静脈瘤など。(血栓性素因:先天性素因としてアンチトロンビン欠損症、プロテインC欠損症、プロテインS欠損症など、後天性素因として抗リン脂質抗体症候群などを示す。)
大手術の厳密な定義はないが、すべての腹部手術あるいはその他の45分以上要する手術を大手術の基本とし、麻酔法、出血量、輸血量、手術時間などを参考として総合的に評価する。
(低用量未分画ヘパリンと間欠的空気圧迫法の併用)や(低用量未分画ヘパリンと弾性ストッキングの併用)の代わりに、用量調節未分画ヘパリンや用量調節ワルファリンを選択してもよい。
THR:股関節全置換術、TKR:膝関節全置換術
*骨盤・下肢手術における弾性ストッキングや間欠的空気圧迫法は、部位によっては施行不能であるため、早期離床・早期荷重・積極的運動のみでの予防もやむを得ない。
**股関節骨折手術においては確立した予防法がないため、本文を参考に可能な予防法を実施する。
なお、キアリ骨盤骨切り術や寛骨臼回転骨切り術については、THRでの予防に準じる。
間欠的空気圧迫法☆の使用は肺血栓塞栓症誘発のリスクを考慮し、また抗凝固療法☆☆は出血性合併症のリスクを考慮して、十分に説明し同意を得たうえで実施する。実施にあたっては本文を参照すること。
間欠的空気圧迫法☆の使用は肺血栓塞栓症誘発のリスクを考慮し、また抗凝固療法☆☆は出血性合併症のリスクを考慮して、十分に説明し同意を得たうえで実施する。実施にあたっては本文を参照すること。
注)肺血栓塞栓症/深部静脈血栓症(静脈血栓塞栓症)予防ガイドライン第1版(肺血栓塞栓症/深部静脈血栓症(静脈血栓塞栓症)予防ガイドライン作成委員会)より抜粋