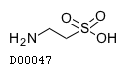医薬品情報
| 総称名 | タウリン |
|---|---|
| 一般名 | タウリン |
| 欧文一般名 | taurine |
| 製剤名 | タウリン製剤 |
| 薬効分類名 | 肝・循環機能改善剤 MELAS脳卒中様発作抑制剤 |
| 薬効分類番号 | 1190 2119 3919 |
| KEGG DRUG |
D00047
タウリン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第1版)

|
4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| タウリン散98%「大正」 | Taurine powder 98%"Taisho" | 大正製薬 | 3919006B1034 | 14.8円/g |
4. 効能または効果
5. 効能または効果に関連する注意
MELAS症候群における脳卒中様発作の抑制においては、臨床試験に組み入れられた患者のミトコンドリア遺伝子の変異型について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
6. 用法及び用量
<高ビリルビン血症(閉塞性黄疸を除く)における肝機能の改善、うっ血性心不全>
タウリンとして、成人1回1gを1日3回食後に経口投与する。なお、うっ血性心不全に用いる場合、本剤は強心利尿剤で十分な効果が認められないときに、それと併用すること。
<ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作(MELAS)症候群における脳卒中様発作の抑制>
タウリンとして、下表の1回量を1日3回食後に経口投与する。
| 体重 | 1回量 |
| 15kg未満 | 1g |
| 15kg以上25kg未満 | 2g |
| 25kg以上40kg未満 | 3g |
| 40kg以上 | 4g |
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
<MELAS症候群における脳卒中様発作の抑制>
血中濃度が上昇するおそれがある。
9.7 小児等
<MELAS症候群における脳卒中様発作の抑制>
新生児、乳児、幼児及び13歳以下の小児を対象とした臨床試験は実施していない。一般に新生児及び2歳未満の乳児においては体表面積あたりのGFRが低いことから排泄されずに血中濃度が上昇するおそれがある。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
11. 副作用
11.2 その他の副作用
| 頻度不明注1) | |
| 消化器 | 悪心、下痢、腹部不快感、便秘、軟便、食欲減退 |
| 過敏症 | 発疹 |
| その他 | 脱力感 |
| 20%以上注2) | 20%未満注2) | |
| 精神神経系 | 不眠症 | |
| 消化器 | 口内炎 | 便秘、下痢、胃食道逆流性疾患、裂孔ヘルニア、胃腸炎、食欲減退 |
| その他 | 頻尿、四肢痛、γ-グルタミルトランスフェラーゼ増加、血中クレアチンホスホキナーゼ増加 |
16. 薬物動態
16.1 血中濃度
健康成人にタウリンとして2gを空腹時単回経口投与した場合、投与約1時間後で最高血中濃度84μg/mLに達し、7時間後には通常の生体内濃度にまで減少した。血中濃度半減期は約2時間であった1)。
16.3 分布
ラットへの経口投与による検討では、投与3時間後で投与量の約20%が肝臓に取り込まれ、腎臓には30分後に約7%が分布し以後急速に低下した。一方、心臓、骨格筋では経日的に徐々に増加するが、脳・脊髄系にはほとんど取り込まれなかった2)。
16.4 代謝
16.5 排泄
経口投与した場合、主に未変化体として尿中に排泄され、糞中には、投与量の2%以下が排泄されたのみであった4)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<高ビリルビン血症(閉塞性黄疸を除く)における肝機能の改善>
17.1.1 国内二重盲検比較試験
血清ビリルビン5mg/dL以上の急性肝炎を対象にタウリンとして3g/日を6週間投与した二重盲検比較試験を行った結果、肝機能改善度は「改善」以上が75.4%(49/65例)、「軽度改善」以上が100%(65/65例)であり、AST、ALTの改善が認められた。副作用は消化器症状(4/96例)、発疹(2/96例)であった5)。
<うっ血性心不全>
17.1.2 国内二重盲検比較試験
うっ血性心不全を対象にタウリンとして3g/日を6週間投与した二重盲検比較試験を行った結果、本剤の有用性が認められ、全般改善度において「中等度改善」以上が26.7%(12/45例)、「軽度改善」以上が73.3%(33/45例)であった。副作用は認められなかった6)。
<MELAS症候群における脳卒中様発作の抑制>
17.1.3 国内第III相試験
MELAS症候群患者注)(10例)を対象に、タウリンとして、それぞれ12g/日(体重40kg以上)、9g/日(体重25kg以上40kg未満)、6g/日(体重15kg以上25kg未満)又は3g/日(体重15kg未満)を52週間投与し、主要評価項目である投与開始9週以降52週までの44週間での脳卒中様発作回数が0回であった症例の割合は60%(6/10例)であった。また、変異型別の脳卒中様発作回数が0回であった症例の割合はA3243Gが55.6%(5/9例)、T3271Cが100%(1/1例)であった7)。副作用は、10例のうち6例(60%)に認められた。便秘、下痢、胃食道逆流性疾患、裂孔ヘルニア、口内炎、胃腸炎、γ-グルタミルトランスフェラーゼ増加、食欲減退、不眠症及び頻尿が各1例に認められた8)。
注)対象とされた変異型は、ミトコンドリアtRNALeu(UUR)遺伝子領域のA3243G、T3271C、G3244A、T3258C及びT3291C変異型であり、臨床試験に組み入れられた変異型はA3243G(9例)及びT3271C(1例)であった7)。
18. 薬効薬理
18.1 作用機序
<高ビリルビン血症(閉塞性黄疸を除く)における肝機能の改善>
肝臓に対し、胆汁酸の抱合体形成に関与して胆汁酸分泌を亢進させる。さらに、肝細胞保護作用、肝細胞賦活作用(肝細胞の再生促進、肝ATPの増加)を有しており、これらの作用により、肝機能異常を改善する。
<うっ血性心不全>
心臓に対し、心筋におけるCa2+動態を調節することで心筋の収縮力を調節するとともに、心筋保護・心筋代謝改善作用を合わせ持ち、心機能の低下を包括的に改善させる。
<MELAS症候群における脳卒中様発作の抑制>
MELAS症候群の発症機序と発症における体内のタウリンの関与について、現時点で詳細に解明されていないものの、タウリン大量投与によりタウリン修飾が改善することでミトコンドリアの機能を改善する機序が考えられる。MELASモデル培養細胞をタウリン存在下で培養した結果、酸素消費量及びミトコンドリアの膜電位で改善が認められたことから、脳軟膜における小動脈の血管内皮細胞及び血管平滑筋細胞等におけるミトコンドリアの機能異常がタウリンにより改善すると考えられる。
18.2 胆汁酸排泄促進作用
ウサギに経口投与した場合、肝胆汁量及び総胆汁量は投与後3〜6時間で約2倍に増加し、また単位胆汁量中胆汁酸濃度、単位時間内胆汁酸排泄量は、ともに増加した9)。
18.3 実験的肝障害に及ぼす影響
四塩化炭素及び黄リン投与による肝障害ウサギに経口投与し、その肝機能の経過を観察したところ、Al-P、γ-グロブリン、BSP、血清コレステロール/血清コレステロールエステル比を改善させた。
また、病理組織学的検討では、肝臓の毒性障害を急速に改善し、肝細胞の再生を促進して組織像を改善させた。さらに慢性障害群においては間質の結合組織増殖を抑制した10)。
また、病理組織学的検討では、肝臓の毒性障害を急速に改善し、肝細胞の再生を促進して組織像を改善させた。さらに慢性障害群においては間質の結合組織増殖を抑制した10)。
18.4 虚血、低酸素条件下における肝機能の恒常性維持
ラット灌流肝を用いた実験において、虚血や低酸素時にみられる肝ATPの低下を軽減することにより、胆汁分泌などの肝細胞機能維持に働いた11)。
18.5 心筋に対する作用
18.6 心筋代謝改善作用・心筋保護作用
18.7 実験的慢性心不全に対する効果
ウサギを用いた大動脈弁閉鎖不全による慢性うっ血性心不全において死亡率の低下を示した17)。
18.8 MELASモデル培養細胞における作用
MELASモデル培養細胞(Cybrid細胞)において、酸素消費量、膜電位、酸化状態の改善が認められた18)(in vitro)。
19. 有効成分に関する理化学的知見
19.1. タウリン
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
1kg[500g×2]
分包1.02g×90包
23. 主要文献
- 社内資料(薬物動態・吸収に関する資料)
- 岩田平太郎ほか, 応用薬理, 16 (2), 179-187, (1978)
- Jacobsen JG, et al., Nature., 214, 1247-1248, (1967) »PubMed
- Wainer A, et al., Proc Soc Exp Biol Med., 121, 212-216, (1966) »PubMed
- 伊藤 圓ほか, 肝胆膵, 10 (5), 819-833, (1985)
- 山村雄一ほか, 医学のあゆみ, 147 (2), 141-158, (1988)
- 砂田芳秀, 厚生労働科学研究費補助金 難治性疾患等実用化研究事業 ミトコンドリア脳筋症MELASの脳卒中様発作に対するタウリン療法の開発(H24-難治等(難)-一般-068)平成24〜26年度総合研究報告書, (2015)
- 社内資料:第III相試験(2019年2月21日承認、CTD 2.5.5.1)
- 三宅 博ほか, 福岡医学雑誌, 53, 695-702, (1962)
- 松岡武恒, 長崎医学会雑誌, 35, 352-365, (1960)
- 中島年和ほか, 含硫アミノ酸, 10 (2), 259-264, (1987)
- Awata N, et al., Cardiovascular Res., 21, 241-247, (1987) »PubMed
- Franconi F, et al., Biochem Pharmacol., 31 (20), 3181-3185, (1982) »PubMed
- Kramer JH, et al., Am J Physiol., 240 (2), H238-H246, (1981)
- Schaffer SW, et al., Sulfur Amino Acids:Biochemical and Clinical Aspects, 39-50, (1983), (Alan R Liss, Inc., New York)
- Franconi F, et al., Taurine:Biological Actions and Clinical Perspectives, 177-182, (1985), (Alan RLiss, Inc., New York)
- Azuma J, et al., Res Commun Chem Pathol Pharm., 45, 261-270, (1984)
- Rikimaru M, et al., Intern Med., 51 (24), 3351-3357, (2012) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
大正製薬株式会社
メディカルインフォメーションセンター
〒170-8633
東京都豊島区高田3-24-1
電話:0120-591-818
製品情報問い合わせ先
大正製薬株式会社
メディカルインフォメーションセンター
〒170-8633
東京都豊島区高田3-24-1
電話:0120-591-818
26. 製造販売業者等
26.1 製造販売
大正製薬株式会社
東京都豊島区高田3-24-1