医薬品情報
| 総称名 | メタルカプターゼ |
|---|---|
| 一般名 | ペニシラミン |
| 欧文一般名 | penicillamine |
| 製剤名 | ペニシラミン製剤 |
| 薬効分類名 | ウイルソン病治療剤 金属解毒剤 |
| 薬効分類番号 | 3929 |
| ATCコード | M01CC01 |
| KEGG DRUG |
D00496
ペニシラミン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第2版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| メタルカプターゼカプセル200mg | METALCAPTASE capsules 200mg | 大正製薬 | 3929001M3031 | 63.1円/カプセル | 処方箋医薬品注) |
1. 警告
無顆粒球症等の重篤な血液障害等が起こることがあるので、使用上の注意に特に留意すること。[11.1.1参照]
2. 禁忌
次の患者には投与しないこと
金剤が投与されている患者[10.1参照]
4. 効能または効果
6. 用法及び用量
<ウイルソン病(肝レンズ核変性症)>
通常、成人にはペニシラミンとして1日1,000mgを食前空腹時に1〜数回に分けて経口投与する。
なお、患者の年齢、症状、忍容性、本剤に対する反応等に応じて、一般に1日量600〜1,400mgの範囲で増減し、また、投与法についても、連日投与、間歇投与、漸増投与法など各症例ごとに用法及び用量を決定する。
なお、患者の年齢、症状、忍容性、本剤に対する反応等に応じて、一般に1日量600〜1,400mgの範囲で増減し、また、投与法についても、連日投与、間歇投与、漸増投与法など各症例ごとに用法及び用量を決定する。
<鉛・水銀・銅の中毒>
通常、成人にはペニシラミンとして1日1,000mgを食前空腹時に数回に分けて経口投与する。なお、患者の年齢、症状、忍容性、本剤に対する反応等に応じて、一般に1日量600〜1,400mgの範囲で増減し、また、投与法についても、連日投与、間歇投与、漸増投与法など各症例ごとに用法及び用量を決定する。
通常、小児にはペニシラミンとして1日20〜30mg/kgを食前空腹時に数回に分けて経口投与する。なお、患者の年齢、症状、忍容性、本剤に対する反応等に応じて適宜増減する。ただし、1日量は、成人の標準用量(1日1,000mg)を上限とする。
通常、小児にはペニシラミンとして1日20〜30mg/kgを食前空腹時に数回に分けて経口投与する。なお、患者の年齢、症状、忍容性、本剤に対する反応等に応じて適宜増減する。ただし、1日量は、成人の標準用量(1日1,000mg)を上限とする。
7. 用法及び用量に関連する注意
1日当たり1,000mgを超えて使用する場合、100mgカプセルの1日最大使用カプセル数は、10カプセル(1,000mg)を上限とし、50mgカプセル、200mgカプセルと組み合わせて使用すること。100mgカプセルの1日使用カプセル数が10カプセルを超える場合、100mgカプセルの添加剤である赤色3号の許容一日摂取量1)を超える。
8. 重要な基本的注意
<鉛・水銀・銅の中毒>
8.1 鉛中毒患者に対する本剤の使用は、重症の場合には静注キレート剤による初期治療後の補助的治療とし、無症状で血中鉛濃度が40〜60μg/dL以上に上昇した場合には単独療法とすること。
また、血中鉛濃度が40〜60μg/dL未満まで減少した場合には、本剤の投与中止を検討すること。ただし、他のキレート剤において、投与中止後に血中鉛濃度のリバウンドが報告されているので、本剤中止後も1〜2週間は定期的に血中鉛濃度を測定し、リバウンドが認められた場合には本剤の投与を検討すること。
なお、小児の精神神経系は成人より鉛の影響を受けやすく、低い鉛濃度でも、持続した場合には脳症が発現する危険性が高くなるので、観察を十分行うこと。
その他の金属中毒に対し本剤を使用する場合は、投与開始及び中止に関する血中金属濃度の指標は明確でないため、臨床症状、健康へ及ぼす影響等を十分に検討すること。
また、血中鉛濃度が40〜60μg/dL未満まで減少した場合には、本剤の投与中止を検討すること。ただし、他のキレート剤において、投与中止後に血中鉛濃度のリバウンドが報告されているので、本剤中止後も1〜2週間は定期的に血中鉛濃度を測定し、リバウンドが認められた場合には本剤の投与を検討すること。
なお、小児の精神神経系は成人より鉛の影響を受けやすく、低い鉛濃度でも、持続した場合には脳症が発現する危険性が高くなるので、観察を十分行うこと。
その他の金属中毒に対し本剤を使用する場合は、投与開始及び中止に関する血中金属濃度の指標は明確でないため、臨床症状、健康へ及ぼす影響等を十分に検討すること。
8.2 効果が得られるためには、排泄するための十分な尿量が必要であるので、投与前には必ずクレアチニン等の腎機能検査を実施すること。また、投与中も定期的(1〜2週間に1回)に検査を行い、腎機能の低下が認められた場合には、血液透析の併用を考慮すること。[9.2.2参照]
8.3 本剤の副作用発現頻度は用量依存的に上昇する可能性があり、また重篤な副作用報告があるので、本剤の投与は治療上の有益性が危険性を上回ると判断される場合のみとし、漫然と投与しないこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 血液障害のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。重篤な血液障害を起こすおそれがある。[11.1.1参照]
9.1.2 血液障害の既往のある患者
血液障害を起こすおそれがあるので血液検査を定期的に行うこと。
9.1.3 SLEの患者
治療上やむを得ないと判断される場合を除き、投与しないこと。SLEの症状を悪化させるおそれがある。[11.1.5参照]
9.1.4 ペニシリン系薬剤に対して過敏症の既往のある患者
9.2 腎機能障害患者
9.2.1 腎機能障害のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。重篤な腎機能障害を起こすおそれがある。[11.1.1参照]
9.2.2 腎機能障害の既往のある患者
腎機能障害を起こすおそれがあるので尿蛋白等の腎機能検査を定期的に行うこと。[8.2参照]
9.3 肝機能障害患者
肝機能異常を起こすおそれがあるので肝機能検査値に注意すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上やむを得ないと判断される場合にのみ投与すること。ヒトで催奇形性を疑う症例報告がある。
9.6 授乳婦
授乳しないことが望ましい。動物試験(ラット)において乳汁移行が認められ、出生児の死亡数増加及び成長遅延が認められている。
9.7 小児等
9.7.1 成長期の小児で結合組織の代謝障害のある児
治療上やむを得ないと判断される場合を除き、投与しないこと。結合組織異常を起こすおそれがある。
9.7.2 「9.7.1 成長期の小児で結合組織の代謝障害のある児」以外の児
<ウイルソン病(肝レンズ核変性症)>
治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。小児等を対象とした臨床試験は実施していない。
<鉛・水銀・銅の中毒>
低出生体重児、新生児及び乳児には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。低出生体重児、新生児及び乳児を対象とした臨床試験は実施していない。
9.8 高齢者
重篤な血液障害等を起こすおそれがある。一般に生理機能が低下している。[11.1.1参照]
10. 相互作用
10.1 併用禁忌
| 金チオリンゴ酸ナトリウム 〔シオゾール〕 オーラノフィン [2.参照] | 重篤な血液障害が発現するおそれがある。 | 機序は不明である。 |
10.2 併用注意
| 免疫抑制剤 | 副作用が増強するおそれがある。 | 機序は不明である。 |
| 経口鉄剤2) 〔クエン酸第一鉄ナトリウム 硫酸鉄 等〕 [16.7.1参照] | 本剤の効果を減弱するおそれがあるので、やむを得ず投与する場合には、本剤との同時投与は避けること。 | 同時投与した場合、本剤の吸収率が低下するとの報告がある。 |
| マグネシウム又はアルミニウムを含有する制酸剤 〔水酸化マグネシウム2) 水酸化アルミニウム2)〕 [16.7.1参照] | 本剤の効果を減弱するおそれがあるので、やむを得ず投与する場合には、本剤との同時投与は避けること。 | 同時投与した場合、本剤の吸収率が低下するとの報告がある。 |
| 亜鉛を含有する経口剤 | 本剤の効果を減弱するおそれがあるので、やむを得ず投与する場合には、本剤との同時投与は避けること。 | 同時投与した場合、本剤が吸収される前に亜鉛とキレート化され、本剤の吸収率が低下する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 白血球減少症、無顆粒球症、顆粒球減少症、好酸球増多症、血小板減少症、再生不良性貧血、貧血(低色素性貧血、溶血性貧血等)、汎血球減少症、血栓性血小板減少性紫斑病(モスコビッチ症候群)、ネフローゼ症候群(膜性腎症等)(いずれも頻度不明)[1.、9.1.1、9.2.1、9.8、10.1参照]
11.1.2 肺胞炎、間質性肺炎・PIE(好酸球性肺浸潤)症候群、閉塞性細気管支炎(いずれも頻度不明)
症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.3 グッドパスチュア症候群(頻度不明)
尿所見の異常と喀血やX線での肺浸潤が関連して認められた場合には、直ちに投与を中止すること。
11.1.4 味覚脱失、視神経炎(いずれも頻度不明)
11.1.5 SLE様症状、天疱瘡様症状、重症筋無力症(いずれも頻度不明)[9.1.3参照]
11.1.6 神経炎、ギランバレー症候群を含む多発性神経炎(いずれも頻度不明)
11.1.7 多発性筋炎、筋不全麻痺(いずれも頻度不明)
11.1.8 血栓性静脈炎、アレルギー性血管炎、多発性血管炎(いずれも頻度不明)
血栓性静脈炎、アレルギー性血管炎(白血球破砕性血管炎等)、肺・腎臓等に多様な臓器障害を引き起こし、血清学的に抗好中球細胞質抗体(MPO-ANCA)陽性であることを特徴とする多発性血管炎等があらわれることがあるので、このような場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.9 胆汁うっ滞性肝炎(頻度不明)
関節リウマチ患者を対象とした承認時の国内臨床試験及び製造販売後調査の結果に基づいている。
11.2 その他の副作用
| 頻度不明 | |
| 精神神経系 | めまい、頭痛、知覚障害、眼瞼下垂、昏迷、痙攣 |
| 感覚器 | 味覚異常、耳鳴、視力異常、複視、白内障、聴力低下 |
| 消化器 | 口内炎・口角炎、腹痛、食欲不振、嘔気、嘔吐、下痢、消化性潰瘍、舌炎、消化不良、口内乾燥、胃炎、口唇炎、下血、歯肉炎、便秘、膵炎 |
| 皮膚 | 発疹、そう痒、脱毛、皮膚炎、紫斑、潮紅、皮下出血、結節性紅斑、多形紅斑、創傷治癒障害、穿孔性弾力線維症、爪の異常 |
| 肝臓 | 肝機能障害(AST、ALT上昇等)、黄疸 |
| 腎臓 | 腎機能障害(尿蛋白、血尿、BUN上昇、クレアチニン上昇)、腎炎 |
| 血液 | 鼻出血、リンパ球減少、白血球増多 |
| 血管 | 毛細血管脆弱 |
| 免疫グロブリン | 免疫グロブリン(IgA、IgG、IgM)減少注1) |
| 筋・骨格 | 関節痛、筋肉痛 |
| その他 | 浮腫、発熱、倦怠感、咽頭炎、無力症、動悸、体重減少、疼痛、陰門びらん、体重増加、ビタミンB6欠乏注2)、乳房肥大、尿失禁 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
健康成人に200mgを空腹時単回経口投与した場合、血中濃度パラメータは以下のとおりであった3)。
| Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC(μg・hr/mL) | |
| 成人(n=12) | 0.62 | 1.8 | 2.3 | 2.17 |
16.2 吸収
16.2.1 食事の影響
16.3 分布
16.4 代謝
健康成人に200mgを単回経口投与した場合、尿中主代謝物はペニシラミン-システインであり、ペニシラミンジスルフィドも検出された6)。
16.5 排泄
健康成人に200mgを単回経口投与した場合、投与後24時間までの総ペニシラミンの尿中排泄率は投与量の35.2%であった6)。
16.7 薬物相互作用
16.7.1 経口鉄剤、マグネシウム又はアルミニウムを含有する制酸剤
健康成人(n=6)に非併用時、空腹時鉄剤服用直後、空腹時制酸剤(水酸化マグネシウム及び水酸化アルミニウム含有)服用直後に、ペニシラミン500mgを単回経口投与した場合、ペニシラミンの血中濃度パラメータは以下のとおりであった2)。
ペニシラミンのT1/2は各群で有意差は認められないものの、鉄剤服用後及び制酸剤服用後のCmax及びAUCは非併用時に比べ1/2〜1/6に低下した2)(外国人データ)。[10.2参照]
ペニシラミンのT1/2は各群で有意差は認められないものの、鉄剤服用後及び制酸剤服用後のCmax及びAUCは非併用時に比べ1/2〜1/6に低下した2)(外国人データ)。[10.2参照]
| Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC(μg・hr/mL) | |
| 非併用時 | 3.05 | 3.8 | 2.1 | 14.7 |
| 鉄剤併用 | 1.00 | 1.3 | 1.2 | 2.6 |
| 制酸剤併用 | 1.72 | 3.0 | 1.5 | 7.0 |
18. 薬効薬理
18.1 作用機序
ペニシラミンが重金属とキレート化合物を生成しその排泄を促進させる。
18.2 キレート形成作用
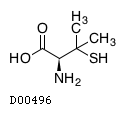
19. 有効成分に関する理化学的知見
19.1. ペニシラミン
22. 包装
PTP 100カプセル[10カプセル×10]
23. 主要文献
- 令和6年度第11回薬事審議会医薬品等安全対策部会安全対策調査会 参考資料2-2, (2025)
- Osman MA,et al., Clin Pharmacol Ther., 33 (4), 465-470, (1983) »PubMed
- 社内資料:血中濃度に関する資料
- 野津隆司ほか, 応用薬理, 14 (2), 265-276, (1977)
- 野津隆司ほか, 応用薬理, 14 (2), 277-287, (1977)
- 社内資料:尿中排泄に関する資料
- Walshe JM, Clin Sci., 26, 461-469, (1964) »PubMed
- Hammond PB, Toxicol Appl Pharmacol., 26, 241-246, (1973) »PubMed
- Tandon SK,et al., Toxicol Appl Pharmacol., 79, 204-210, (1985) »PubMed
- 島田秀昭ほか, 薬学雑誌, 108 (12), 1209-1214, (1988) »DOI
- Kiyozumi M,et al., Chem Pharm Bull., 36 (7), 2599-2606, (1988) »DOI
- Shimada H,et al., Toxicology., 77, 157-169, (1993) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
大正製薬株式会社
メディカルインフォメーションセンター
〒170-8633
東京都豊島区高田3-24-1
電話:0120-591-818
製品情報問い合わせ先
大正製薬株式会社
メディカルインフォメーションセンター
〒170-8633
東京都豊島区高田3-24-1
電話:0120-591-818
26. 製造販売業者等
26.1 製造販売
大正製薬株式会社
東京都豊島区高田3-24-1
26.2 提携
ドイツ・ハイル社