医薬品情報
| 総称名 | アクラシノン |
|---|---|
| 一般名 | アクラルビシン塩酸塩 |
| 欧文一般名 | Aclarubicin Hydrochloride |
| 製剤名 | 注射用アクラルビシン塩酸塩 |
| 薬効分類名 | 抗腫瘍性抗生物質製剤 |
| 薬効分類番号 | 4235 |
| ATCコード | L01DB04 |
| KEGG DRUG |
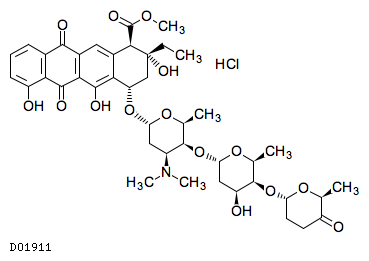
D01911
アクラルビシン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アクラシノン注射用20mg | Aclacinon 20mg for Injection | 日本マイクロバイオファーマ | 4235400D1030 | 2136円/瓶 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 心機能異常又はその既往歴のある患者[心筋障害があらわれることがある。]
2.2 本剤の成分に対し重篤な過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
2)投与方法
<固形癌及び悪性リンパ腫>
[1]アクラルビシン塩酸塩として1日量40〜50mg(力価)(0.8〜1.0mg(力価)/kg)を1週間に2回、1、2日連日または1、4日に静脈内ヘワンショット投与または点滴投与する。
[2]アクラルビシン塩酸塩として1日量20mg(力価)(0.4mg(力価)/kg)を7日間連日静脈内へワンショット投与または点滴投与後、7日間休薬し、これを反復する。
<急性白血病>
アクラルビシン塩酸塩として1日量20mg(力価)(0.4mg(力価)/kg)を10〜15日間連日静脈内へワンショットまたは点滴投与する。
8. 重要な基本的注意
<効能共通>
8.1 骨髄抑制、心筋障害等の重篤な副作用が起こることがあるので頻回に臨床検査(血液検査、肝機能・腎機能検査、心機能検査等)を行うなど、患者の状態を十分に観察すること。また、使用が長期にわたると副作用が強くあらわれ、遷延性に推移することがあるので投与は慎重に行うこと。[9.1.1、9.1.2、9.1.4、11.1.1、11.1.2参照]
8.2 感染症、出血傾向の発現又は悪化に十分注意すること。
<急性白血病>
8.3 末梢血液及び骨髄所見を随時検査し、投与期間を短縮又は延長すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄抑制のある患者
9.1.2 感染症を合併している患者
9.1.3 水痘患者
致命的な全身障害があらわれるおそれがある。
9.1.4 アントラサイクリン系薬剤投与後の患者
アントラサイクリン系薬剤投与後症例に本剤を投与する場合、本剤の総投与量が600mg(力価)以上になる例では心電図異常の発現が増加するので注意すること。[11.1.1参照]
9.2 腎機能障害患者
副作用が強くあらわれるおそれがある。
9.3 肝機能障害患者
副作用が強くあらわれるおそれがある。
9.4 生殖能を有する者
小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.5 妊婦
9.7 小児等
副作用の発現に特に注意し、慎重に投与すること。小児等を対象とした臨床試験は実施していない。
9.8 高齢者
用量に留意して患者の状態を観察しながら慎重に投与すること。本剤は主として肝臓で代謝されるが、高齢者では肝機能等の生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| 投与前の心臓部あるいは縦隔への放射線照射 潜在的に心毒性を有する他の抗悪性腫瘍剤 アントラサイクリン系薬剤等 | 心筋障害が増強されるおそれがある。 | 心筋に対する蓄積毒性が増強される。 |
| 他の抗悪性腫瘍剤 放射線照射 | 骨髄抑制等の副作用が増強することがある。 | 副作用が相互に増強される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 心筋障害(頻度不明)
11.1.2 骨髄抑制
11.1.3 ショック(頻度不明)
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 心臓 | 心電図異常 | 頻脈、不整脈 | |
| 消化器 | 食欲不振(44.4%)、悪心(43.6%)、嘔吐(35.8%)、口内炎、下痢 | 腹痛、胃部不快感 | 消化管出血 |
| 肝臓 | AST上昇、ALT上昇、Al-P上昇等 | ||
| 腎臓 | 蛋白尿等 | ||
| 泌尿器 | 血尿、膀胱炎、排尿痛、尿意頻数、残尿感等 | ||
| 過敏症 | 発疹 | ||
| 皮膚 | 脱毛、色素沈着 | ||
| 精神神経系 | 全身倦怠(18.2%) | 頭痛、頭重感 | |
| 膵臓 | 膵炎 | ||
| その他 | 発熱 | 静脈炎、顔面紅潮 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は溶解時のpHが高いと濁りを生じることがあるので、pH7以上の注射剤との配合は避けること。
14.1.2 用時溶解注射剤のため、溶解後は、できるだけ速やかに使用すること。
14.2 薬剤投与時の注意
14.2.1 皮下・筋肉内には投与しないこと。
14.2.2 静脈内投与により、ときに血管痛、静脈炎等を起こすことがあるので、注射部位、注射方法等に十分注意すること。
14.2.3 静脈内投与に際し、薬液が血管外に漏れると注射部位を中心に炎症を起こすことがあるので、慎重に投与すること。
16. 薬物動態
16.1 血中濃度
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
本剤の単独療法における腫瘍別の有効率は、乳癌29.4%(10/34)、肺癌18.2%(6/33)、胃癌18.6%(19/102)、卵巣癌35.3%(6/17)、急性白血病36.2%(17/47)、悪性リンパ腫53.3%(16/30)であった。
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
19.1. アクラルビシン塩酸塩
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
10バイアル
23. 主要文献
- Mori,S.et al., Jpn.J.Antibiotics., 33 (5), 618-622, (1980) »DOI
- 鎌田紘八 他, 応用薬理, 19 (5), 783-790, (1980)
- 鎌田紘八 他, 応用薬理, 19 (6), 887-894, (1980)
- Oki,T.et al., Recent Results in Cancer Research., 76, 21-40, (1980)
- Yamada,K.et al., Cancer Treatment Rev., 7, 177-182, (1980) »PubMed
- Crooke,S.T.et al., Molecular Pharmacol., 14, 290-298, (1978) »PubMed
- Yamaki,H.et al., J.Antibiotics., 31 (11), 1149-1154, (1978) »DOI
- Hori,S.et al., Gann., 68, 685-690, (1977) »PubMed
- 佐藤 博, Jpn.J.Antibiotics., 33 (2), 133-137, (1980) »DOI
- 久保田哲朗 他, 癌と化学療法, 5 (3), 535-543, (1978)
24. 文献請求先及び問い合わせ先
文献請求先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
製品情報問い合わせ先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
26. 製造販売業者等
26.1 製造販売元
日本マイクロバイオファーマ株式会社
東京都中央区京橋一丁目3番1号
26.2 発売元
アステラス製薬株式会社
東京都中央区日本橋本町2丁目5番1号