医薬品情報
| 総称名 | エスラックス |
|---|---|
| 一般名 | ロクロニウム臭化物 |
| 欧文一般名 | Rocuronium Bromide |
| 製剤名 | ロクロニウム臭化物注射液 |
| 薬効分類名 | 非脱分極性麻酔用筋弛緩剤 |
| 薬効分類番号 | 1229 |
| ATCコード | M03AC09 |
| KEGG DRUG |
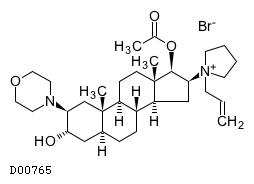
D00765
ロクロニウム臭化物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年3月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エスラックス静注25mg/2.5mL | ESLAX Intravenous 25mg/2.5mL | MSD | 1229405A1028 | 353円/瓶 | 毒薬, 処方箋医薬品 |
| エスラックス静注50mg/5.0mL | ESLAX Intravenous 50mg/5.0mL | MSD | 1229405A2024 | 493円/瓶 | 毒薬, 処方箋医薬品 |
1. 警告
本剤は、その作用及び使用法について熟知した医師のみが使用すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分又は臭化物に対して過敏症の既往歴のある患者
2.2 重症筋無力症、筋無力症候群の患者のうち、スガマデクスナトリウムに対して過敏症の既往歴のある患者[筋弛緩回復剤であるスガマデクスナトリウムを使用できないため、筋弛緩作用が遷延しやすい。]
4. 効能または効果
麻酔時の筋弛緩、気管挿管時の筋弛緩
6. 用法及び用量
通常、成人には挿管用量としてロクロニウム臭化物0.6mg/kgを静脈内投与し、術中必要に応じて0.1〜0.2mg/kgを追加投与する。持続注入により投与する場合は、7μg/kg/分の投与速度で持続注入を開始する。なお、年齢、症状に応じて適宜増減するが、挿管用量の上限は0.9mg/kgまでとする。
7. 用法及び用量に関連する注意
7.1 作用持続時間は用量に依存して長くなるため、本剤0.9mg/kgを挿管用量として投与する際は注意すること。
7.2 持続注入により投与する場合は、筋弛緩モニタリング装置を用いて適切に注入速度を調節すること。
8. 重要な基本的注意
8.1 本剤は呼吸抑制を起こすので十分な自発呼吸が回復するまで必ず調節呼吸を行うこと(ガス麻酔器又は人工呼吸器を使用すること)。[11.1.2参照]
8.2 重症筋無力症、筋無力症候群の患者では、非脱分極性筋弛緩剤に対する感受性が極めて高く、筋弛緩作用が増強・遷延しやすいため、筋弛緩モニターによる確認を必ず行うとともに、患者の呼吸状態等に十分注意し、必要に応じてスガマデクスナトリウムによる筋弛緩状態からの回復を行うこと。また、これらの患者では筋弛緩状態からの回復に抗コリンエステラーゼ剤を使用しないこと。[9.1.6参照]
8.3 重症筋無力症、筋無力症候群以外の患者では、本剤による筋弛緩状態から回復させるには、スガマデクスナトリウム又は抗コリンエステラーゼ剤並びにアトロピン硫酸塩水和物(抗コリンエステラーゼ剤の副作用防止のため)を静脈内投与すること。抗コリンエステラーゼ剤を投与する場合、筋弛緩モニターによる回復又は自発呼吸の発現を確認した後に投与すること。
なお、それぞれの薬剤の電子添文の用法及び用量、使用上の注意を必ず確認すること。
なお、それぞれの薬剤の電子添文の用法及び用量、使用上の注意を必ず確認すること。
8.4 麻酔導入後、本剤にさきがけて気管挿管の目的でスキサメトニウム塩化物水和物を投与した場合には、スキサメトニウム塩化物水和物の効果の消失(患者の自発呼吸の発現)を確認した後、本剤を投与すること。[10.2参照]
8.5 本剤による筋弛緩の程度を客観的に評価し、本剤を安全かつ適切に使用するために、筋弛緩モニターを必要に応じて行うこと。
8.6 スキサメトニウム塩化物水和物で過去にアナフィラキシー反応が生じた患者では、同様にアナフィラキシー反応が生じる可能性があるので、注意すること。
8.7 筋弛緩作用の残存による呼吸抑制、誤嚥等の合併症を防止するため、患者の筋弛緩が十分に回復したことを確認した後に抜管すること。
8.8 スガマデクスナトリウム投与後に本剤を再投与する必要が生じた場合、本剤の作用発現時間の遅延が認められるおそれがあるので、患者の状態を十分に観察しながら慎重に投与すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 呼吸困難及び気道閉塞のある患者
換気不全により、患者の自発呼吸の再開が遅れるおそれがある。
9.1.2 胆道疾患の患者
本剤の排泄が遅れるため作用が遷延することがある。
9.1.3 気管支喘息の患者
喘息発作、気管支痙攣を起こすおそれがある。[11.1.4参照]
9.1.4 電解質異常(低カリウム血症、低カルシウム血症、高マグネシウム血症等)、低蛋白血症、脱水症、アシドーシス、高炭酸ガス血症の患者
本剤の作用が増強されるおそれがある。
9.1.5 低体温麻酔及び低体温灌流法による人工心肺使用の患者
作用が増強し、作用持続時間が延長するおそれがある。
9.1.6 重症筋無力症、筋無力症候群の患者
非脱分極性筋弛緩剤に対する感受性が極めて高い。[8.2参照]
9.1.7 重症筋無力症、筋無力症候群の患者を除く神経筋疾患の患者(筋ジストロフィー、筋緊張症候群、先天性ミオパチー、脊髄性筋萎縮症、ギラン・バレー症候群等)又はポリオ罹患後の患者
本剤の作用の増強又は減弱が生じることがある。
9.1.8 心拍出量の低下が認められる患者
作用発現時間が遅延し、また作用が遷延することがある。
9.1.9 肥満の患者
実体重で投与量を算出した場合、作用持続時間が延長し回復が遅延するおそれがある。
9.1.10 熱傷の患者
筋弛緩剤の作用が抑制されることが知られている。
9.1.11 血液脳関門の機能障害又は透過性の亢進がある患者
重篤な感染症を合併している患者や新生児において、散瞳及び固定瞳孔がみられたとの報告がある。
9.2 腎機能障害患者
9.2.1 腎疾患の患者
本剤の排泄が遅れるため作用が遷延することがある。[16.6.1参照]
9.3 肝機能障害患者
9.3.1 肝疾患の患者
本剤の排泄が遅れるため作用が遷延することがある。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
動物実験(ラット)で乳汁中に移行することが報告されている。
動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした国内臨床試験は実施していない。小児患者(704例)を対象とした本剤(投与量上限1mg/kg)の11の海外臨床試験のメタアナリシスでは、副作用として頻脈(1.4%)が認められた。
作用発現時間が早く、また小児では作用持続時間が短い。
作用発現時間が早く、また小児では作用持続時間が短い。
9.8 高齢者
10. 相互作用
10.2 併用注意
| スキサメトニウム塩化物水和物 [8.4参照] | スキサメトニウム投与後に本剤を投与すると、本剤の筋弛緩作用が増強されることがある。また本剤投与後、スキサメトニウムを投与すると本剤の作用が増強又は減弱される。 | 脱分極性の筋弛緩剤との併用により本剤の作用が増強されると考えられるが、減弱の機序については不明である。 |
| 他の非脱分極性筋弛緩剤 | 本剤と他の非脱分極性筋弛緩剤との投与順により、本剤の筋弛緩作用が減弱あるいは、増強することがある。 | 作用持続時間の異なる非脱分極性筋弛緩剤を逐次使用した場合、最初に使用した筋弛緩剤の作用が影響する。 |
| 吸入麻酔剤 イソフルラン セボフルラン エンフルラン ハロタン エーテル等 リチウム塩製剤 | 本剤の筋弛緩作用が増強されることがあるので、併用する場合には減量するなど注意すること。 | 筋弛緩作用を有する。 |
| カリウム排泄型利尿剤 フロセミド チアジド系 | 本剤の筋弛緩作用が増強されることがあるので、併用する場合には減量するなど注意すること。 | 低カリウム血症により本剤の作用が増強されることがある。 |
| MAO阻害剤 プロタミン製剤 不整脈用剤 β-遮断薬 メトロニダゾール カルシウム拮抗剤 シメチジン ブピバカイン | 本剤の筋弛緩作用が増強されることがあるので、併用する場合には減量するなど注意すること。 | 機序不明 |
| 抗生物質 アミノグリコシド系 リンコマイシン系 ポリペプチド系 アシルアミノペニシリン系 マグネシウム塩製剤 キニジン キニーネ | 本剤の筋弛緩作用が増強されることがあるので、併用する場合には減量するなど注意すること。また、これらの薬剤を術後に投与した場合、本剤の筋弛緩作用が再発現(再クラーレ化)することがある。 | これらの薬剤は筋弛緩作用を有するため作用が増強されると考えられている。再クラーレ化については機序不明である。 |
| フェニトイン | 術中の静脈内投与により本剤の筋弛緩作用が増強されることがあるので、併用する場合は注意すること。 | 機序不明 |
| 塩化カルシウム製剤 塩化カリウム製剤 | 本剤の筋弛緩作用が減弱されることがある。 | Ca2+及びK+は骨格筋の収縮に関与している。 |
| プロテアーゼ阻害剤 ガベキサート ウリナスタチン | 本剤の筋弛緩作用が減弱されることがある。 | 機序不明 |
| 副腎皮質ホルモン剤 抗てんかん剤 カルバマゼピン フェニトイン | 長期前投与により、本剤の筋弛緩作用が減弱されることがある。 | 機序不明 |
| リドカイン | 本剤の筋弛緩作用が増強される及びリドカインの作用発現が早まることがあるので、併用する場合には減量するなど注意すること。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(頻度不明)
ショック、アナフィラキシー(気道内圧上昇、血圧低下、頻脈、全身発赤等)を起こすことがある。
11.1.2 遷延性呼吸抑制(頻度不明)[8.1参照]
11.1.3 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがある。
11.1.4 気管支痙攣(頻度不明)[9.1.3参照]
11.2 その他の副作用
| 1%未満 | 頻度不明 | |
| 神経系障害 | 浮動性めまい | |
| 心臓障害 | 徐脈、洞性徐脈、心室性期外収縮 | |
| 血管障害 | 低血圧、潮紅 | |
| 胃腸障害 | 上腹部痛 | |
| 皮膚及び皮下組織障害 | 接触性皮膚炎、発疹 | 発赤 |
| 全身障害及び投与局所様態 | 注射部位紅斑 | 疼痛* |
| 臨床検査 | 心拍数増加、血圧上昇、血圧低下、アラニン・アミノトランスフェラーゼ増加、アスパラギン酸アミノトランスフェラーゼ増加、血中ビリルビン増加、白血球数減少、白血球数増加、血小板数減少、血小板数増加、血中アルカリホスファターゼ増加、血中アルカリホスファターゼ減少、血中コレステロール増加 |
13. 過量投与
13.1 症状
筋弛緩作用が遷延することがある。
13.2 処置
自発呼吸が回復するまで呼吸管理を行うこと。また、筋弛緩モニターを必要に応じて行うこと。
14. 適用上の注意
14.1 薬剤投与時の注意
アムホテリシン、エリスロマイシンラクトビオン酸塩、クロキサシリン、ヒドロコルチゾンコハク酸エステルナトリウム、メチルプレドニゾロンコハク酸エステル、セファゾリン、チアミラールナトリウム、チオペンタールナトリウム、デキサメタゾン、ドパミン塩酸塩、バンコマイシン、フロセミドと混合すると沈殿を生じるので、別々の投与経路で使用するか、又は同一点滴回路を使用する場合は回路内を生理食塩水等の中性溶液を用いて洗浄するなど混合しないようにすること。
15. その他の注意
15.1 臨床使用に基づく情報
本剤を承認外の適応である呼吸管理を目的として長期にわたり連続投与した際に、筋弛緩作用の遷延又は四肢麻痺等を生じたとの報告がある。また、他の非脱分極性筋弛緩剤で、同様の投与を重症の新生児又は乳児に行った際に、難聴を生じたとの報告がある。
16. 薬物動態
16.1 血中濃度
国内臨床試験において、バランス麻酔下の患者(59例)に本剤0.3、0.6、0.9mg/kgを単回静脈内投与したときの血漿中未変化体濃度推移を下図に、薬物動態パラメータを下表に示す2)。
図 単回静脈内投与したときの血漿中未変化体濃度推移
| 投与量(mg/kg) | 症例数 | 半減期(min) | MRT(min) | CL(mL/min/kg) | Vss(mL/kg) | AUC(mg・min/mL) |
| 0.3 | 20 | 48±17 | 33±13 | 4.5±0.9 | 146±55 | 0.07±0.01 |
| 0.6 | 19 | 75±28 | 46±13 | 4.1±1.0 | 181±48 | 0.15±0.03 |
| 0.9 | 20 | 76±19 | 47±14 | 3.8±0.8 | 172±39 | 0.25±0.05 |
16.4 代謝
スフェンタニル麻酔下の患者11例に本剤0.6mg/kgを単回静脈内投与し、維持用量として0.3mg/kg注1)を静脈内投与した後、持続点滴注入を15μg/kg/分で開始した注2)。血漿中に少量の代謝物17-脱アセチル体が検出された3)(外国人データ)。
16.5 排泄
スフェンタニル麻酔下の患者11例に本剤0.6mg/kgを単回静脈内投与し、維持用量として0.3mg/kg注1)を静脈内投与した後、持続点滴注入を15μg/kg/分で開始した注2)。静脈内持続注入の開始から投与終了後12時間までの未変化体の尿中排泄率は38%であった。尿中に代謝物は検出されなかった3)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎不全患者及び肝機能障害患者
16.6.2 高齢者
注1)本剤の承認された維持用量は0.1〜0.2mg/kgである。
注2)本剤の承認された初期注入速度は7μg/kg/分である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(併合)
筋弛緩作用(気管挿管時)
国内で実施されたオープン試験(3試験)において、プロポフォール麻酔下の各科領域手術患者(ASA分類Class1〜3)に、本剤の挿管用量0.6mg/kg、0.9mg/kg又はベクロニウム臭化物0.1mg/kgを投与した際の筋弛緩作用を表1に示す5)6)7)。本剤の作用発現時間はベクロニウム臭化物と比較して有意に早かった5)。
| 挿管用量 | 本剤0.6mg/kg | 本剤0.9mg/kg | ベクロニウム臭化物0.1mg/kg | |||||||||
| 90%遮断時間(秒) | 70.7±22.1(n=71) | 65.6±17.5(n=64) | 108.2±32.4(n=30) | |||||||||
| 作用発現時間(秒) | 84.8±28.5(n=71) | 77.8±31.0(n=64) | 125.7±38.0(n=30) | |||||||||
| 最大遮断率(%) | 99.7±1.1(n=71) | 99.7±1.1(n=64) | 99.8±0.9(n=30) | |||||||||
| 挿管完了時間(秒) | 166.7±94.4(n=71) | 151.6±76.4(n=63) | 231.1±103.1(n=30) | |||||||||
| 作用持続時間(分) | 54.2±33.3(n=42) | 82.1±29.6(n=36) | 59.9±28.3(n=30) | |||||||||
| 挿管スコア | 優秀 | 良好 | 不良 | 不可 | 優秀 | 良好 | 不良 | 不可 | 優秀 | 良好 | 不良 | 不可 |
| 症例数 | 32 | 34 | 5 | 0 | 37 | 26 | 1 | 0 | 15 | 13 | 2 | 0 |
| % | 45.1 | 47.9 | 7.0 | 0 | 57.8 | 40.6 | 1.6 | 0 | 50.0 | 43.3 | 6.7 | 0 |
17.1.2 国内第III相比較試験
(1)筋弛緩作用(気管挿管時)
セボフルラン麻酔下における本剤の挿管用量0.6mg/kg、0.9mg/kg又はベクロニウム臭化物0.1mg/kg投与後の作用持続時間(本剤投与後、単収縮高が25%に回復するまでの時間)を表2に示す5)。
| 麻酔薬 | セボフルラン | ||
| 挿管用量 | 本剤0.6mg/kg | 本剤0.9mg/kg | ベクロニウム臭化物0.1mg/kg |
| 作用持続時間(分) | 53.4±36.9(n=30) | 73.4±20.5(n=27) | 59.9±28.3(n=30) |
| ベクロニウム群との差と95%信頼区間 | −6.5 −21.7〜8.7 | 13.5 −2.1〜29.2 | |
(2)筋弛緩作用(筋弛緩維持)
挿管用量として本剤0.6mg/kgを投与した後、セボフルラン麻酔下の手術患者に本剤0.1mg/kg(n=10)、0.15mg/kg(n=10)、0.2mg/kg(n=9)を筋弛緩維持のために静脈内投与した時、維持用量1回目投与時の作用持続時間の平均値はそれぞれ23.0分、31.0分、43.7分であった5)。
(3)安全性
挿管用量0.6mg/kg投与
維持用量0.1mg/kg投与群(10例)で副作用の発現はなかった。維持用量0.15mg/kg投与群(10例)で1例に徐脈、低血圧、上腹部痛、接触性皮膚炎の副作用が発現した。維持用量0.2mg/kg投与群(10例)で、1例に浮動性めまい、洞性徐脈、血圧低下の副作用が発現した。
挿管用量0.9mg/kg投与
維持用量0.1mg/kg投与群(9例)で1例に心室性期外収縮の副作用が発現した。維持用量0.15mg/kg投与群(10例)で副作用の発現はなかった。維持用量0.2mg/kg投与群(9例)で、1例に発疹の副作用が発現した5)。
17.1.3 国内第III相、麻酔薬との相互作用試験(ボーラス投与)
(1)筋弛緩作用(気管挿管時)
プロポフォール又はセボフルラン麻酔下における本剤の挿管用量0.6mg/kg、0.9mg/kg投与後の作用持続時間を表3に示す6)。プロポフォール(n=9)又はセボフルラン麻酔下(n=12)における本剤の挿管用量0.6mg/kgでの作用持続時間はそれぞれ41.2分及び56.4分であった6)。
| 挿管用量 | 本剤0.6mg/kg | 本剤0.9mg/kg | ||
| 麻酔薬 | プロポフォール | セボフルラン | プロポフォール | セボフルラン |
| 作用持続時間(分) | 41.2±8.7(n=9) | 56.4±23.6(n=12) | 63.4±25.2(n=9) | 108.1±38.3(n=9) |
| 麻酔薬群間の差と95%信頼区間 | −15 −33〜2 | −45 −77〜−12 | ||
(2)筋弛緩作用(筋弛緩維持)
プロポフォール又はセボフルラン麻酔下の手術患者に挿管用量として本剤0.6mg/kg又は0.9mg/kgを投与し、その後、維持用量0.15mg/kgを投与した時のそれぞれの作用持続時間を表4に示す。セボフルラン麻酔は本剤の作用持続時間を延長させた6)。
| 麻酔薬 | プロポフォール | セボフルラン | ||
| 本剤の挿管用量 | 0.6mg/kg | 0.9mg/kg | 0.6mg/kg | 0.9mg/kg |
| 作用持続時間(分) | 21.8±9.5(n=8) | 27.3±15.4(n=8) | 34.8±13.5(n=11) | 42.3±11.5(n=8) |
| セボフルラン群との差と95%信頼区間* | −14 −22.7〜−5.2 | |||
(3)安全性
挿管用量0.6mg/kg投与群(21例)及び0.9mg/kg投与群(18例)で副作用の発現はなかった6)。
17.1.4 国内第III相、麻酔薬との相互作用試験(持続注入投与)
(1)筋弛緩作用(筋弛緩維持)
セボフルラン又はプロポフォール麻酔下の手術患者において、挿管用量として本剤0.6mg/kg又は0.9mg/kgを投与した後、7μg/kg/分の速度で持続注入を開始し、単収縮高がコントロール値の3〜10%に維持されるよう注入速度を調節したときの持続注入速度の変化を下図に示す。挿管用量として本剤0.6mg/kg投与時の注入開始後90分の平均注入速度はそれぞれ3.4μg/kg/分(n=7)と7.5μg/kg/分(n=9)であった7)。
図 持続注入で筋弛緩を維持したときの注入速度(平均値±標準偏差)
(2)安全性
挿管用量0.6mg/kg投与群(20例)及び0.9mg/kg投与群(18例)で副作用の発現はなかった7)。
17.3 その他
回復時間
TOF比0.9までの回復時間
セボフルラン麻酔下の手術患者において、本剤0.9mg/kgを静脈内投与した後、筋弛緩モニターにおける四連(TOF)刺激による2回目の収縮反応(T2)の再出現時からTOF比(T4/T1の比)0.9に回復するまでの自然回復時間は82.1±27.6分(n=6、平均±標準偏差)であった8)。
18. 薬効薬理
18.1 作用機序
ロクロニウム臭化物は神経筋接合部のニコチン性アセチルコリン受容体のアンタゴニストとして作用することにより、筋弛緩作用を示すことが認められている。
18.1.1 摘出ニワトリヒナの神経筋標本において、ロクロニウム臭化物は多重神経支配を受けている筋線維の収縮を引き起こさず、間接刺激による筋収縮を抑制した9)。
18.1.2 麻酔下のネコ及びブタを用いた試験において、ロクロニウム臭化物は筋束の不随収縮を引き起こさず、筋収縮の抑制時にはテタヌス減衰またはTOF(四連)刺激による減衰を示した。またネオスチグミンはロクロニウム臭化物による筋収縮の抑制を拮抗した9)。
18.2 筋弛緩作用
麻酔下のネコ及びブタを用いた試験においてロクロニウム臭化物の筋弛緩作用のED50値はベクロニウム臭化物の約5倍であった。ネコにおいて、ED90の投与量のロクロニウム臭化物投与による作用発現時間は同効力のベクロニウム臭化物の2倍早かった。ネコ及びブタにおいてED90の投与量のロクロニウム臭化物とベクロニウム臭化物の作用持続時間はほぼ同等であった9)。
19. 有効成分に関する理化学的知見
19.1. ロクロニウム臭化物
20. 取扱い上の注意
バイアルを開封後は速やかに使用すること。
22. 包装
<エスラックス静注25mg/2.5mL>
10バイアル
<エスラックス静注50mg/5.0mL>
10バイアル
23. 主要文献
- 社内資料:高齢者(2007年8月16日承認、エスラックス静注CTD 2.7.6.6)
- 鈴木孝浩、他, 麻酔, 55, 419-27, (2006) »PubMed
- 社内資料:代謝・排泄(2007年8月16日承認、エスラックス静注CTD 2.7.6.7)
- 社内資料:腎不全患者及び肝機能障害患者(2007年8月16日承認、エスラックス静注CTD 2.7.6.5)
- 新宮興、他, 麻酔, 55, 1140-8, (2006) »PubMed
- 小竹良文、他, 麻酔, 55, 873-9, (2006) »PubMed
- 高木俊一、他, 麻酔, 55, 963-70, (2006) »PubMed
- 社内資料:日本人を対象としたT2再出現時投与におけるブリッジング試験(2010年1月20日承認、ブリディオン静注CTD 2.7.6.19)
- Muir AW,et al., Br J Anaesth., 63, 400-10, (1989) »PubMed »DOI
24. 文献請求先及び問い合わせ先
文献請求先
MSD株式会社
MSDカスタマーサポートセンター
東京都千代田区九段北1-13-12
電話:医療関係者の方:フリーダイヤル0120-024-961
製品情報問い合わせ先
MSD株式会社
MSDカスタマーサポートセンター
東京都千代田区九段北1-13-12
電話:医療関係者の方:フリーダイヤル0120-024-961
26. 製造販売業者等
26.1 製造販売元
MSD株式会社
東京都千代田区九段北1-13-12