医薬品情報
| 総称名 | アラノンジー |
|---|---|
| 一般名 | ネララビン |
| 欧文一般名 | Nelarabine |
| 製剤名 | ネララビン注射液 |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 薬効分類番号 | 4229 |
| ATCコード | L01BB07 |
| KEGG DRUG |
D05134
ネララビン
|
| KEGG DGROUP |
DG02018
代謝拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アラノンジー静注用250mg | ARRANON G Injection | サンドファーマ | 4229402A1028 | 46359円/瓶 | 劇薬, 処方箋医薬品 |
1. 警告
1.1 本剤の投与は、緊急時に十分に対応できる医療施設において、造血器悪性腫瘍の治療に対して、十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例のみに行うこと。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分に説明し、同意を得てから投与を開始すること。
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
再発又は難治性の下記疾患
6. 用法及び用量
通常、成人には、ネララビンとして1500mg/m2(体表面積)を1日1回2時間以上かけて点滴静注する。これを1、3、5日目に投与し、その後16日間休薬する。21日間を1クールとして、繰り返す。
通常、小児には、ネララビンとして650mg/m2(体表面積)を1日1回1時間以上かけて点滴静注する。これを5日間連日投与し、その後16日間休薬する。21日間を1クールとして、繰り返す。
7. 用法及び用量に関連する注意
7.1 神経毒性は本剤の用量規制因子である。本剤による治療を受けている患者においては神経系障害の徴候及び症状を注意深く観察すること。なお、Common Terminology Criteria for Adverse Events(CTCAE)注)のグレード2以上に該当する神経系障害の徴候が認められた場合は、直ちに投与を中止すること。[1.2、11.1.1参照]
7.2 他の抗悪性腫瘍薬との併用に関する有効性及び安全性は確立していない。
注)CTCAE1) ver.3.0に基づき評価する。ただし、「傾眠/意識レベルの低下」については、NCI-CTC ver.2.0の「意識レベル低下」に従う。
8. 重要な基本的注意
8.1 免疫機能が抑制された患者への生ワクチン接種により、ワクチン由来の感染を増強又は持続させるおそれがあるので、本剤投与中に生ワクチンを接種しないこと。
8.2 傾眠が発現することがあるので、自動車の運転等危険を伴う機械を操作する際には十分注意させること。
8.3 血液障害があらわれることがあるので、血小板を含む全血算を定期的にモニタリングすること。[11.1.2参照]
8.4 劇症肝炎、肝機能障害及び黄疸があらわれることがあるので、定期的に肝機能検査を行うこと。[11.1.7参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 髄腔内化学療法による治療歴のある患者又は現在治療中の患者
神経系障害のリスクが高まるおそれがある。
9.1.2 全脳・全脊髄照射の施行歴のある患者
神経系障害のリスクが高まるおそれがある。
9.2 腎機能障害患者
9.3 肝機能障害患者
本剤は主に肝臓で代謝されるため、肝機能障害のある患者では血中濃度が上昇するおそれがある。
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性には、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.4.2 パートナーが妊娠する可能性のある男性には、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。マウスリンパ腫細胞を用いたin vitro遺伝子突然変異試験において遺伝毒性が報告されている。
9.4.3 小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。[15.2.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠中に本剤を使用するか、本剤を使用中の患者が妊娠した場合は、胎児に異常が生じる可能性があることを患者に十分説明すること。動物実験において、妊娠7〜19日のウサギに本剤を8時間静脈内持続投与した結果、354mg/m2/日(成人用量の約24%)以上の投与量において、胆嚢無発生、肺分葉異常、胸骨分節の癒合又は過剰及び骨化遅延などの胎児の奇形及び変異の発現が対照群に比べて高い頻度で観察された。また、1180mg/m2/日以上(成人用量の約79%)の投与量においては欠指(第1指)、3540mg/m2/日(成人用量の約2倍)の投与量においては口蓋裂、母動物の体重増加量減少及び胎児体重の低値がみられた。[9.4.1参照]
9.6 授乳婦
授乳しないことが望ましい。本剤又は本剤の活性代謝物であるara-Gがヒトの乳汁中に移行するかどうかは不明である。
9.7 小児等
低出生体重児、新生児を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。十分な症例数ではないものの海外臨床試験での探索的な分析の結果、65歳以上で神経系障害の発現率が高い傾向がみられている。
10. 相互作用
相互作用序文
本剤はアデノシンデアミナーゼによって活性代謝物であるara-Gに変換される。
薬物代謝酵素用語
アデノシンデアミナーゼ
10.2 併用注意
| アデノシンデアミナーゼ阻害剤 ペントスタチン | 本剤の作用が減弱するおそれがある。なお、併用した場合の安全性は確認されていない。アデノシンデアミナーゼ阻害剤との併用は避けることが望ましい。 | In vitroにおいて併用によりネララビンからara-Gへの変換が阻害されることが示されている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 神経系障害
11.1.2 血液障害
貧血(99%)、血小板減少症(86%)、好中球減少症(81%)、発熱性好中球減少症(12%)及び白血球減少症(3%注1))があらわれることがある。[8.3参照]
11.1.3 錯乱状態(8%)
11.1.4 感染症(39%)
敗血症、菌血症、肺炎、真菌感染等の感染症があらわれることがある。本剤投与中に致死的な日和見感染をおこすおそれがある。
11.1.5 腫瘍崩壊症候群(1%)
高尿酸血症等を伴うことがあるので、異常が認められた場合には直ちに投与を中止し、輸液投与や高尿酸血症治療剤の投与等の適切な処置を行うこと。
11.1.6 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等が認められた場合には、投与を中止し、適切な処置を行うこと。
また、横紋筋融解症による急性腎障害の発症に注意すること。
また、横紋筋融解症による急性腎障害の発症に注意すること。
11.1.7 劇症肝炎(頻度不明)、肝機能障害(9%注1))、黄疸(頻度不明)
劇症肝炎、AST、ALT上昇等を伴う肝機能障害、黄疸があらわれることがある。[8.4参照]
成人の海外臨床試験で認められた有害事象をもとに発現頻度を記載した。
注1)小児を対象とした海外臨床試験において、10〜50%未満に認められた有害事象
11.2 その他の副作用
| 10〜50%未満 | 1〜10%未満 | 頻度不明 | |
| 神経 | めまい、頭痛 | 振戦、運動失調、健忘、味覚異常、平衡障害 | − |
| 眼 | − | 霧視 | − |
| 呼吸器 | 胸水、呼吸困難、咳嗽 | 喘鳴 | − |
| 消化器 | 下痢、悪心、嘔吐、便秘 | 食欲不振、口内炎、腹痛 | − |
| 筋骨格 | 筋痛 | 筋力低下、関節痛、背部痛、四肢痛 | − |
| 全身 | 浮腫、末梢性浮腫、疼痛、発熱、疲労、無力症 | 歩行異常 | − |
| 皮膚 | − | 発疹、紅斑 | − |
| その他 | − | 低カリウム血症注1)、低血糖症注2)、低カルシウム血症、低マグネシウム血症、血中クレアチニン増加、低血圧 | 心室頻拍 |
13. 過量投与
13.1 症状
過量投与により麻痺、昏睡を含む重度の神経系障害や骨髄抑制が発現し、場合によっては致死的な結果をもたらすおそれもある。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は希釈せずに使用すること。
14.1.2 本剤は細胞毒性を有するため、調製時には手袋を着用することが望ましい。皮膚、眼、粘膜に薬液が付着した場合には、直ちに多量の流水でよく洗い流すこと。
14.2 薬剤投与時の注意
本剤は静脈内にのみ投与すること。
15. その他の注意
15.1 臨床使用に基づく情報
類薬において二次性悪性腫瘍が発生したとの報告がある。
15.2 非臨床試験に基づく情報
15.2.1 本剤のがん原性試験は実施していないが、L5178Y/TKマウスリンパ腫細胞を用いた検討において、代謝活性化の有無にかかわらず、遺伝子突然変異誘発作用を示すことが報告されている。
15.2.2 本剤の性腺に対する影響については不明であるが、類薬では動物実験において精巣毒性が認められている。[9.4.3参照]
16. 薬物動態
16.1 血中濃度
16.1.1 再発又は難治性のT細胞急性リンパ性白血病ならびにT細胞リンパ芽球性リンパ腫の成人患者7例注)にネララビンを隔日(1、3、5日目)に2時間かけて静脈内投与した時の血漿中ネララビン及びara-Gの薬物動態パラメータを表-1に、濃度推移を図-1に示す。また、再発又は難治性のT細胞急性リンパ性白血病の小児患者4例にネララビンを5日間連日1時間かけて静脈内投与した時の血漿中ネララビン及びara-Gの薬物動態パラメータを表-2に、濃度推移を図-2に示す2)(日本人のデータ)。
注)T細胞急性リンパ性白血病患者4例、T細胞リンパ芽球性リンパ腫患者3例
| 投与量 | 測定対象 | 評価日 | AUC0-∞(μM・hr) | Cmax(μM) | t1/2(hr) | CLa)(L/hr) | Vssa)(L) |
| 1500mg/m2 | ネララビン | 1日目 | 33 (18-62) | 26 (14-49) | 0.23 (0.16-0.34) | 244 (134-446) | 82 (57-117) |
| 5日目 | 46 (29-71) | 38 (25-57) | 0.22 (0.13-0.38) | 176 (112-278) | 56 (33-98) | ||
| ara-G | 1日目 | 623 (391-992) | 132 (109-160) | 3.0 (2.1-4.2) | 12.9 (8.2-20.3) | 55 (42-73) | |
| 5日目 | 572 (368-890) | 124 (101-153) | 2.9 (2.0-4.0) | 14.1 (9.3-21.3) | 58 (52-65) | ||
| 1000mg/m2 | ネララビン | 1日目 | 36 (8-156) | 28 (7-118) | 0.30 (0.16-0.59) | 148 (38-582) | 65 (31-138) |
| 5日目 | 30 (9-95) | 23 (8-69) | 0.29 (0.15-0.54) | 180 (60-542) | 75 (32-171) | ||
| ara-G | 1日目 | 441 (263-739) | 87 (65-116) | 3.5 (2.8-4.5) | 12.2 (7.7-19.3) | 62 (31-124) | |
| 5日目 | 399 (235-677) | 83 (56-123) | 3.4 (1.9-6.2) | 13.5 (8.3-21.9) | 67 (23-197) |
| 投与量 | 測定対象 | 評価日 | AUC0-∞(μM・hr) | Cmax(μM) | t1/2(hr) | CLa)(L/hr) | Vssa)(L) |
| 650mg/m2 | ネララビン | 1日目 | 25 (6-104) | 31 (7-131) | 0.25 (0.13-0.47) | 91 (23-360) | 33 (7-151) |
| ara-G | 192 (114-325) | 64 (52-77) | 1.7 (1.3-2.1) | 12.1 (7.9-18.5) | 28.9 (16.6-50.5) | ||
| 400mg/m2b) | ネララビン | 1日目 | 19,−c) | 8.4,23.7 | 0.21,−c) | 86.5,−c) | 26.5,−c) |
| ara-G | 78,140 | 36,45 | 1.9,2.0 | 15.9,11.6 | 43.4,32.9 |
図-1 成人における血漿中濃度推移(平均値±標準偏差)
図-2 小児における血漿中濃度推移(平均値±標準偏差)
16.1.2 血漿中ara-GのCmaxは概して、1時間又は2時間かけたネララビンの持続静注の終了時に認められ、ネララビンのCmaxよりも高かったことから、ネララビンからara-Gへの迅速かつ高度な変換が示された。成人患者に本剤1500mg/m2を2時間かけて持続静注したときの血漿中ネララビン及びara-GのCmax(幾何平均)は、各々13.9μM及び115μMであった。1500mg/m2の投与1日目における血漿中ara-GのAUC0-tは535μM・hrであり、血漿中ネララビンのAUC0-t(17.8μM・hr)よりも30倍高かった。
ネララビンの連日投与又は1、3、5日目の隔日投与後の血漿中に、ネララビン又はara-Gの蓄積は認められなかった。
ネララビン及びara-Gは血漿中から速やかに消失し、半減期は各々30分未満及び2〜3時間であった。本剤104〜2900mg/m2を投与した第I相臨床試験全体の成人患者の成績では、試験1日目のネララビンのクリアランスは138L/hr/m2であり、ara-Gの見かけのクリアランスは9.5L/hr/m2であった。
ネララビン及びara-Gは体内に広範に分布し、成人患者におけるネララビンの定常状態での分布容積は約115L/m2、ara-Gの定常状態での見かけの分布容積は約45L/m2であった。
本剤104〜2900mg/m2を投与した第I相臨床試験全体の小児患者の成績では、ネララビンの定常状態での分布容積は約89L/m2、ara-Gの定常状態での見かけの分布容積は約32L/m2であった。小児患者における試験1日目のネララビンのクリアランスは125L/hr/m2であり、ara-Gの見かけのクリアランスは10.8L/hr/m2であった(外国人のデータ)。
ネララビンの連日投与又は1、3、5日目の隔日投与後の血漿中に、ネララビン又はara-Gの蓄積は認められなかった。
ネララビン及びara-Gは血漿中から速やかに消失し、半減期は各々30分未満及び2〜3時間であった。本剤104〜2900mg/m2を投与した第I相臨床試験全体の成人患者の成績では、試験1日目のネララビンのクリアランスは138L/hr/m2であり、ara-Gの見かけのクリアランスは9.5L/hr/m2であった。
ネララビン及びara-Gは体内に広範に分布し、成人患者におけるネララビンの定常状態での分布容積は約115L/m2、ara-Gの定常状態での見かけの分布容積は約45L/m2であった。
本剤104〜2900mg/m2を投与した第I相臨床試験全体の小児患者の成績では、ネララビンの定常状態での分布容積は約89L/m2、ara-Gの定常状態での見かけの分布容積は約32L/m2であった。小児患者における試験1日目のネララビンのクリアランスは125L/hr/m2であり、ara-Gの見かけのクリアランスは10.8L/hr/m2であった(外国人のデータ)。
16.3 分布
1500mg/m2の投与1日目における白血病芽球内のara-Gの活性5'-三リン酸化体(細胞内ara-GTP)のCmaxは、投与後3〜25時間の間に認められ、細胞内ara-GTPのAUC0-tは2214μM・hrで血漿中ネララビンのAUCよりも124倍高く、血漿中ara-GのAUCよりも4倍高かった。
白血病芽球の細胞内ara-GTP濃度は、長時間にわたって定量可能であった。ネララビンの反復投与により細胞内ara-GTPが蓄積し、1、3、5日目の隔日投与試験における試験3日目の細胞内ara-GTPのCmax及びAUC0-tは、試験1日目の値よりも各々約50%及び約30%高かった。
ネララビン及びara-Gのin vitroでのヒト血漿中蛋白結合率は低く(25%未満)、600μM以下の濃度ではネララビン又はara-Gの濃度に依存しなかった(外国人のデータ)。
白血病芽球の細胞内ara-GTP濃度は、長時間にわたって定量可能であった。ネララビンの反復投与により細胞内ara-GTPが蓄積し、1、3、5日目の隔日投与試験における試験3日目の細胞内ara-GTPのCmax及びAUC0-tは、試験1日目の値よりも各々約50%及び約30%高かった。
ネララビン及びara-Gのin vitroでのヒト血漿中蛋白結合率は低く(25%未満)、600μM以下の濃度ではネララビン又はara-Gの濃度に依存しなかった(外国人のデータ)。
16.4 代謝
ネララビン及びara-Gは、in vitroで、主なヒト肝チトクロームP450(CYP)酵素であるCYP1A2、CYP2A6、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6及びCYP3A4をいずれも100μMまでの濃度で阻害しなかった。
ネララビンの主要代謝経路はara-Gを生成するアデノシンデアミナーゼによるO-脱メチル化であり、ara-Gは加水分解されてグアニンに代謝される。また、ネララビンの一部は加水分解されてメチルグアニンとなり、さらにO-脱メチル化によってグアニンに代謝される。グアニンはN-脱アミノ化によってキサンチンとなり、さらに酸化されて尿酸に代謝される(外国人のデータ)。
ネララビンの主要代謝経路はara-Gを生成するアデノシンデアミナーゼによるO-脱メチル化であり、ara-Gは加水分解されてグアニンに代謝される。また、ネララビンの一部は加水分解されてメチルグアニンとなり、さらにO-脱メチル化によってグアニンに代謝される。グアニンはN-脱アミノ化によってキサンチンとなり、さらに酸化されて尿酸に代謝される(外国人のデータ)。
16.5 排泄
ネララビン及びara-Gの一部は腎を経由して排泄された。成人患者における試験1日目のネララビン投与後24時間のネララビン及びara-Gの尿中排泄率は各々投与量の約5%及び約23%であり、ネララビン及びara-Gの腎クリアランスは各々16.4L/hr及び4.9L/hrであった(外国人のデータ)。[9.2参照]
16.6 特定の背景を有する患者
16.6.1 性差
ネララビン及びara-Gの薬物動態に関して性差は認められなかった(外国人のデータ)。
16.6.2 高齢者
ネララビン及びara-Gの薬物動態に及ぼす年齢の影響は認められなかったが、高齢者では腎機能の低下している場合が多いためara-Gのクリアランスが減少する可能性がある(外国人のデータ)。
16.6.3 腎機能障害患者
腎機能障害患者又は血液透析患者を対象としたネララビン及びara-Gの薬物動態試験は実施されていない。ネララビンの腎からの排泄率は低く(投与量の約5%)、ara-Gとしての腎からの排泄率はこれより高い(ネララビン投与量の約23%)。なお、第I相臨床試験で薬物動態を検討した成人及び小児患者をクレアチニンクリアランス(CLcr)概算値に基づいて、腎機能正常の患者(CLcr>80mL/分、n=55)、軽度のCLcr低下患者(CLcr=50〜80mL/分、n=11)及び中等度のCLcr低下患者(CLcr<50mL/分、n=2)に三区分すると、腎機能正常の患者と比べて、ara-Gの見かけのクリアランスが、軽度のCLcr低下患者では約7%低く、中等度のCLcr低下患者では約20〜40%低かった。なお、CLcrが50mL/分未満の腎機能障害患者への推奨用量のデータは十分に得られていない(外国人のデータ)。[9.2参照]
16.7 薬物相互作用
16.7.1 フルダラビン
難治性の白血病患者を対象として、ネララビン1200mg/m2投与の4時間前にフルダラビン30mg/m2を30分間持続静注した試験では、12例の白血病患者(解析例)における血漿中ネララビン及びara-G又は白血病細胞内ara-GTPの薬物動態にフルダラビンの影響は認められなかった(外国人のデータ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外第II相試験(PGAA2002試験)
海外で実施された再発又は難治性の成人T細胞急性リンパ性白血病ならびにT細胞リンパ芽球性リンパ腫を対象とした第II相臨床試験成績は以下のとおりである。
| 16歳以上注) 1500mg/m2(1、3、5日) | ||
| 寛解導入回数 (患者数) | 1回 (11例) | 2回以上 (28例) |
| 完全寛解(例数及びその持続期間) | ||
| 例数(%) [95%信頼区間] | 2(18%) [2〜52] | 5(18%) [6〜37] |
| 持続期間(週) | 51.0及び212.0 | 15.1〜195.4以上 |
有害事象発現頻度は97%(38/39例)であった。主な有害事象は、ヘモグロビン減少87%(34/39例)、血小板数減少72%(28/39例)及び好中球数減少64%(25/39例)であった。
17.1.2 海外第II相試験(PGAA2001試験)
海外で実施された再発又は難治性の小児T細胞急性リンパ性白血病ならびにT細胞非ホジキンリンパ腫を対象とした第II相臨床試験成績は以下のとおりである。
| 21歳以下注) 650mg/m2(1〜5日) | ||
| 寛解導入回数 (患者数) | 1回 (31例) | 2回以上 (39例) |
| 完全寛解(例数及びその持続期間) | ||
| 例数(%) [95%信頼区間] | 13(42%) [25〜61] | 5(13%) [4〜27] |
| 持続期間(週) | 0.9〜260.0以上 | 4.7〜36.4 |
有害事象発現頻度は、650mg/m2投与群で79%(66/84例)であった。主な有害事象は、ヘモグロビン減少及び白血球数減少が各38%(32/84例)及び好中球数減少37%(31/84例)であった。
17.1.3 国内第I相試験(PGA105446試験)
再発又は難治性T細胞急性リンパ性白血病ならびにT細胞リンパ芽球性リンパ腫を対象とした国内第I相臨床試験において成人7例(T細胞急性リンパ性白血病患者4例、T細胞リンパ芽球性リンパ腫患者3例)のうち1例で完全寛解が、有効性解析対象集団に含めた小児4例(いずれもT細胞急性リンパ性白血病)のうち2例で完全寛解が得られた。注)
臨床検査値異常を含む主な有害事象は以下のとおりであった。
臨床検査値異常を含む主な有害事象は以下のとおりであった。
成人
7例に認められた臨床検査値異常を含む主な有害事象は、傾眠7例(100%)、悪心5例(71%)、リンパ球数減少、AST増加、ALT増加各4例(57%)であった。
小児
6例に認められた臨床検査値異常を含む主な有害事象は、白血球数減少5例(83%)、リンパ球数減少4例(67%)、ヘモグロビン減少、尿潜血陽性、好中球数減少各3例(50%)であった。
注)本剤の通常用量は、成人では「ネララビンとして1500mg/m2(体表面積)を1日1回2時間以上かけて点滴静注する。これを1、3、5日目に投与し、その後16日間休薬する。21日間を1クールとして、繰り返す。」、小児では「ネララビンとして650mg/m2(体表面積)を1日1回1時間以上かけて点滴静注する。これを5日間連日投与し、その後16日間休薬する。21日間を1クールとして、繰り返す。」である。通常、15歳未満の患者には、小児に対する用法・用量にて投与すること。
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍効果
ネララビンはin vitroの培養系において、ヒトT細胞性白血病細胞株に対して強い細胞障害活性を示した。一方、ヒトB細胞株に対する細胞障害活性は弱かった。ヒトT細胞性白血病細胞株を用いたマウス皮下異種移植モデルにおいて、ネララビンは反復投与により用量依存的な抗腫瘍活性を示した。
19. 有効成分に関する理化学的知見
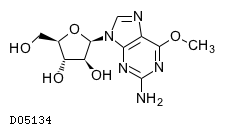
19.1. ネララビン
22. 包装
1バイアル
23. 主要文献
- Common Terminology Criteria for Adverse Events, (National Cancer Institute,https://ctep.cancer.gov/protocoldevelopment/electronic_applications/ctc.htm) »PubMed
- 堀部敬三ほか, 臨床血液, 52 (6), 406-415, (2011) »PubMed
- Lambe,C.U.et al., Cancer Res., 55 (15), 3352-3356, (1995) »PubMed
- Rodriguez,C.O.Jr.et al., Cancer Res., 59 (19), 4937-4943, (1999) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
サンド株式会社
カスタマーケアグループ
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-982-001
FAX:03-6257-3633
製品情報問い合わせ先
サンド株式会社
カスタマーケアグループ
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-982-001
FAX:03-6257-3633