医薬品情報
| 総称名 | クロミッド |
|---|---|
| 一般名 | クロミフェンクエン酸塩 |
| 欧文一般名 | Clomifene Citrate |
| 薬効分類名 | 排卵誘発剤 抗エストロゲン剤 |
| 薬効分類番号 | 2499 |
| ATCコード | G03GB02 |
| KEGG DRUG |
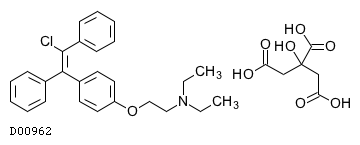
D00962
クロミフェンクエン酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年9月 改訂(効能変更、用法変更)(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| クロミッド錠50mg | Clomid tablets | 富士製薬工業 | 2499009F1080 | 92.4円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
<効能共通>
2.1 エストロゲン依存性悪性腫瘍(例えば、乳癌、子宮内膜癌)及びその疑いのある患者[腫瘍の悪化あるいは顕性化を促すことがある。]
2.2 肝障害又は肝疾患のある患者[9.3.1参照]
2.3 アンドロゲン依存性悪性腫瘍(例えば前立腺癌)及びその疑いのある患者[アンドロゲン産生を促進するため、腫瘍の悪化あるいは顕性化を促すおそれがある。]
<排卵障害にもとづく不妊症の排卵誘発、生殖補助医療における調節卵巣刺激>
4. 効能または効果
5. 効能または効果に関連する注意
<効能共通>
5.1 頭蓋内に病変(下垂体腫瘍等)のある患者には投与しないこと。
<排卵障害にもとづく不妊症の排卵誘発>
5.2 排卵障害にもとづく不妊症の排卵誘発の対象は間脳又は下垂体前葉の機能障害に由来する性腺刺激ホルモン低分泌無排卵患者であるので、以下の患者には投与しないこと。
・原発性卵巣不全による尿中性腺刺激ホルモン分泌の高い患者
・副腎及び甲状腺機能の異常による無排卵患者
・無排卵症以外の不妊症患者
5.3 無月経患者においては、投与前にGestagen testにより、第1度無月経を確認し、Estrogen testにより子宮性無月経を除外すること。
<排卵障害にもとづく不妊症の排卵誘発、生殖補助医療における調節卵巣刺激>
5.4 本剤の投与の適否は、患者及びパートナーの検査を十分に行った上で判断すること。原発性卵巣不全が認められる場合や妊娠不能な性器奇形又は妊娠に不適切な子宮筋腫の合併等の妊娠に不適当な場合には本剤を投与しないこと。また、甲状腺機能低下、副腎機能低下、高プロラクチン血症及び下垂体又は視床下部腫瘍等が認められた場合、当該疾患の治療を優先すること。
<乏精子症における精子形成の誘導>
5.5 本剤の投与に際しては、精液検査、内分泌学的検査、精巣エコー検査等の検査結果から、乏精子症の原因探索を行い、特発性の乏精子症であることを確認すること。また、血中FSH、LH及びテストステロン値を踏まえて、本剤による治療の適否を判断すること。
なお、乏精子症の原因が特定された場合には、当該原因に対する治療を行うこと。[8.7参照]
なお、乏精子症の原因が特定された場合には、当該原因に対する治療を行うこと。[8.7参照]
6. 用法及び用量
<排卵障害にもとづく不妊症の排卵誘発>
無排卵症の患者に対して本剤により排卵誘発を試みる場合には、まずGestagen、Estrogen testを必ず行って、消退性出血の出現を確認し、子宮性無月経を除外した後、経口投与を開始する。
通常第1クール1日クロミフェンクエン酸塩として50mg 5日間で開始し、第1クールで無効の場合は1日100mg 5日間に増量する。
用量・期間は1日100mg 5日間を限度とする。
用量・期間は1日100mg 5日間を限度とする。
<生殖補助医療における調節卵巣刺激>
通常、クロミフェンクエン酸塩として1日50mgを月経周期3日目から5日間経口投与する。効果不十分な場合は、次周期以降の用量を1日100mgに増量できる。
<乏精子症における精子形成の誘導>
通常、クロミフェンクエン酸塩として1回50mgを隔日経口投与する。
7. 用法及び用量に関連する注意
<排卵障害にもとづく不妊症の排卵誘発>
一般に3クール反復投与しても排卵性月経の全くみられない場合には投与を中止すること。
8. 重要な基本的注意
<効能共通>
8.1 霧視等の視覚症状があらわれることがあるので、服用中は自動車の運転等、危険を伴う機械の操作に従事させないように注意すること。
8.2 本剤は、不妊治療に十分な知識と経験のある医師のもとで使用すること。
<排卵障害にもとづく不妊症の排卵誘発、生殖補助医療における調節卵巣刺激>
8.3 本剤投与により予想されるリスク及び注意すべき症状について、あらかじめ患者に説明を行うこと。
<乏精子症における精子形成の誘導>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 児を望まない無排卵患者
治療上やむを得ないと判断される場合を除き、投与しないこと。
9.1.2 子宮筋腫のある患者
子宮筋腫の発育を促進するおそれがある。
9.1.3 子宮内膜症のある患者
症状が増悪するおそれがある。
9.1.4 乳癌の既往歴のある患者
乳癌が再発するおそれがある。
9.1.5 乳癌家族素因が強い患者、乳房結節のある患者、乳腺症の患者又は乳房レントゲン像に異常がみられた患者
症状が増悪するおそれがある。
9.1.6 多嚢胞性卵巣のある患者
9.1.7 未治療の子宮内膜増殖症のある患者
子宮内膜増殖症は細胞異型を伴う場合がある。
9.1.8 前立腺肥大のある患者
アンドロゲン産生を促進するため、症状が増悪するおそれがある。
9.1.9 本人及び家族の既往歴等の一般に血栓塞栓症発現リスクが高いと認められる患者
9.3 肝機能障害患者
9.4 生殖能を有する者
<排卵障害にもとづく不妊症の排卵誘発、生殖補助医療における調節卵巣刺激>
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 卵巣過剰刺激症候群(頻度不明)
11.2 その他の副作用
| 5%以上又は頻度不明 | 0.1〜5%未満 | 0.1%未満 | |
| 眼 | 虚血性視神経症 | 霧視等の視覚症状注1) | |
| 過敏症 | 発疹等 | ||
| 精神神経系 | 精神変調 | 頭痛、情動不安等 | |
| 肝臓 | AST上昇、ALT上昇、ビリルビン上昇、γ-GTP上昇 | 5%以上のBSP排泄遅延 | |
| 消化器 | 悪心・嘔吐、食欲不振等 | ||
| その他 | 男性:女性化乳房、ざ瘡、脱毛 | 顔面潮紅、尿量増加、口渇、疲労感 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
16. 薬物動態
16.2 吸収
16.4 代謝
16.5 排泄
患者6例に、14C-標識クロミフェンクエン酸塩を経口投与したとき、5日間で平均51%が排泄された。主に糞便中に排泄され、投与後6週間までは糞便中濃度が尿中濃度を超えていた。このことは、未変化体及び代謝物が腸肝循環でゆっくりと排泄されたことを示している8)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<排卵障害にもとづく不妊症の排卵誘発>
17.1.1 国内臨床試験
承認時における一般臨床試験での排卵誘発率を指標とした有効性評価対象例は49例であり、有効率は44.9%(22例)であった9)。
| 疾患名 | 有効例数/有効性評価対象例数 | 有効率(%) |
| 第1度無月経 | 9/16 | 56.3 |
| 第2度無月経 | 1/17 | 5.9 |
| 無排卵周期症 | 12/16 | 75.0 |
18. 薬効薬理
18.1 作用機序
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. クロミフェンクエン酸塩
21. 承認条件
<乏精子症における精子形成の誘導>
関連学会と連携の上、本剤投与下で形成された精子を用いた妊娠での児への影響に関してデータを収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
30錠[10錠(PTP)×3]
23. 主要文献
- Rossing MA,et al., N Engl J Med., 331 (12), 771-776, (1994) »PubMed
- 伊藤由紀ほか, 日病薬誌, 39 (10), 1247-1249, (2003)
- Benshushan A,et al., Eur J Obstet Gynecol Reprod Biol., 62 (2), 261-262, (1995) »PubMed
- Nagao T,et al., Teratog Carcinog Mutagen., 21 (3), 213-221, (2001) »PubMed
- Geier A,et al., Fertil Steril., 47 (5), 778, (1987) »PubMed
- USP DI Vol.I Drug Information for the Health Care Professional 27th ed., 848-850, (2007), (Thomson Healthcare.)
- たか折修二ほか監訳, グッドマン・ギルマン薬理書 第11版, 2007, 1988-1990, (廣川書店)
- Schreiber E,et al., Clin Res., 14, 287, (1966)
- 植田安雄ほか, 日本産科婦人科学会雑誌, 18 (6), 555, (1966)
- 青野敏博, 産婦人科の進歩, 28 (5), 407, (1976)
- Awouters M,et al., Andrology., 8 (6), 1590-1597, (2020) »PubMed
- 寺川直樹, 臨床婦人科産科, 42 (3), 247, (1988)
- Roy S,et al., Acta Endocrinol(Copenh)., 47, 645-656, (1964) »PubMed
- Boyar RM., Endocrinology., 86 (3), 629-633, (1970) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
富士製薬工業株式会社
富山工場 学術情報課
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
製品情報問い合わせ先
富士製薬工業株式会社
富山工場 学術情報課
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
26. 製造販売業者等
26.1 製造販売元
富士製薬工業株式会社
富山県富山市水橋辻ヶ堂1515番地