医薬品情報
| 総称名 | ロピオン |
|---|---|
| 一般名 | フルルビプロフェン アキセチル |
| 欧文一般名 | Flurbiprofen axetil |
| 製剤名 | フルルビプロフェン アキセチル注射液 |
| 薬効分類名 | 静注用非ステロイド性鎮痛剤 |
| 薬効分類番号 | 1149 |
| ATCコード | M01AE09 M02AA19 |
| KEGG DRUG |
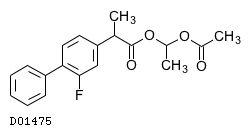
D01475
フルルビプロフェンアキセチル
|
| KEGG DGROUP |
DG00755
フルルビプロフェン
DG01504
非ステロイド性抗炎症薬 (NSAID)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年10月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ロピオン静注50mg | ROPION Intravenous | 科研製薬 | 1149407A1040 | 278円/管 | 劇薬, 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
下記疾患並びに状態における鎮痛
術後、各種癌
5. 効能または効果に関連する注意
発熱を伴う患者に対する解熱や、腰痛症の患者に対する鎮痛を目的として使用しないこと。
6. 用法及び用量
通常、成人にはフルルビプロフェン アキセチルとして1回50mgをできるだけゆっくり静脈内注射する。
その後、必要に応じて反復投与する。
なお、年齢、症状により適宜増減する。
ただし、本剤の使用は経口投与が不可能な場合又は効果が不十分な場合とする。
その後、必要に応じて反復投与する。
なお、年齢、症状により適宜増減する。
ただし、本剤の使用は経口投与が不可能な場合又は効果が不十分な場合とする。
7. 用法及び用量に関連する注意
7.1 患者の状態に注意し、できるだけゆっくり(1分間以上の時間をかけて)投与すること。
7.2 経口投与が不可能な患者に投与した場合は、経口投与が可能になれば速やかに投与を中止し、経口投与に切り替えること。
7.3 他の非ステロイド性消炎鎮痛剤との併用は避けることが望ましい。
8. 重要な基本的注意
<効能共通>
8.1 ショック発現時に緊急処置のとれる準備をしておくこと。また、投与後患者を安静の状態に保たせ、十分な観察を行うこと。[11.1.1参照]
8.2 疼痛の程度を考慮し、必要以上に投与しないこと。
8.3 長期投与を避けること。なお、やむを得ず長期投与する場合には定期的に尿検査、血液検査及び肝機能検査等を行うこと。
8.4 過度の体温下降、虚脱、四肢冷却等があらわれることがあるので、投与後の患者の状態に十分注意すること。
8.5 急性腎障害、ネフローゼ症候群等の重篤な腎障害があらわれることがあるので、定期的に腎機能検査を行うなど観察を十分に行うこと。[11.1.2参照]
<各種癌における鎮痛>
8.6 鎮痛効果がみられない場合は、他剤に切り替えるなど適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 消化性潰瘍の既往歴のある患者
消化性潰瘍を再発させることがある。
9.1.2 血液の異常又はその既往歴のある患者(重篤な血液の異常のある患者を除く)
9.1.3 出血傾向のある患者
血小板機能低下が起こることがあるので、出血傾向を助長するおそれがある。
9.1.4 心機能異常のある患者(重篤な心機能不全のある患者を除く)
プロスタグランジン合成阻害作用による水・ナトリウム貯留傾向があるため、心機能異常を悪化させるおそれがある。[2.5参照]
9.1.5 高血圧症のある患者(重篤な高血圧症のある患者を除く)
プロスタグランジン合成阻害作用による水・ナトリウム貯留傾向があるため、血圧を上昇させるおそれがある。[2.6参照]
9.1.6 気管支喘息のある患者(アスピリン喘息又はその既往歴のある患者を除く)
9.1.7 感染症を合併している患者
9.1.8 潰瘍性大腸炎の患者
他の非ステロイド性消炎鎮痛剤で症状が悪化したとの報告がある。
9.1.9 クローン病の患者
他の非ステロイド性消炎鎮痛剤で症状が悪化したとの報告がある。
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
9.2.2 腎障害又はその既往歴のある患者あるいは腎血流量が低下している患者(重篤な腎障害のある患者を除く)
腎障害を悪化又は再発あるいは誘発させるおそれがある。[11.1.2参照]
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。副作用として肝機能異常があらわれることがあるので、肝障害を更に悪化させるおそれがある。[2.3参照]
9.3.2 肝障害又はその既往歴のある患者(重篤な肝障害のある患者を除く)
肝障害を悪化又は再発させるおそれがある。
9.5 妊婦
9.5.1 妊娠後期の女性
9.5.2 妊婦(妊娠後期を除く)又は妊娠している可能性のある女性
治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。投与する際には、必要最小限にとどめ、羊水量、胎児の動脈管収縮を疑う所見を妊娠週数や投与日数を考慮して適宜確認するなど慎重に投与すること。シクロオキシゲナーゼ阻害剤(経口剤、坐剤)を妊婦に使用し、胎児の腎機能障害及び尿量減少、それに伴う羊水過少症が起きたとの報告がある。シクロオキシゲナーゼ阻害剤(全身作用を期待する製剤)を妊娠中期の妊婦に使用し、胎児の動脈管収縮が起きたとの報告がある。妊娠前及び妊娠初期投与試験では、ラット(静脈内投与)の5mg/kg/日群で、排卵及び着床の減少が認められた2)。器官形成期投与試験では、ラット(静脈内投与)の10mg/kg/日群で、母体の全身状態の悪化に伴う胎児発育遅延、胎児死亡率の増加傾向、哺育能力の低下及び出生児の発育抑制が認められた3)。また、ウサギ(静脈内投与)の80mg/kg/日群で、母体の全身状態の悪化に伴う流・早産の増加及び胎児死亡率の増加が認められた4)。周産期及び授乳期投与試験では、ラット(静脈内投与)の0.1、1mg/kg/日群で、分娩障害による母体死亡、また、1mg/kg/日群で妊娠期間延長、分娩障害による死産児数の増加及び哺育能力の低下が認められた5)。[9.6参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁移行が認められている。[9.5.2参照]
9.7 小児等
9.7.1 小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.7.2 副作用の発現に特に注意し、必要最小限の使用にとどめるなど慎重に投与すること。
9.8 高齢者
副作用の発現に特に注意し、少量から投与を開始するなど必要最小限の使用にとどめ慎重に投与すること。
10. 相互作用
相互作用序文
本剤の活性代謝物であるフルルビプロフェンは、主として肝代謝酵素CYP2C9によって代謝される。
薬物代謝酵素用語
CYP2C9
10.1 併用禁忌
10.2 併用注意
| ニューキノロン系抗菌剤(ただし、エノキサシン水和物、ロメフロキサシン、ノルフロキサシン、プルリフロキサシンは併用禁忌) オフロキサシン等 [9.1.7、10.1、11.1.4参照] | 痙攣があらわれるおそれがある。併用は避けることが望ましい。 | ニューキノロン系抗菌剤のGABA阻害作用が併用により増強されるためと考えられる。 |
| クマリン系抗凝血剤 ワルファリン | クマリン系抗凝血剤(ワルファリン)の作用を増強するとの報告があるので、用量を調節するなど注意すること。 | ワルファリンの血漿蛋白結合と競合し、遊離型ワルファリンが増加するためと考えられる。 |
| メトトレキサート | メトトレキサートの作用が増強され、中毒症状(貧血、血小板減少等)があらわれたとの報告があるので、用量を調節するなど注意すること。 | プロスタグランジン合成阻害作用により腎血流が減少し、メトトレキサートの腎排泄が抑制されることにより、メトトレキサートの血中濃度が上昇すると考えられる。 |
| リチウム製剤 炭酸リチウム | リチウムの血中濃度が上昇し、リチウム中毒を呈するおそれがあるので、併用する場合にはリチウムの血中濃度をモニターするなど観察を十分に行い、慎重に投与すること。 | プロスタグランジン合成阻害作用により、腎でのナトリウム排泄が減少してリチウムクリアランスを低下させ、リチウムの血中濃度が上昇すると考えられる。 |
| チアジド系利尿薬 ヒドロクロロチアジド等 ループ利尿薬 フロセミド | これら利尿薬の作用を減弱するとの報告がある。 | プロスタグランジン合成阻害作用により、水・塩類の体内貯留が生じるためと考えられる。 |
| 副腎皮質ホルモン剤 メチルプレドニゾロン等 [11.1.3参照] | 相互に消化器系の副作用(消化性潰瘍、消化管出血等)が増強されるおそれがある。 | 両薬剤の消化器系の副作用が併用により増強されると考えられる。 |
| CYP2C9阻害作用を有する薬剤 フルコナゾール等 | フルルビプロフェンの血中濃度が上昇するおそれがある。 | 代謝酵素(CYP2C9)の競合により、フルルビプロフェンの代謝が阻害されると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
胸内苦悶、悪寒、冷汗、呼吸困難、四肢しびれ感、血圧低下、血管浮腫、蕁麻疹等があらわれた場合には投与を中止し、適切な処置を行うこと。[8.1参照]
11.1.2 急性腎障害、ネフローゼ症候群(いずれも頻度不明)
11.1.3 胃腸出血(頻度不明)[10.2参照]
11.1.4 痙攣(頻度不明)
11.1.5 喘息発作(頻度不明)
11.1.6 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、剥脱性皮膚炎(いずれも頻度不明)
11.1.8 心筋梗塞、脳血管障害(いずれも頻度不明)
心筋梗塞、脳血管障害等の心血管系血栓塞栓性事象があらわれることがある6)。
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 過敏症 | そう痒感、発疹 | ||
| 消化器 | 嘔気 | 嘔吐 | 下痢 |
| 肝臓 | AST上昇、ALT上昇 | Al-P上昇等 | |
| 精神神経系 | 熱感、倦怠感、悪寒 | 頭痛、眠気 | |
| 循環器 | 血圧上昇、動悸 | ||
| 血液 | 血小板減少、血小板機能低下(出血時間の延長) | ||
| 適用部位 | 注射部位の疼痛、皮下出血 |
14. 適用上の注意
14.1 薬剤調製時の注意
可塑剤としてDEHP[di-(2-ethylhexyl)phthalate;フタル酸ジ-(2-エチルヘキシル)]を含むポリ塩化ビニル製の輸液セット等を使用した場合、DEHPが製剤中に溶出するので、DEHPを含まない輸液セット等を使用することが望ましい。
14.2 薬剤投与時の注意
本剤は脂肪乳剤を含有しているため、ポリカーボネート製の三方活栓や延長チューブ等を使用した場合、コネクター部分にひび割れが発生し、血液及び薬液漏れ、空気混入等の可能性がある。その場合、必要な投与量が確保されず期待された鎮痛効果が得られない可能性があるので注意すること。
15. その他の注意
15.1 臨床使用に基づく情報
非ステロイド性消炎鎮痛剤を長期間投与されている女性において、一時的な不妊が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
健康男子6名に本剤5mL(50mg)を単回静脈内投与した場合、フルルビプロフェン アキセチルは速やかに加水分解され、5分後には未変化体は認められず、フルルビプロフェンのみが認められた。フルルビプロフェンの血漿中濃度は6.7分後に最高となり(8.9μg/mL)、消失半減期は5.8時間であった7)。
16.3 分布
フルルビプロフェンのヒト血漿及び血清蛋白結合率は99.9%であった8)(in vitro)。
16.5 排泄
健康男子6名に本剤5mL(50mg)を単回静脈内投与した場合、投与24時間後の尿中にフルルビプロフェン、その水酸化体等の代謝物が認められ、それらの大部分は抱合体であった7)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
本剤の鎮痛作用は、フルルビプロフェン アキセチルがカルボキシエステラーゼにより加水分解されて生じたフルルビプロフェンのプロスタグランジン生合成阻害作用に基づくものと考えられる20)。
18.2 鎮痛作用
酢酸writhing法(マウス、ラット)、phenylquinone writhing法(マウス)、Randall&Selitto法(ラット)、硝酸銀関節炎疼痛法(ラット)及びadjuvant関節炎疼痛法(ラット)によるED50値で本剤の鎮痛作用を比較すると、筋注用ケトプロフェン及びペンタゾシンと同等かそれ以上であった。
鎮痛作用の持続時間は、硝酸銀関節炎疼痛法及びadjuvant関節炎疼痛法による鎮痛作用のED80値相当量を投与した試験において、ペンタゾシンより長く、筋注用ケトプロフェンとほぼ同等であった20)。
鎮痛作用の持続時間は、硝酸銀関節炎疼痛法及びadjuvant関節炎疼痛法による鎮痛作用のED80値相当量を投与した試験において、ペンタゾシンより長く、筋注用ケトプロフェンとほぼ同等であった20)。
18.3 消化管障害作用
ラットに本剤(静脈内)、フルルビプロフェン(経口)を単回投与及び7日連続投与した結果、両剤とも投与量に依存した胃粘膜障害がみられたが、本剤の胃粘膜障害作用はフルルビプロフェンより弱かった21)。
19. 有効成分に関する理化学的知見
19.1. フルルビプロフェン アキセチル
22. 包装
5mL[10、50アンプル]
23. 主要文献
- 今井正彦 他, 医薬品研究, 20, 42-47, (1989)
- 今井正彦 他, 薬理と治療, 16, 3671-3687, (1988)
- 今井正彦 他, 薬理と治療, 16, 3689-3712, (1988)
- 今井正彦 他, 薬理と治療, 16, 3731-3741, (1988)
- 今井正彦 他, 薬理と治療, 16, 3713-3730, (1988)
- データベース調査結果の概要(NDBを用いた非ステロイド性抗炎症薬による心血管系イベント発現のリスク評価), (https://www.pmda.go.jp/files/000270714.pdf)
- 東野正男 他, 基礎と臨床, 26, 3907-3921, (1992)
- 東野正男 他, 基礎と臨床, 22, 4031-4045, (1988)
- 古江尚 他, 臨牀と研究, 66, 1622-1630, (1989)
- 古江尚 他, 臨牀と研究, 66, 2303-2311, (1989)
- 百瀬隆, 基礎と臨床, 23, 2141-2146, (1989)
- 古江尚 他, 臨牀と研究, 66, 2014-2024, (1989)
- 百瀬隆, 基礎と臨床, 23, 2921-2926, (1989)
- 平賀一陽 他, 基礎と臨床, 22, 6523-6534, (1988)
- 松村公人, 基礎と臨床, 23, 917-922, (1989)
- 小川郁 他, 基礎と臨床, 23, 699-704, (1989)
- 吉野肇一, 新薬と臨床, 38, 166-174, (1989)
- 富岡峰敏 他, 診療と新薬, 26, 290-299, (1989)
- 古江尚 他, 医学と薬学, 21, 370-377, (1989)
- 栗山澄 他, 日本薬理学雑誌, 93, 61-73, (1989) »PubMed
- 社内資料:ラット胃障害誘起作用−同種同効注射薬との比較試験−
24. 文献請求先及び問い合わせ先
文献請求先
科研製薬株式会社
医薬品情報サービス室
〒113-8650
東京都文京区本駒込二丁目28番8号
電話:フリーダイヤル 0120-519-874
製品情報問い合わせ先
科研製薬株式会社
医薬品情報サービス室
〒113-8650
東京都文京区本駒込二丁目28番8号
電話:フリーダイヤル 0120-519-874
26. 製造販売業者等
26.1 製造販売元
科研製薬株式会社
東京都文京区本駒込二丁目28番8号