医薬品情報
| 総称名 | ダラシン |
|---|---|
| 一般名 | クリンダマイシン塩酸塩 |
| 欧文一般名 | Clindamycin Hydrochloride |
| 薬効分類名 | 抗生物質製剤 |
| 薬効分類番号 | 6112 |
| ATCコード | D10AF01 J01FF01 |
| KEGG DRUG |
D02132
クリンダマイシン塩酸塩
|
| KEGG DGROUP |
DG00435
クリンダマイシン
DG01578
リンコサミド系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ダラシンカプセル75mg | Dalacin Capsules 75mg | ファイザー | 6112001M1031 | 17.6円/カプセル | 処方箋医薬品注) |
| ダラシンカプセル150mg | Dalacin Capsules 150mg | ファイザー | 6112001M2038 | 23.8円/カプセル | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分又はリンコマイシン系抗生物質に対し過敏症の既往歴のある患者
2.2 エリスロマイシンを投与中の患者[10.1参照]
4. 効能または効果
<適応菌種>
<適応症>
表在性皮膚感染症、深在性皮膚感染症、慢性膿皮症、咽頭・喉頭炎、扁桃炎、急性気管支炎、肺炎、慢性呼吸器病変の二次感染、涙嚢炎、麦粒腫、外耳炎、中耳炎、副鼻腔炎、顎骨周辺の蜂巣炎、顎炎、猩紅熱
5. 効能または効果に関連する注意
<咽頭・喉頭炎、扁桃炎、急性気管支炎、中耳炎、副鼻腔炎>
5.1 「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
<効能共通>
6. 用法及び用量
通常、成人はクリンダマイシン塩酸塩として1回150mg(力価)を6時間ごとに経口投与、重症感染症には1回300mg(力価)を8時間ごとに経口投与する。
小児には体重1kgにつき、1日量15mg(力価)を3〜4回に分けて経口投与、重症感染症には体重1kgにつき1日量20mg(力価)を3〜4回に分けて経口投与する。ただし、年齢、体重、症状等に応じて適宜増減する。
小児には体重1kgにつき、1日量15mg(力価)を3〜4回に分けて経口投与、重症感染症には体重1kgにつき1日量20mg(力価)を3〜4回に分けて経口投与する。ただし、年齢、体重、症状等に応じて適宜増減する。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 衰弱患者、大腸炎等の既往歴のある患者
9.1.2 アトピー性体質の患者
重症の即時型アレルギー反応があらわれるおそれがある。
9.1.3 食道通過障害のある患者
食道に停留し、崩壊すると、食道炎や食道潰瘍を起こすおそれがある。[14.1.1参照]
9.1.4 重症筋無力症の患者
本剤は筋への直接作用により収縮を抑制するので、症状が悪化するおそれがある。
9.2 腎機能障害患者
腎排泄は本剤の主排泄経路ではないが、消失半減期が延長するおそれがある。
9.3 肝機能障害患者
胆汁排泄のため、消失半減期が延長するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中へ移行する。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
10.1 併用禁忌
| エリスロマイシン (エリスロシン等) [2.2参照] | 併用しても本剤の効果があらわれないと考えられる。 | 細菌のリボゾーム50S Subunitへの親和性が本剤より高い。 |
10.2 併用注意
| 末梢性筋弛緩剤 スキサメトニウム ツボクラリン等 | 筋弛緩作用が増強される。 | 本剤は神経筋遮断作用を有する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)
呼吸困難、全身潮紅、血管浮腫、蕁麻疹等のアナフィラキシーを伴うことがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、血圧の維持、体液の補充管理、気道の確保等の適切な処置を行うこと。
11.1.2 偽膜性大腸炎等の血便を伴う重篤な大腸炎(頻度不明)
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、急性汎発性発疹性膿疱症(頻度不明)、剥脱性皮膚炎(頻度不明)
11.1.4 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがあるので、観察を十分に行い、このような症状があらわれた場合には、投与を中止し、適切な処置を行うこと。投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること2)。
11.1.5 汎血球減少(頻度不明)、無顆粒球症(頻度不明)、血小板減少(頻度不明)[8.3参照]
11.1.6 間質性肺炎(頻度不明)、PIE症候群(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、PIE症候群があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.7 肝機能障害(頻度不明)、黄疸(頻度不明)
AST、ALT、Al-P等の上昇を伴う肝機能障害、黄疸があらわれることがある。[8.4参照]
11.1.8 急性腎障害(頻度不明)[8.5参照]
11.2 その他の副作用
| 頻度不明 | |
| 消化器 | 食道炎、食道潰瘍、下痢、軟便、食欲不振、悪心・嘔吐、腹痛、舌炎 |
| 過敏症 | そう痒、発疹、浮腫 |
| 血液a) | 好酸球増多、白血球減少、顆粒球減少 |
| 肝臓b) | Al-Pの上昇、ASTの上昇、ALTの上昇 |
| 腎臓c) | BUNの上昇、クレアチニンの上昇、NPNの上昇、窒素血症、乏尿、蛋白尿 |
| 神経系 | 耳鳴、めまい |
| 菌交代症 | 口内炎、カンジダ症 |
| その他 | 発熱、頭痛、倦怠感、腟炎、小水疱性皮膚炎、多発性関節炎、苦味 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 多め(コップ一杯程度)の水又は牛乳で服用させ、就寝直前の服用を避け、服用後30分は横にならないよう指導すること。食道に停留し、崩壊すると、まれに食道炎や食道潰瘍を起こすことがある。[9.1.3参照]
14.1.2 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人3例に1回300mg(力価)を経口投与したときの血中濃度は投与後1時間でピーク(平均3.25μg/mL)に達した3)。
16.4 代謝
クリンダマイシンは肝で代謝され、N-デメチルクリンダマイシンとクリンダマイシンスルホキシドの2つの抗菌活性のある代謝産物を生じる4)。
16.5 排泄
健康成人4例に1回150mg(力価)を経口投与したときの24時間までの尿中排泄率は平均17.7%であった5)。
18. 薬効薬理
18.1 作用機序
細菌のリボゾーム50S Subunitに作用し、ペプチド転移酵素反応を阻止し蛋白合成を阻害する。
18.2 抗菌作用
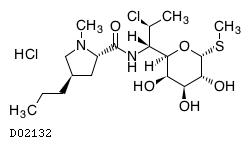
19. 有効成分に関する理化学的知見
19.1. クリンダマイシン塩酸塩
22. 包装
<ダラシンカプセル75mg>
100カプセル[10カプセル(PTP)×10]
<ダラシンカプセル150mg>
100カプセル[10カプセル(PTP)×10]
23. 主要文献
- 厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
- 厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
- 上田 泰ほか, Chemotherapy(Tokyo)., 17 (5), 817-821, (1969)
- 中山 一誠ほか, Jpn J Antibiot., 30 (4), 266-277, (1977)
- 中川 圭一ほか, Chemotherapy(Tokyo)., 17 (5), 788-792, (1969)
- 中沢 昭三ほか, Chemotherapy(Tokyo)., 17 (5), 752-757, (1969)
- 北本 治ほか, Chemotherapy(Tokyo)., 17 (5), 822-827, (1969)
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
製品情報問い合わせ先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7