医薬品情報
| 総称名 | アルケラン |
|---|---|
| 一般名 | メルファラン |
| 欧文一般名 | Melphalan |
| 製剤名 | メルファラン錠 |
| 薬効分類名 | 抗多発性骨髄腫剤 |
| 薬効分類番号 | 4219 |
| ATCコード | L01AA03 |
| KEGG DRUG |
D00369
メルファラン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年8月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 13.過量投与 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アルケラン錠2mg | Alkeran Tablets2mg | サンドファーマ | 4219002F1034 | 113.4円/錠 | 毒薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 白血球数2000/mm3以下又は血小板数50000/mm3以下に減少した患者[致死的な感染症誘発や出血傾向増大の危険性が高くなる。]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
下記疾患の自覚的ならびに他覚的症状の寛解
6. 用法及び用量
(1)1日1回メルファランとして2〜4mgを連日経口投与する。
又は、
又は、
(2)1日1回メルファランとして6〜10mgを4〜10日間(総量40〜60mg)経口投与し、休薬して骨髄機能の回復を待ち(通常2〜6週間)、1日2mgの維持量を投与する。
又は、
又は、
(3)1日1回メルファランとして6〜12mgを4〜10日間(総量40〜60mg)経口投与し、休薬して骨髄機能の回復を待ち(通常2〜6週間)、同様の投与法を反復する。
なお、投与中は頻回に血液検査を行い、特に白血球数、血小板数を指標として適宜用量を増減又は休薬する。
なお、投与中は頻回に血液検査を行い、特に白血球数、血小板数を指標として適宜用量を増減又は休薬する。
7. 用法及び用量に関連する注意
本剤の投与により、骨髄抑制があらわれるので血液検査を十分に行い、特に白血球数が3000/mm3以下又は血小板数100000/mm3以下に減少した場合は骨髄機能が回復するまで減量又は休薬すること。
8. 重要な基本的注意
8.2 骨髄異形成症候群(MDS)、急性白血病が発生したとの報告があるので、本剤を投与する際は、患者に対する有益性及び危険性を考慮すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 他の化学療法剤の投与中又は投与直後の患者あるいは放射線照射中又は照射直後の患者
9.1.2 感染症がある患者
感染症が増悪するおそれがある。
9.1.3 尿毒症を伴う患者
観察を十分に行い適宜減量のこと。本剤の毒性が増大される。
9.2 腎機能障害患者
投与量が過多にならないよう考慮すること。腎機能障害のある患者では本剤のクリアランスが低下し、本剤による副作用が増強するおそれがある。
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性には、投与中及び投与終了後一定期間は適切な避妊をするよう指導すること。[9.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。妊娠中に本剤を使用する場合、又は本剤を使用中に妊娠した場合は、胎児に異常が生じる可能性があることを患者に説明すること。
動物試験(雌ラット)に大量投与(1.0mg/kg以上)した際に、胚・胎児の死亡及び催奇形性が報告されており、また他のアルキル化剤(シクロホスファミド)で催奇形性を疑う症例報告がある。[9.4.1参照]
動物試験(雌ラット)に大量投与(1.0mg/kg以上)した際に、胚・胎児の死亡及び催奇形性が報告されており、また他のアルキル化剤(シクロホスファミド)で催奇形性を疑う症例報告がある。[9.4.1参照]
9.6 授乳婦
授乳しないことが望ましい。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。本剤は、主として腎臓から排泄されるが、高齢者では腎機能が低下していることが多いため、高い血中濃度が持続するおそれがある。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制(66.0%)
11.1.2 ショック、アナフィラキシー(いずれも頻度不明)
症状に伴ってまれに心停止(頻度不明)が起こることがある。
11.1.3 重篤な肝障害(7.5%)、黄疸(2.2%)
肝炎や黄疸があらわれることがある。
11.1.4 間質性肺炎、肺線維症(いずれも頻度不明)
異常が認められた場合には投与を中止し、副腎皮質ホルモン剤投与等の適切な処置を行うこと。
11.1.5 溶血性貧血(頻度不明)
11.2 その他の副作用
| 0.1%以上 | 頻度不明 | |
| 消化器 | 悪心、嘔吐、食欲不振、口内炎 | 腹痛、胃重感、下痢、腹部膨満感、胃・十二指腸潰瘍 |
| 過敏症 | 発疹 | 発熱、そう痒感、紅斑、丘疹、めまい、血圧低下、呼吸困難、蕁麻疹、浮腫 |
| 皮膚 | 脱毛 | |
| 肝臓 | AST上昇、ALT上昇、Al-P上昇、LDH上昇、ビリルビン上昇、γ-GTP上昇 | |
| その他 | 感染誘発、卵巣機能不全、月経異常、BUN増加 |
13. 過量投与
13.1 症状
本剤の過量の経口投与において、最も起こり得る初期症状は悪心、嘔吐及び下痢である。また、主な副作用は白血球減少、血小板減少及び貧血をきたす骨髄抑制である。
13.2 処置
本剤は血液透析により除去されないとの報告がある3)。本剤の過量投与が疑われた場合は、輸血、血液造血因子、抗感染症薬の投与等の支持療法を行うこと。また、必要に応じ無菌管理を考慮すること。
15. その他の注意
15.1 臨床使用に基づく情報
本剤を投与した患者において染色体異常が認められたとの報告がある。
15.2 非臨床試験に基づく情報
15.2.1 マウス(1回0.75及び1.5mg/kgを週3回、6ヵ月間、腹腔内投与)及びラット(1回0.9及び1.8mg/kgを週3回、6ヵ月間、腹腔内投与)におけるがん原性試験で、マウスでは肺腫瘍及びリンパ肉腫の発生、ラットでは腹膜肉腫の発生が報告されている。
15.2.2 本剤は動物試験(ラット及びマウス)において遺伝毒性が認められている。
15.2.3 動物試験(ラット及びイヌ)において精子形成抑制作用が認められたとの報告がある。
15.2.4 類縁薬シクロホスファミドを投与した雄ラットを、シクロホスファミドを投与しない雌ラットと交配させたところ、胎仔の死亡増加及び奇形を認めたとの報告がある。
16. 薬物動態
16.1 血中濃度
成人悪性腫瘍患者に経口投与された14C標識メルファラン(4.4〜6.4mg/m2/日注))は、投与2時間後に最高血中濃度に達した4)(外国人データ)。
16.5 排泄
成人悪性腫瘍患者に経口投与された14C標識メルファラン(4.4〜6.4mg/m2/日注))は、緩徐な排泄パターンを示し、投与後6日間で、投与量の約30%が尿中に排泄され、また20〜50%が糞便中に排泄された4)(外国人データ)。
注)本剤の承認された1日投与量は2〜12mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内一般臨床試験
昭和42年9月より昭和51年12月に実施された、多発性骨髄腫患者234症例における一般臨床試験の概要は次のとおりである5)。
| 多発性骨髄腫治療効果判定項目 | 有効 | やや有効 | 無効 |
| 自覚症状の改善 (骨痛の軽快その他) | 114例(54.5%) | 64例 | 31例 |
| 末梢血液像の改善 (Hb量の改善その他) | 56例(26.8%) | 56例 | 97例 |
| 骨髄像の改善 (形質細胞百分比の減少その他) | 78例(44.6%) | 40例 | 57例 |
| M成分量の減少 血清骨髄腫蛋白の減少 | 96例(43.8%) | 63例 | 60例 |
| M成分量の減少 尿BJ蛋白の減少 | 48例(50.0%) | 12例 | 36例 |
| 骨レ線所見の改善 | 11例(6.3%) | 32例 | 131例 |
| 血清カルシウムの減少 | 14例(18.7%) | 21例 | 40例 |
| 腎機能の改善 (BUNその他の改善) | 19例(21.1%) | 23例 | 48例 |
18. 薬効薬理
18.1 作用機序
メルファランは、ヒト多発性骨髄腫細胞のDNA合成開始を抑制することによりその増殖を抑制する6)。
18.2 抗腫瘍効果
メルファランは、多発性骨髄腫に罹患した患者における骨髄腫細胞に対し、増殖抑制作用を示す6)。
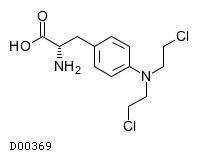
19. 有効成分に関する理化学的知見
19.1. メルファラン
20. 取扱い上の注意
開封後は湿気を避けて遮光して保存すること。
22. 包装
25錠[瓶、バラ]
23. 主要文献
- Russell,L.B.,et al., Mutat Res., 282, 151-158, (1992) »PubMed
- Generoso,W.M.,et al., Mutat Res., 345, 167-180, (1995) »PubMed
- Tricot,G.,et al., Blood., 84, 180A, (1994)
- Tattersall,M.H.N.,et al., Eur J Cancer., 14, 507-513, (1978)
- Melphalan治療研究グループ, 臨床血液, 18, 961-972, (1977) »PubMed
- 原 宏ほか, 日本血液学会雑誌, 34, 614-621, (1971) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
サンド株式会社
カスタマーケアグループ
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-982-001
FAX:03-6257-3633
製品情報問い合わせ先
サンド株式会社
カスタマーケアグループ
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-982-001
FAX:03-6257-3633