医薬品情報
| 総称名 | イミグラン |
|---|---|
| 一般名 | スマトリプタンコハク酸塩 |
| 欧文一般名 | Sumatriptan Succinate |
| 製剤名 | スマトリプタンコハク酸塩注射液 |
| 薬効分類名 | 5-HT1B/1D受容体作動型片頭痛治療剤 |
| 薬効分類番号 | 2160 |
| ATCコード | N02CC01 |
| KEGG DRUG |
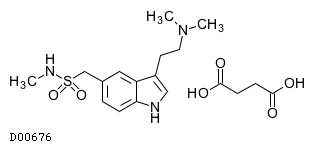
D00676
スマトリプタンコハク酸塩
|
| KEGG DGROUP |
DG00836
スマトリプタン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| イミグランキット皮下注3mg | IMIGRAN Kit Subcutaneous Injection 3mg | グラクソ・スミスクライン | 2160402G1026 | 1699円/筒 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 心筋梗塞の既往歴のある患者、虚血性心疾患又はその症状・兆候のある患者、異型狭心症(冠動脈攣縮)のある患者[不整脈、狭心症、心筋梗塞を含む重篤な虚血性心疾患様症状があらわれることがある]
2.3 脳血管障害や一過性脳虚血性発作の既往のある患者[脳血管障害や一過性脳虚血性発作があらわれることがある]
2.4 末梢血管障害を有する患者[症状を悪化させる可能性が考えられる]
2.5 コントロールされていない高血圧症の患者[一過性の血圧上昇を引き起こすことがある]
2.6 重篤な肝機能障害を有する患者[9.3.1参照]
2.7 エルゴタミン、エルゴタミン誘導体含有製剤、あるいは他の5-HT1B/1D受容体作動薬を投与中の患者[10.1参照]
4. 効能または効果
○片頭痛
○群発頭痛
5. 効能または効果に関連する注意
5.1 本剤は国際頭痛学会による片頭痛、群発頭痛診断基準1)により「前兆のない片頭痛」、「前兆のある片頭痛」あるいは群発頭痛と確定診断が行われた場合にのみ投与すること。特に次のような患者は、くも膜下出血等の脳血管障害や他の原因による頭痛の可能性があるので、本剤投与前に問診、診察、検査を十分に行い、頭痛の原因を確認してから投与すること。
・今までに片頭痛又は群発頭痛と診断が確定したことのない患者
・片頭痛又は群発頭痛と診断されたことはあるが、片頭痛又は群発頭痛に通常見られる症状や経過とは異なった頭痛及び随伴症状のある患者
5.2 家族性片麻痺性片頭痛、孤発性片麻痺性片頭痛、脳底型片頭痛あるいは眼筋麻痺性片頭痛の患者には投与しないこと。
6. 用法及び用量
片頭痛及び群発頭痛発作の頭痛発現時に、通常、成人にはスマトリプタンとして1回3mgを皮下投与する。なお、年齢、症状により適宜増減する。
ただし、1回3mg、1日6mgを超えないこと。
ただし、1回3mg、1日6mgを超えないこと。
<片頭痛>
1回の頭痛発作において、初回投与で頭痛が軽減した場合には、24時間以内に起こった次の発作に対して追加投与することができるが、2回の投与の間には少なくとも1時間の間隔をおくこと。
<群発頭痛>
1日2回の発作に投与することができるが、2回の投与の間には少なくとも1時間の間隔をおくこと。
7. 用法及び用量に関連する注意
7.1 本剤は頭痛発現時にのみ使用し、予防的には使用しないこと。
7.2 本剤投与により全く効果が認められない場合は、その発作に対して追加投与をしないこと。このような場合は、再検査の上、頭痛の原因を確認すること。
7.3 スマトリプタン製剤を組み合わせて使用する場合には少なくとも以下の間隔をあけて投与すること。
・注射液投与後に経口剤あるいは点鼻液を追加投与する場合には1時間以上
・経口剤投与後に注射液を追加投与する場合には2時間以上
・点鼻液投与後に注射液を追加投与する場合には2時間以上
8. 重要な基本的注意
8.2 片頭痛あるいは本剤投与により眠気を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械操作に従事させないよう十分注意すること。
8.3 本剤の自己投与の適用にあたっては、患者自らが適切に使用可能と医師が判断した患者に対してのみ交付すること。
8.4 患者に本剤を交付する際には、使用方法等の患者教育を十分に行い、本剤の注射により発現する可能性のある副作用等についても十分説明すること。また自己注射後何らかの異常があればすぐに医師の指示を仰ぐよう患者を指導すること。
8.5 本剤の注射針カバーは天然ゴムラテックスを含み、アレルギー反応を起こすことがあるので、投与に際し、問診を行うこと。また、観察を十分に行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 虚血性心疾患の可能性のある患者
9.1.2 てんかん様発作の既往又は危険因子のある患者(脳炎等の脳疾患のある患者、痙攣の閾値を低下させる薬剤を使用している患者等)
9.1.3 スルホンアミド系薬剤に過敏症の既往歴のある患者
本剤はスルホンアミド基を有するため、交叉過敏症(皮膚の過敏症からアナフィラキシーまで)があらわれる可能性がある。[11.1.1参照]
9.1.4 コントロールされている高血圧症患者
一過性の血圧上昇や末梢血管抵抗の上昇がみられたとの報告がある。
9.1.5 脳血管障害の可能性のある患者
脳血管障害があらわれるおそれがある。
9.2 腎機能障害患者
本剤は腎臓を介して排泄されるので、重篤な腎機能障害患者では血中濃度が上昇するおそれがある。[16.5参照]
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害患者
投与しないこと。本剤は主に肝臓で代謝されるので、重篤な肝機能障害患者では血中濃度が上昇するおそれがある。[2.6参照]
9.3.2 肝機能障害患者(重篤な肝機能障害患者を除く)
中等度の肝機能障害患者に本剤を経口投与したとき、健康成人と比較して血中濃度が上昇した。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
本剤投与後12時間は授乳しないことが望ましい。皮下投与後にヒト母乳中へ移行することが認められている2)(外国人データ)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
高い血中濃度が持続するおそれがある。本剤は主として肝臓で代謝され、腎臓で排泄されるが、高齢者では肝機能あるいは腎機能が低下していることが多い。
10. 相互作用
相互作用序文
薬物代謝酵素用語
MAO-A
10.1 併用禁忌
| エルゴタミン エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン(クリアミン) エルゴタミン誘導体含有製剤 ジヒドロエルゴタミンメシル酸塩 エルゴメトリンマレイン酸塩(エルゴメトリンF) メチルエルゴメトリンマレイン酸塩(パルタンM) [2.7参照] | 血圧上昇又は血管攣縮が増強されるおそれがある。 本剤投与後にエルゴタミンあるいはエルゴタミン誘導体含有製剤を投与する場合、もしくはその逆の場合は、それぞれ24時間以上の間隔をあけて投与すること。 | 5-HT1B/1D受容体作動薬との薬理的相加作用により、相互に作用(血管収縮作用)を増強させる。 |
| 5-HT1B/1D受容体作動薬 ゾルミトリプタン(ゾーミッグ) エレトリプタン臭化水素酸塩(レルパックス) リザトリプタン安息香酸塩(マクサルト) ナラトリプタン塩酸塩(アマージ) [2.7参照] | 血圧上昇又は血管攣縮が増強されるおそれがある。 本剤投与後に他の5-HT1B/1D受容体作動型の片頭痛薬を投与する場合、もしくはその逆の場合は、それぞれ24時間以内に投与しないこと。 | 併用により相互に作用を増強させる。 |
| MAO阻害剤 [2.8、16.4、16.7.1参照] | 本剤の消失半減期(t1/2)が延長し、血中濃度−時間曲線下面積(AUC)が増加するおそれがあるので、MAO阻害剤を投与中あるいは投与中止2週間以内の患者には本剤を投与しないこと。 | MAO阻害剤により本剤の代謝が阻害され、本剤の作用が増強される可能性が考えられる。 |
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシーショック、アナフィラキシー(いずれも1%未満)[9.1.3参照]
11.1.2 虚血性心疾患様症状(1%未満)
11.1.4 薬剤の使用過多による頭痛(頻度不明)[8.6参照]
11.2 その他の副作用
| 1%以上注1) | 1%未満注1) | 頻度不明注1) | |
| 過敏症 | 蕁麻疹、発疹等の皮膚症状 | ||
| 呼吸器 | 呼吸困難 | ||
| 循環器 | 頻脈、徐脈、一過性の血圧上昇、低血圧、動悸、レイノー現象 | ||
| 消化器 | 悪心、嘔吐 | 虚血性大腸炎 | |
| 眼 | ちらつき、視野狭窄 | 複視、眼振、暗点、一過性の視力低下 | |
| 精神神経系 | めまい、眠気、感覚障害(錯感覚、しびれなどの感覚鈍麻等) | 振戦、ジストニア | |
| 肝臓 | 肝機能障害 | ||
| 注射部位 | 痛み、腫脹 | 灼熱感、紅斑、挫傷、出血 | |
| その他 | 痛み(胸痛、咽喉頭痛、頭痛、筋肉痛、関節痛、背部痛、頚部痛等)注2)、熱感注2) | 圧迫感注2)、ひっ迫感注2)、倦怠感、脱力感、潮紅 | 重感注2)、冷感注2) |
13. 過量投与
13.1 処置
本剤の消失半減期は約2時間であり、少なくとも10時間、あるいは症状・徴候が持続する限り患者をモニターすること。[16.1.1参照]
14. 適用上の注意
14.1 薬剤交付時の注意
患者には本剤に添付の使用説明書を渡し、使用方法を指導すること。
14.2 薬剤投与時の注意
14.2.1 必ず専用のペン型注入器(イミグランキット皮下注3mg用注入器)を用いること。
14.2.2 カートリッジパック上部の封緘シールがはがれている場合、そのシリンジは使用しないこと。
14.2.3 本剤は滅菌済みであるため、カートリッジパックから取り出した後は、速やかに使用すること。
14.2.4 使用済みの本剤を誤って再使用することのないよう注意すること。
14.2.5 本剤は皮下注射のみに使用し、静脈内投与はしないこと。静脈内投与により血管攣縮をおこす可能性がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性にスマトリプタン(以下、アンプル製剤)又は本剤(以下、キット製剤)を用いて3mgを単回皮下投与した時の血漿中スマトリプタン濃度は下記のとおりである。両製剤は生物学的に同等であった。[13.1参照]
図1 健康成人男性における単回投与時の血漿中スマトリプタン濃度(平均値±標準偏差)
| 製剤 | 投与量 | Cmax(ng/mL) | AUC0-8(ng・hr/mL) | Tmax(hr) | t1/2(hr) |
| アンプル製剤 | 3mg | 56.9±11.6 | 52.2±5.6 | 0.23±0.06 | 1.78±0.27 |
| キット製剤 | 3mg | 64.7±13.0 | 52.8±5.4 | 0.18±0.04 | 1.71±0.26 |
| Cmax | AUC0-8 | |
| 幾何平均値の比(キット製剤/アンプル製剤) | 1.138 | 1.010 |
| 幾何平均値の比の90%信頼区間 | 1.052-1.231 | 0.985-1.036 |
16.3 分布
In vitroでのヒト血漿蛋白結合率は約34%であった。
16.4 代謝
16.5 排泄
16.7 薬物相互作用
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
片頭痛及び群発頭痛患者を対象に本剤(以下、キット製剤)を自己注射した時の成績は以下のとおりであった。
(1)頭痛改善度及び適正自己注射率
| 対象疾患名 | 有効率注1) | 適正自己注射率注2) |
| 片頭痛 | 93.9%(31/33例) | 100%(33/33例) |
| 群発頭痛 | 93.9%(31/33例) | 100%(33/33例) |
(2)患者評価によるキット製剤の使用感
| 対象疾患名 | 「本キット製剤は使いやすかったですか?」 | 「次回も本キット製剤を使いたいですか?」 | 「あなたの頭痛の治療に本キット製剤は必要だと思いますか?」 | |||
| はい | いいえ | はい | いいえ | はい | いいえ | |
| 片頭痛 | 97.0%(32/33例) | 3.0%(1/33例) | 93.9%(31/33例) | 6.1%(2/33例) | 93.9%(31/33例) | 6.1%(2/33例) |
| 群発頭痛 | 100.0%(33/33例) | 0 | 93.9%(31/33例) | 6.1%(2/33例) | 87.9%(29/33例) | 12.1%(4/33例) |
(3)頭痛改善度の経時的推移
| 対象疾患名 | 有効率注) | |||
| 投与後10分 | 投与後20分 | 投与後30分 | 投与後60分 | |
| 片頭痛 | 30.3%(10/33例) | 51.5%(17/33例) | 75.8%(25/33例) | 93.9%(31/33例) |
| 群発頭痛 | 63.6%(21/33例) | 78.8%(26/33例) | 93.9%(31/33例) | / |
図1 頭痛改善度の経時的推移
副作用発現頻度は、16.7%(11/66例)であった。主な副作用は、倦怠感及び圧迫感4.5%(3/66例)、脱力感、悪心及び眠気3.0%(2/66例)であった。
17.1.2 国内臨床試験
18. 薬効薬理
18.1 作用機序
18.2 5-HT1受容体に対する作用
18.3 各種摘出血管に対する作用
In vitroにおいて、イヌ及びヒトの摘出脳底動脈、ヒト摘出中硬膜動脈、ヒト側頭動脈、ヒト大脳動脈及びヒト摘出硬膜内の動脈を濃度依存的(1pM〜100μM)に収縮させた15)16)17)18)。これらの収縮は、5-HT1B/1D受容体の選択的拮抗薬であるGR55562やこれより選択性の劣る5-HT1受容体拮抗薬メチオテピンで抑制された15)16)17)18)(in vitro)。一方、イヌ冠動脈や大腿動脈などの末梢血管に対してはほとんど作用を示さなかった24)(in vitro)。ヒト摘出冠動脈に対しては、TXA2類似薬であるU-46619の0.1μMに対して最大約10%程の弱い収縮作用を示した25)(in vitro)。
18.4 麻酔動物の血管床に対する作用
18.5 脳循環に対する作用
片頭痛発作時の成人患者に3mg又は6mgを皮下投与すると、臨床症状の改善と相関して、内頚動脈と中大脳動脈の血流速度が用量依存的に増加することが報告されている20)(外国人データ)。
19. 有効成分に関する理化学的知見
19.1. スマトリプタンコハク酸塩
20. 取扱い上の注意
本剤には注射針がついているため、誤刺や感染防止に留意し、安全な方法で廃棄すること。
22. 包装
0.5mL[1シリンジ]×2
23. 主要文献
- International Headache Society, Cephalalgia., 38, 1-211, (2018)
- Wojnar-Horton RE,et al., Br J Clin Pharmacol., 41, 217-221, (1996) »PubMed
- Tarbit MH,et al., Biochem Pharmacol., 47, 1253-1257, (1994)
- 海老原昭夫ほか, 臨床医薬, 9, 767-776, (1993)
- Scott AK,et al., Br J Clin Pharmacol., 32, 581-584, (1991) »PubMed
- Van Hecken AM,et al., Br J Clin Pharmacol., 34, 82-84, (1992) »PubMed
- 田崎義昭ほか, 臨床医薬, 9, 1077-1093, (1993)
- 田崎義昭ほか, 臨床医薬, 9, 1095-1106, (1993)
- 檀健二郎ほか, 臨床成人病, 24, 123-130, (1994)
- 田崎義昭ほか, 臨床医薬, 9, 1897-1909, (1993)
- 檀健二郎ほか, 臨床成人病, 24, 251-257, (1994)
- 田崎義昭ほか, 臨床医薬, 9, 1911-1923, (1993)
- 坂井文彦ほか, 臨床医薬, 16, 283-300, (2000)
- 坂井文彦ほか, 臨床医薬, 16, 301-323, (2000)
- Connor HE,et al., Br J Pharmacol., 96, 379-387, (1989) »PubMed
- Parsons AA,et al., Br J Pharmacol., 96, 434-440, (1989) »PubMed
- Humphrey PPA,et al., Serotonin:Molecular Biology,Receptors and Functional Effects., 421-429, (1991), (Basel:Birkhauser Verlag)
- Jansen I,et al., Cephalalgia., 12, 202-205, (1992) »PubMed
- 後藤好史ほか, 基礎と臨床, 27, 3609-3630, (1993)
- Caekebeke JFV,et al., Neurology., 42, 1522-1526, (1992)
- Goadsby PJ,et al., Ann Neurol., 33, 48-56, (1993) »PubMed
- McCarthy BG,et al., Headache., 29, 420-422, (1989) »PubMed
- 後藤好史ほか, 基礎と臨床, 27, 3593-3607, (1993)
- Humphrey PPA,et al., Br J Pharmacol., 94, 1123-1132, (1988)
- Connor HE,et al., Eur J Pharmacol., 161, 91-94, (1989) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
グラクソ・スミスクライン株式会社
メディカル・インフォメーション
東京都港区赤坂1-8-1
電話:0120-561-007(9:00〜17:45/土日祝日及び当社休業日を除く)
製品情報問い合わせ先
グラクソ・スミスクライン株式会社
メディカル・インフォメーション
東京都港区赤坂1-8-1
電話:0120-561-007(9:00〜17:45/土日祝日及び当社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1