医薬品情報
| 総称名 | バクトロバン |
|---|---|
| 一般名 | ムピロシンカルシウム水和物 |
| 欧文一般名 | Mupirocin Calcium Hydrate |
| 薬効分類名 | 鼻腔内MRSA除菌剤 |
| 薬効分類番号 | 6119 |
| ATCコード | D06AX09 R01AX06 |
| KEGG DRUG |
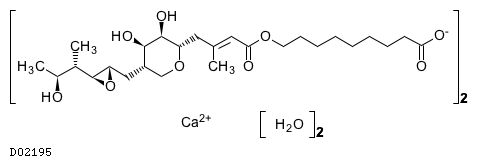
D02195
ムピロシンカルシウム水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年4月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 25.保険給付上の注意 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| バクトロバン鼻腔用軟膏2% | Bactroban Nasal Ointment | グラクソ・スミスクライン | 6119700M1035 | 524.4円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対して過敏症の既往歴のある者
4. 効能または効果
<適応菌種>
<適応症>
次の患者及び個人の保菌する鼻腔内のメチシリン耐性黄色ブドウ球菌(MRSA)の除菌
○MRSA感染症発症の危険性の高い免疫機能の低下状態にある患者(易感染患者)
○易感染患者から隔離することが困難な入院患者
○易感染患者に接する医療従事者
5. 効能または効果に関連する注意
5.1 本剤は、うがい、手洗い等の他の適切なMRSA感染対策を講じた上で、適用すること。
5.2 「易感染患者」については、「院内感染対策の手引き−MRSAに注目して−」1)で定義されている易感染患者(次に示す患者)を参考に、自らの鼻腔内に保菌するMRSAにより患者が内因性のMRSA感染症を発症する危険性が高い場合に使用すること。
・高齢者、特に寝たきりの高齢患者
・免疫不全状態にある患者(悪性腫瘍患者、糖尿病患者、免疫抑制剤又は抗癌剤投与患者等)
・侵襲が大きく、長時間を要する手術患者(心臓、大血管手術、腹部大手術患者等)
・IVH施行患者
・気管内挿管等による長期呼吸管理患者
・広範囲の熱傷又は外傷患者
5.3 鼻腔内にMRSAを保菌する入院患者については、易感染患者から隔離するなど、易感染患者との接触を断つ措置を講ずること。やむを得ず、隔離することが困難な場合に本剤の適用を考慮すること。
5.4 鼻腔内にMRSAを保菌する医療従事者については、医師、看護師等で、易感染患者と頻回に接することが避けられない場合に本剤の適用を考慮すること。[25.2参照]
6. 用法及び用量
通常、適量を1日3回鼻腔内に塗布する。
7. 用法及び用量に関連する注意
使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、必要な最小限の期間(3日間程度)の投与にとどめ、漫然と長期にわたり投与しないこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 鼻腔内に損傷部位のある患者
海外での臨床試験において投与部位に軽度の局所反応(鼻炎様症状、刺激感等)が報告されている。
9.1.2 アレルギー疾患の既往歴のある患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 頻度不明 | |
| 投与部位 | 軽度の局所反応(鼻炎様症状、刺激感等) |
| 皮膚 | 過敏症(発疹、発赤、そう痒等) |
14. 適用上の注意
14.1 薬剤投与時の注意
熱傷、各種皮膚潰瘍(褥瘡、糖尿病性壊疽、外傷性皮膚欠損等)の際の皮膚における創面感染には使用しないこと。
16. 薬物動態
16.2 吸収
本剤を健康成人5例に対し、両鼻腔内に1回各0.1g 1日3回、3日間連続塗布したところ、ムピロシン及び主代謝物であるmonic acidは血清中及び尿中から検出されず、鼻腔内粘膜より極めて吸収されにくいことが確認された2)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
MRSAの鼻腔内保菌者に対し、本剤を1回60mg(片側の鼻腔に30mg)1日3回、3日間塗布した際の除菌効果(消失率)は、次のとおりであった。副作用は認められなかった3)。
| 被験者区分 | 最終塗布翌日 | 最終塗布1週間後 |
| 医療従事者 | 74/79(93.7%) | 76/77(98.7%) |
| 入院患者 | 37/50(74.0%) | 41/48(85.4%) |
| 合計 | 111/129(86.0%) | 117/125(93.6%) |
17.3 その他
17.3.1 皮膚安全性試験(鼻腔内粘膜安全性試験)
健康成人30例を対象に、軟膏基剤(プラセボ軟膏)を対照薬として1回約30mgずつ、1日3回、3日間の鼻腔内粘膜塗布比較試験を実施した結果、両群ともに鼻粘膜の異常は認められず、また、臨床検査及び理学的検査等すべての検査項目においても異常は認められなかった4)。
17.3.2 皮膚安全性試験(単純パッチテスト)
健康成人30例を対象に、背部皮膚に本剤及び軟膏基剤(プラセボ軟膏)、対照薬として白色ワセリン及びポビドンヨード製剤の各々約50mgずつをパッチ絆プレートを用いて閉塞塗布し、皮膚刺激性の検討を行った結果、本剤の皮膚刺激指数は、24時間、48時間の閉塞塗布とも0であり、皮膚刺激性に問題はないと考えられた。
18. 薬効薬理
18.1 作用機序
ムピロシンは、細菌の蛋白合成の初期段階において、イソロイシルtRNA合成酵素−イソロイシン−AMP複合体の生成を阻害する5)。その結果、ムピロシンは細菌のリボゾームにおけるペプチド合成を阻害し、細菌内での蛋白合成を抑制することによって抗菌活性を示す。
18.2 抗菌作用
ムピロシンは、MRSAに対し優れた抗菌力を発揮する。国内で臨床分離されたMRSA(519株)に対する90%最小発育阻止濃度(MIC90)は0.2μg/mLであり、すべての株が0.39μg/mL以下で発育を阻止された3)。
19. 有効成分に関する理化学的知見
19.1. ムピロシンカルシウム水和物
22. 包装
3g[1チューブ]×5
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
グラクソ・スミスクライン株式会社
メディカル・インフォメーション
東京都港区赤坂1-8-1
電話:0120-561-007(9:00〜17:45/土日祝日及び当社休業日を除く)
製品情報問い合わせ先
グラクソ・スミスクライン株式会社
メディカル・インフォメーション
東京都港区赤坂1-8-1
電話:0120-561-007(9:00〜17:45/土日祝日及び当社休業日を除く)
25. 保険給付上の注意
25.1 4.効能又は効果のうち、「MRSA感染症発症の危険性の高い免疫機能の低下状態にある患者(易感染患者)」及び「易感染患者から隔離することが困難な入院患者」の鼻腔内のMRSA除菌を目的として使用した場合にのみ保険給付される。
25.2 4.効能又は効果のうち、「易感染患者に接する医療従事者」の鼻腔内MRSAの除菌に使用する場合には、保険給付の対象とならない。[5.4参照]
26. 製造販売業者等
26.1 製造販売元
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1