医薬品情報
| 総称名 | シンフェーズ |
|---|---|
| 一般名 | ノルエチステロン エチニルエストラジオール |
| 欧文一般名 | Norethisterone Ethinylestradiol |
| 製剤名 | ノルエチステロン・エチニルエストラジオール錠 |
| 薬効分類名 | 経口避妊剤 |
| 薬効分類番号 | 2549 |
| ATCコード | G03AA05 G03AB04 |
| KEGG DRUG |
D04483
エチニルエストラジオール・ノルエチステロン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第4版)
経口避妊剤は、HIV感染(エイズ)及び他の性感染症(例えば梅毒、性器ヘルペス、淋病、クラミジア感染症、尖圭コンジローマ、腟トリコモナス症、B型肝炎等)を防止するものではないこと、これらの感染防止には、コンドームの使用が有効であることを服用者に十分説明すること。
なお、必要に応じ、性感染症検査の実施を考慮すること。
なお、必要に応じ、性感染症検査の実施を考慮すること。
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| シンフェーズT28錠 | Synphase T28 Tablets | 科研製薬 | 254910AF1042 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏性素因のある女性
2.4 血栓性静脈炎、肺塞栓症、脳血管障害、冠動脈疾患又はその既往歴のある患者[血液凝固能が亢進され、これらの症状が増悪することがある。][11.1.1参照]
2.6 前兆(閃輝暗点、星型閃光等)を伴う片頭痛の患者[前兆を伴う片頭痛の患者は前兆を伴わない患者に比べ脳血管障害(脳卒中等)が発生しやすくなるとの報告がある。][11.1.1参照]
2.7 肺高血圧症又は心房細動を合併する心臓弁膜症の患者、亜急性細菌性心内膜炎の既往歴のある心臓弁膜症の患者[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。][9.1.9、11.1.1参照]
2.8 血管病変を伴う糖尿病患者(糖尿病性腎症、糖尿病性網膜症等)[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。][11.1.1参照]
2.9 血栓性素因のある女性[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。][11.1.1参照]
2.10 抗リン脂質抗体症候群の患者[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。][11.1.1参照]
2.12 重篤な肝障害のある患者[9.3.1参照]
2.13 肝腫瘍のある患者[症状が増悪することがある。]
2.14 脂質代謝異常のある患者[血栓症等の心血管系の障害が発生しやすくなるとの報告がある。また、脂質代謝に影響を及ぼす可能性があるため、症状が増悪することがある。][11.1.1参照]
2.16 耳硬化症の患者[症状が増悪することがある。]
2.17 妊娠中に黄疸、持続性そう痒症又は妊娠ヘルペスの既往歴のある患者[症状が再発するおそれがある。]
2.19 授乳婦[9.6参照]
2.20 骨成長が終了していない可能性がある女性[骨端の早期閉鎖を来すおそれがある。]
4. 効能または効果
避妊
5. 効能または効果に関連する注意
経口避妊剤使用開始1年間の飲み忘れを含めた一般的使用における失敗率は9%との報告がある。[17.3参照]
6. 用法及び用量
1周期目は1日1錠を毎日一定の時刻に淡青色錠から開始し、指定された順番に従い、28日間連続経口投与する。
2周期目は、1周期服用開始29日目より1周期目と同様に淡青色錠から1日1錠を28日間連続投与し、3周期目以降は2周期目と同様に投与する。
2周期目は、1周期服用開始29日目より1周期目と同様に淡青色錠から1日1錠を28日間連続投与し、3周期目以降は2周期目と同様に投与する。
7. 用法及び用量に関連する注意
7.1 毎日一定の時刻に服用させること。
7.2 服用開始日
経口避妊剤を初めて服用させる場合、月経が始まった次の日曜日から(月経が日曜日に始まった場合は、その日から)服用を開始させる。この場合は、飲み始めの最初の1週間は他の避妊法を併用させること。
7.3 本剤の投与にあたっては飲み忘れ等がないよう服用方法を十分指導すること。万一飲み忘れがあった場合(だいだい色錠を除く)、翌日までに気づいたならば直ちに飲み忘れた錠剤を服用し、その日の錠剤も通常どおりに服用させる。
2日以上連続して飲み忘れがあった場合は服用を中止させ、次の月経を待ち投与を再開させること。
なお、飲み忘れにより妊娠する可能性が高くなるので、その周期は他の避妊法を使用させること。
2日以上連続して飲み忘れがあった場合は服用を中止させ、次の月経を待ち投与を再開させること。
なお、飲み忘れにより妊娠する可能性が高くなるので、その周期は他の避妊法を使用させること。
7.4 他の経口避妊剤から本剤に切り替える場合
7.4.1 21錠タイプの経口避妊剤から切り替える場合
前に服用していた薬剤をすべて服用し、7日間の休薬期間中の日曜日から服用を開始させる。服用開始が遅れた場合、妊娠の可能性がある。
7.4.2 28錠タイプの経口避妊剤から切り替える場合
前に服用していた薬剤のプラセボ錠服用期間中の日曜日から服用を開始させる。服用開始が遅れた場合、妊娠の可能性がある。
8. 重要な基本的注意
8.1本剤の服用により、年齢、喫煙、肥満、家族歴等のリスク因子の有無にかかわらず血栓症があらわれることがあるので、次のような症状があらわれた場合は直ちに投与を中止し、適切な処置を行うこと。
緊急対応を要する血栓症の主な症状
下肢の急激な疼痛・腫脹、突然の息切れ、胸痛、激しい頭痛、四肢の脱力・麻痺、構語障害、急性視力障害等
本剤服用者に対しても、このような症状があらわれた場合は、直ちに服用を中止し、救急医療機関を受診するよう説明すること。[11.1.1参照]
8.2 本剤の服用中に、血栓症が疑われる症状があらわれた場合は、投与を中止するなど適切な処置を行うこと。[11.1.1参照]
血栓症が疑われる症状
下肢の疼痛・腫脹・しびれ・発赤・熱感、頭痛、嘔気・嘔吐等
8.3 血栓症のリスクが高まる状態(体を動かせない状態、顕著な血圧上昇、脱水等)が認められる場合は、投与を中止するなど適切な処置を行うこと。[11.1.1参照]
8.4 本剤服用者には、投与開始時及び継続時に以下について説明すること。[11.1.1参照]
・血栓症は生命に関わる経過をたどることがあること。
・血栓症が疑われる症状があらわれた場合や、血栓症のリスクが高まる状態になった場合は、症状・状態が軽度であっても直ちに服用を中止し医師等に相談すること。
・血栓症を疑って他の医療機関を受診する際は、本剤の使用を医師に告知し、本剤による血栓症を念頭においた診察を受けられるようにすること。
8.7 本剤の投与にあたっては服用者の病歴調査及び検診が必要である。この検診には、血圧測定、乳房・腹部の検査及び臨床検査が含まれる。また、投与中は6ヵ月毎の検診を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 40歳以上の女性(ただし、1日15本以上の喫煙者には投与しないこと)
9.1.2 子宮筋腫のある患者
子宮筋腫の発育を促進するおそれがある。[8.8参照]
9.1.3 乳癌の既往歴のある女性
乳癌が再発するおそれがある。[8.9参照]
9.1.4 乳癌の家族歴又は乳房に結節のある女性
定期的に乳房検診を行うなど慎重に投与すること。エストロゲン投与と乳癌発生との因果関係についてその関連性を示唆する報告もある。[8.9参照]
9.1.5 喫煙者(ただし、35歳以上で1日15本以上の喫煙者には投与しないこと)
9.1.6 肥満の女性
血栓症等の心血管系の障害が発生しやすくなるとの報告がある。[11.1.1参照]
9.1.7 血栓症の家族歴を持つ女性
血栓症等の心血管系の障害が発生しやすくなるとの報告がある。[11.1.1参照]
9.1.8 前兆を伴わない片頭痛の患者
脳血管障害(脳卒中等)が発生しやすくなるとの報告がある。[11.1.1参照]
9.1.9 心臓弁膜症の患者(ただし、肺高血圧症又は心房細動を合併する心臓弁膜症の患者、亜急性細菌性心内膜炎の既往歴のある心臓弁膜症の患者には投与しないこと)
9.1.10 軽度の高血圧(妊娠中の高血圧の既往も含む)のある患者
9.1.11 耐糖能の低下している女性(糖尿病患者及び耐糖能異常の女性)
十分コントロールを行いながら投与すること。耐糖能が低下することがある。
9.1.12 ポルフィリン症の患者
症状が増悪することがある。
9.1.13 心疾患又はその既往歴のある患者
ナトリウム又は体液の貯留により症状が増悪することがある。
9.1.14 てんかん患者
症状が増悪することがある。
9.1.15 テタニーのある患者
症状が増悪することがある。
9.2 腎機能障害患者
9.2.1 腎疾患又はその既往歴のある患者
ナトリウム又は体液の貯留により症状が増悪することがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。[2.12参照]
9.3.2 肝障害のある患者(重篤な肝障害のある患者を除く)
代謝能が低下しており肝臓への負担が増加するため、症状が増悪することがある。
9.4 生殖能を有する者
9.4.2 服用中に激しい下痢、嘔吐が続いた場合には本剤の吸収不良を来すことがあり、その場合には妊娠する可能性が高くなるので、その周期は他の避妊法を併用させること。
9.4.4 本剤の服用を中止して妊娠を希望する場合には、月経周期が回復するまで避妊させることが望ましい。
9.5 妊婦
9.5.2 卵胞ホルモン剤を妊娠動物(マウス)に投与した場合、児の成長後腟上皮及び子宮内膜の悪性変性を示唆する結果が報告されている。
また、新生児(マウス)に投与した場合、児の成長後腟上皮の悪性変性を認めたとの報告がある。
また、新生児(マウス)に投与した場合、児の成長後腟上皮の悪性変性を認めたとの報告がある。
9.6 授乳婦
投与しないこと。他の避妊法をすすめるなど適切な指導をすること。母乳の量的質的低下が起こることがある。また、母乳中への移行、児において黄疸、乳房腫大が報告されている。[2.19参照]
10. 相互作用
10.2 併用注意
| 副腎皮質ホルモン プレドニゾロン等 三環系抗うつ剤 イミプラミン等 セレギリン塩酸塩 シクロスポリン テオフィリン オメプラゾール チザニジン | これらの薬剤の作用が増強するおそれがある。 | 本剤はこれらの薬剤の代謝を抑制すると考えられる。 |
| リファンピシン リファブチン バルビツール酸系製剤 フェノバルビタール等 ヒダントイン系製剤 フェニトインナトリウム等 カルバマゼピン ボセンタン モダフィニル トピラマート | 本剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがある。 | これらの薬剤は薬物代謝酵素を誘導し、本剤の代謝を促進すると考えられる。 |
| テトラサイクリン系抗生物質 テトラサイクリン等 ペニシリン系抗生物質 アンピシリン等 | 本剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがある。 | これらの薬剤は腸内細菌叢を変化させ、本剤の腸肝循環による再吸収を抑制すると考えられる。 |
| テルビナフィン塩酸塩 | 黄体ホルモン・卵胞ホルモン配合剤との併用で、月経異常があらわれたとの報告がある。 | 機序不明 |
| Gn-RH誘導体 ブセレリン酢酸塩等 | これらの薬剤の作用を減弱するおそれがある。 | これらの薬剤は性ホルモンの分泌を低下することにより薬効を示すため、性ホルモンである本剤の投与によってこれらの薬剤の効果を減弱する可能性が考えられる。 |
| 血糖降下剤 インスリン製剤 スルフォニル尿素系製剤 スルフォンアミド系製剤 ビグアナイド系製剤等 | 血糖降下剤の作用が減弱するおそれがある。血糖値その他患者の状態を十分観察し、血糖降下剤の用量を調節するなど注意する。 | 本剤は耐糖能を低下させ、血糖降下剤の作用を減弱させると考えられる。 |
| ラモトリギン モルヒネ サリチル酸 ロラゼパム(注射剤) | これらの薬剤の血中濃度が低下するおそれがある。 | 本剤はこれらの薬剤のグルクロン酸抱合を促進すると考えられる。 |
| HIVプロテアーゼ阻害剤 リトナビル ダルナビル等(リトナビル併用時) 非ヌクレオシド系逆転写酵素阻害剤 ネビラピン | エチニルエストラジオールのAUCが低下する。 | 機序不明 |
| アプレピタント ホスアプレピタント | 本剤の効果が減弱されるおそれがあるので、これらの薬剤の投与期間中及び最終投与から1ヵ月間は、代りの避妊法又は補助的避妊法を用いる必要がある。 | 機序は解明されていないが、これらの薬剤との併用により本剤の代謝が亢進することが報告されている。 |
| ベルズチファン | 本剤の効果が減弱されるおそれがあるので、ベルズチファンの投与期間中及び最終投与から1週間は、代りの避妊法又は補助的避妊法を用いる必要がある。 | ベルズチファンがCYP3Aを誘導することにより、本剤の血中濃度が低下する可能性がある。 |
| フルコナゾール | 本剤の血中濃度が上昇するおそれがある。 | フルコナゾールは本剤の代謝酵素(CYP3A4)を阻害すると考えられる。 |
| ボリコナゾール | 本剤の血中濃度が上昇するおそれがある。 ボリコナゾールの血中濃度が上昇するおそれがある。 | ボリコナゾールは本剤の代謝酵素(CYP3A4)を阻害すると考えられる。 本剤がボリコナゾールの代謝酵素(CYP2C19)を阻害すると考えられる。 |
| アセトアミノフェン | 本剤の血中濃度が上昇するおそれがある。 アセトアミノフェンの血中濃度が低下するおそれがある。 | アセトアミノフェンはエチニルエストラジオールの硫酸抱合を阻害すると考えられる。 本剤が肝におけるアセトアミノフェンのグルクロン酸抱合を促進すると考えられる。 |
| ルフィナミド | 本剤の効果が減弱化するおそれがある。 | 機序不明 |
| セイヨウオトギリソウ(St.John's Wort,セント・ジョーンズ・ワート)含有食品 | 本剤の効果の減弱化及び不正性器出血の発現率が増大するおそれがあるので、本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | この食品は薬物代謝酵素を誘導し、本剤の代謝を促進すると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 血栓症(四肢、肺、心、脳、網膜等)(頻度不明)
11.1.2 アナフィラキシー(頻度不明)
呼吸困難、蕁麻疹、血管性浮腫、そう痒感等があらわれることがある。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 過敏症 | 発疹 | ||
| 眼 | 網膜血流障害による視力障害 | ||
| 肝臓 | 黄疸、肝機能異常 | ||
| 電解質代謝 | 浮腫、体重増加 | ||
| 子宮 | 不正性器出血(破綻出血、点状出血)(17.2%) | 無月経、月経困難症、月経過多 | |
| 乳房 | 乳房痛、乳房緊満感 | ||
| 循環器 | 血圧上昇 | ||
| 消化器 | 悪心 | 嘔吐、食欲不振、腹痛、下痢、便秘、口内炎 | |
| 精神神経系 | 頭痛、倦怠感、眠気、めまい | 抑うつ | |
| 皮膚 | ざ瘡 | 色素沈着注) | |
| その他 | トリグリセリド上昇、血小板数増加 | しびれ感 |
12. 臨床検査結果に及ぼす影響
含有するエチニルエストラジオールの作用による血清蛋白(コルチコイド結合性グロブリン、サイロキシン結合性グロブリン等)の増加により、総コルチゾール、総T3、総T4の上昇がみられることがある。また、これらの遊離型は変化しないとされている。これら検査値の判定に際しては注意すること。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 外国の疫学調査の結果、静脈血栓症のリスクは、経口避妊剤を服用している女性は服用していない女性に比し、3.25〜4.0倍高くなるとの報告がある。
また、静脈血栓症のリスクは経口避妊剤服用開始の最初の1年間において最も高くなるとの報告がある。さらに、外国での大規模市販後調査の結果、初めて経口避妊剤の服用を開始した時だけでなく、4週間以上の中断後に服用を再開した時又は4週間以上の中断後に別の経口避妊剤へ切り替えた時にも静脈血栓症のリスクが上昇し、そのリスクは服用開始後3ヵ月間が特に高いとの報告がある。
また、静脈血栓症のリスクは経口避妊剤服用開始の最初の1年間において最も高くなるとの報告がある。さらに、外国での大規模市販後調査の結果、初めて経口避妊剤の服用を開始した時だけでなく、4週間以上の中断後に服用を再開した時又は4週間以上の中断後に別の経口避妊剤へ切り替えた時にも静脈血栓症のリスクが上昇し、そのリスクは服用開始後3ヵ月間が特に高いとの報告がある。
15.1.2 外国での疫学調査の結果、経口避妊剤の服用により乳癌及び子宮頸癌になる可能性が高くなるとの報告がある。
15.1.3 外国で、経口避妊剤を2年以上服用した場合、良性肝腫瘍が10万人当たり3.4人発生するとの報告がある。また、腫瘍の破裂により腹腔内出血を起こす可能性がある。一方、悪性肝腫瘍(肝癌)の発生率は極めて低く、100万人当たり1人に満たない。
15.1.4 外国で、経口避妊剤の服用により全身性エリテマトーデス(SLE)の悪化、溶血性尿毒症症候群(HUS)があらわれたとの報告がある。
15.1.5 外国で、経口避妊剤の服用による角膜厚の変化等によりコンタクトレンズがうまく調整されないため、視力・視野の変化、装用時の不快感等がみられたとの報告がある。
16. 薬物動態
16.1 血中濃度
健常成人女性6例に淡青色錠(ノルエチステロン(NET)0.5mg、エチニルエストラジオール(EE)0.035mg含有)又は白色錠(NET 1.0mg、EE 0.035mg含有)を経口投与した時の血漿中濃度推移から得られた薬物速度論的パラメータは以下のとおりである1)。
| \ | 淡青色錠 | 白色錠 | ||
| NET | EE | NET | EE | |
| tmax(h) | 1.75±0.69 | 1.17±0.26 | 1.75±0.42 | 1.83±0.61 |
| Cmax | 3.35±0.92 ng/mL | 172±72.7 pg/mL | 10.3±1.96 ng/mL | 168±31.2 pg/mL |
| t1/2(h) | 6.94±1.63 | 10.9±4.09 | 7.28±0.57 | 11.9±3.53 |
16.3 分布
16.4 代謝
NETの代謝はA環の還元(4,5位の飽和反応)、3位の水素化が主代謝経路として確認され、それぞれ3位、5位で4つのisomerが生成するが血漿中、尿中ではさらに抱合を受けた代謝物に変換される。EEの代謝は種によってその程度は異なるが、その主代謝経路は未変化体のグルクロン酸抱合及び硫酸抱合であり、未変化体としての存在はごく微量である3)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
国内において健常成人女性435症例に対し、避妊効果を有効性の指標として本剤を投与した。
有効性評価可能症例387例中の有効率は99.2%(384/387)であり、無効(妊娠)率は0.8%(3/387)であった。
判定症例412例における副作用発現率は、34.0%(140例)であった。その主なものは、不正性器出血(破綻出血、点状出血)、悪心、嘔吐、頭痛、体重増加及び浮腫であった。また、副作用発現率は周期とともに低下し、第1周期21.8%(90/412)、第2周期12.0%(46/383)、第3周期10.3%(38/369)であった5)。
有効性評価可能症例387例中の有効率は99.2%(384/387)であり、無効(妊娠)率は0.8%(3/387)であった。
判定症例412例における副作用発現率は、34.0%(140例)であった。その主なものは、不正性器出血(破綻出血、点状出血)、悪心、嘔吐、頭痛、体重増加及び浮腫であった。また、副作用発現率は周期とともに低下し、第1周期21.8%(90/412)、第2周期12.0%(46/383)、第3周期10.3%(38/369)であった5)。
17.3 その他
各種避妊法使用開始1年間の失敗率(妊娠率)は以下のとおりである6)。[5.参照]
| 方法 | 理想的な使用注1)(%) | 一般的な使用注2)(%) |
| 経口避妊剤 | 0.3 | 9 |
| レボノルゲストレル放出IUS | 0.2 | 0.2 |
| 銅付加IUD | 0.6 | 0.8 |
| コンドーム | 2 | 18 |
| リズム法 | 0.4〜5 | 24 |
| 女性避妊手術 | 0.5 | 0.5 |
| 男性避妊手術 | 0.10 | 0.15 |
| 避妊せず | 85 | 85 |
18. 薬効薬理
18.1 作用機序
本剤は排卵抑制作用を主作用とし、子宮内膜変化による着床阻害作用及び頸管粘液変化による精子通過阻害作用等により避妊効果を発揮する。
18.2 排卵阻害作用
下垂体に作用してゴナドトロピンの分泌を抑制する。ノルエチステロンは主に黄体形成ホルモン(LH)、エチニルエストラジオールは主に卵胞刺激ホルモン(FSH)の分泌を抑え、これらホルモンに依存する卵胞の発育が抑えられ排卵が阻害される7)(ラット)。
18.3 受精卵着床阻害作用
ノルエチステロン及びエチニルエストラジオールは排卵された卵の輸送を速める作用によって子宮内膜の着床準備のタイミングを狂わせ、その結果として受精卵の着床を阻害する7)(ラット)。
18.4 精子通過阻害作用
ノルエチステロンは頸管粘液の粘度上昇等により、精子の進入を阻害する8)(ヒト)。
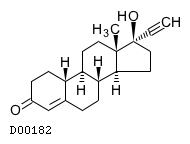
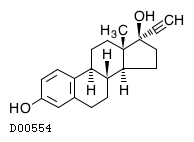
19. 有効成分に関する理化学的知見
19.1. ノルエチステロン
19.2. エチニルエストラジオール
20. 取扱い上の注意
小児の手の届かない場所に保管すること。
22. 包装
280錠[28錠(PTP)×10]
840錠[28錠(PTP)×30]
23. 主要文献
- 水口弘司 他, 臨床医薬, 6 (9), 1763-1786, (1990)
- 小野健司 他, 薬理と治療, 19 (Suppl.4), 309(S-1077)-342(S-1100), (1991)
- 社内資料:女性におけるノルエチステロンとエチニルエストラジオールの吸収・分布・代謝・排泄
- 社内資料:ヒトにおける代謝経路および主代謝物
- 谷澤修 他, 臨床医薬, 6 (10), 2167-2202, (1990)
- Hatcher RA,et al., Contraceptive Technology:Twentieth Revised Edition., 779-861, (2011), (New York:Ardent Media.)
- 原田滋雄 他, 薬理と治療, 19 (Suppl.4), 29(S-797)-40(S-808), (1991)
- 社内資料:経口避妊薬の作用機序
24. 文献請求先及び問い合わせ先
文献請求先
科研製薬株式会社
医薬品情報サービス室
〒113-8650
東京都文京区本駒込二丁目28番8号
電話:フリーダイヤル 0120-519-874
製品情報問い合わせ先
科研製薬株式会社
医薬品情報サービス室
〒113-8650
東京都文京区本駒込二丁目28番8号
電話:フリーダイヤル 0120-519-874
25. 保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
26. 製造販売業者等
26.1 製造販売元
科研製薬株式会社
東京都文京区本駒込二丁目28番8号
その他の説明
23.主要文献
9)安全性に関する参考資料 腫瘍に関する事項
・Collaborative Group on Hormonal Factors in Breast Cancer:Lancet.1996;347:1713-1727
・WHO:Int J Cancer.1993;55:228-236
・Ursin G,et al.:Lancet.1994;344:1390-1394
・Ye Z,et al.:Int J Epidemiol.1995;24:19-26
・Thomas DB,et al.:Am J Epidemiol.1996;144:281-289
・小川重男ら:必修産婦人科学改訂第4版.南江堂.1996;p.390-393,p.395-398
・Edmondson HA,et al.:N Engl J Med.1976;294:470-472
・Neuberger J,et al.:Br Med J.1986;292:1355-1357
・プリンシプル産科婦人科学婦人科編.メジカルビュー社.1987;p.618-623
・乳癌検診(日本対ガン協会編.社会保険出版社.1984)
・乳癌集団検診の手引き(乳癌研究会編.篠原出版.1987)
・乳癌の診断と治療(医薬ジャーナル.1995)
・Becker TM,et al.:Int J Epidemiol.1994;23:913-922
・Parazzini F,et al.:Br J Cancer.1998;77:838-841
・Zondervan KT,et al.:Br J Cancer.1996;73:1291-1297
・永井宣隆:臨婦産.1997;51:429-436
・Chie W-C,et al.:Int J Cancer.1998;77:219-223
・Rooks JB,et al.:JAMA.1979;242:644-648
・Corfman PA:Contraception.1988;37:433-455
・Mays ET,et al.:Semin Liver Dis.1984;4:147-157
・Forman D,et al.:Br Med J.1986;292:1357-1361
・WHO:Int J Cancer.1989;43:254-259
・The Collaborative MILTS(Multi-centre International Liver Tumor Study):Contraception.1997;56:275-284
10)安全性に関する参考資料 心血管系に関する事項
・WHO:Lancet.1995;346:1575-1582
・Spitzer WO,et al.:Br Med J.1996;312:83-88
・WHO:Lancet.1996;348:498-505
・WHO:Lancet.1996;348:505-510
・Petitti DB,et al.:N Engl J Med.1996;335:8-15
・WHO:Lancet.1997;349:1202-1209
・Lewis MA,et al.:Contraception.1997;56:129-140
・WHO Special Program of Research:Br J Obstet Gynecol.1991;98:1117-1128
・Jespersen J,et al.:Am J Obstet Gynecol.1990;163:396-403
・Layde PM,et al.:Lancet.1981;1:541-546
・Stadel BV:N Engl J Med.1981;305:672-677
・風間睦美:Biomedical Perspectives.1997;6:85-89
・Bloemenkamp KWM,et al.:Lancet.1995;346:1593-1596
・丸山征郎:血栓と循環.1996;4:21-23
・野島順三ら:臨床病理.1998;46:1181-1187
・Robinson GE,et al.:Br Med J.1991;302:269-271
・Vessey MP,et al.:Br Med J.1970;3:123-126
・篠木信敏ら:medicina.1996;33:1308-1310
・Gibbs NM:Br J Surg.1957;45:209-236
・Kawasaki T,et al.:Thrombosis Res.1995;79:147-151
・高木繁夫ら:綜合臨床.1985;34:1115-1119
・Jain AK,et al.:Studies in Family Planning.1977;8:50-54
・櫻川信男ら:臨床血栓止血学.医歯薬出版.1994;p.231
・脇坂行一ら:病態血液学.南江堂.1978;p.477
・Farley TMM,et al.:Contraception.1998;57:211-230
・Heinemann LAJ,et al.:Br Med J.1997;315:1502-1504
11)安全性に関する参考資料 次世代への影響に関する事項
・安田佳子ら:医学のあゆみ.1976;98:537-538
・安田佳子ら:医学のあゆみ.1976;99:611-612
・Takasugi N,et al.:J Natl Cancer Inst.1964;33:855-865
・守隆夫:医学のあゆみ.1975;95:599-602
・Huggins GR,et al.:Fertility & Sterility.1990;54:559-573
・Corfman PA:Contraception.1988;37:433-455
・Heinonen OP,et al.:N Engl J Med.1977;296:67-70
・Harlap S,et al.:Obstet Gynecol.1980;55:447-452
・Savolainen E,et al.:Am J Obstet Gynecol.1981;140:521-524
・Ferencz C,et al.:Teratology.1980;21:225-239
・Rothman KJ,et al.:Am J Epidemiol.1979;109:433-439
・常見邦順ら:基礎と臨床.1990;24:4737-4756
・原田滋雄ら:薬理と治療.1991;19(suppl.):965-999
・Kwarta Jr RF,et al.:応用薬理.1991;42:327-340
・影山明彦ら:日獨医報.1991;36:284-299
・先天異常調査20年のあゆみ:日本母性保護医協会.1993
・東京都立病産院における先天異常出産モニタリング調査
・Li DK,et al.:Teratology.1995;51:30-36
・Kim MR,et al.:Am J Obstet Gynecol.1995;172:1042-1043
・石塚直隆:日本内分泌学会雑誌.1962;38:443-449
・Carr DH,et al.:Can Med Assoc J.1970;103:343-348
・Lauritsen JG:Acta Obstet Gynecol Scand.1975;54:261-264
・Dhadial RK,et al.:Lancet.1970;ii:20-21
・Boue J,et al.:Teratology.1975;12:11-26
・松永英:産婦人科治療.1976;32:88-93
・Harlap S,et al.:Teratology.1985;31:381-387
・Depue RH,et al.:J Natl Cancer Inst.1983;71:1151-1155
・Henderson BE,et al.:Int J Cancer.1979;23:598-602
・Brown LM,et al.:Cancer Res.1986;46:4812-4816
・Moss AR,et al.:Am J Epidemiol.1986;124:39-52
12)安全性に関する参考資料 妊娠機能に関する事項
・Woutersz TB:J Reprod Med.1981;26:615-620
・Royal College of General Practitioners:Oral contraceptives and health.Pitman Medical.1974;p.71-77
・Mosher WD,et al.:Fertility & Sterility.1991;56:192-193
・Chasan-Taber L,et al.:Am J Epidemiol.1997;146:258-265
13)安全性に関する参考資料 その他
・厚生省医薬品副作用情報.1977;No.28:33-35
・Fisch IR,et al.:JAMA.1977;237:2499-2503
・Schwartzman JA,et al.:Rev Bras Oto-Rino-Laringol.1975;41:46-50
・Drill VA:Am J Obstet Gynecol.1974;119:165-174
・Orellana-Alcalde JM,et al.:Lancet.1966;2:1278-1280
・Koide SS,et al.:J Reprod Med.1975;15:214-224
・Nilsson S:Contraception.1978;17:131-139
・吉本雅昭ら:ホルモンと臨床.1996;44:597-605
・Chasan-Taber L,et al.:Circulation.1996;94:483-489
・Godsland IF,et al.:J Clin Endocrinol Metab.1992;74:64-70
・二宮涼子ら:臨皮.1994;48:281-283
・降旗謙一ら:最新医学.1980;35:2522-2527
・Harrison's Principles of Internal Medicine.Eighth Edition.1977;p.176,p.1450
・岡田弘二:ステロイド療法のあり方 産婦人科領域.金芳堂.1982;p.171
・Zimmerman AW:Neurol Clin.1986;4:853-861
・Burckhardt P:Hormone Res.1975;6:321-328
・Crook D,et al.:Am J Obstet Gynecol.1988;158:1612-1620
・Frey BM,et al.:Eur J Clin Pharmacol.1984;26:505-511
・Abernethy DR,et al.:Clin Pharmacol Ther.1984;35:792-797
・セレギリン塩酸塩電子添文
・シクロスポリン電子添文
・Reimers D,et al.:Prax Pneumol.1971;25:255-262
・Back DJ,et al.:Contraception.1980;21:135-143
・Back DJ,et al.:Br J Pharmacol.1980;69:441-452
・Back DJ,et al.:Br J Clin Pharmacol.1988;25:527-532
・Crawford P,et al.:Br J Clin Pharmacol.1990;30:892-896
・Back DJ,et al.:J Steroid Biochem.1982;16:407-413
・テルビナフィン塩酸塩電子添文
・ブセレリン酢酸塩電子添文
・Steele JM:J Fam Plan Doctors.1978;3:77-78
・Ouellet D,et al.:Br J Clin Pharmacol.1998;46:111-116
・ネビラピン電子添文
・檜垣祐子:今日の治療指針.医学書院.1999;p.713
・Van Vange N,et al.:Contraception.1990;41:345-352
・野口實:日産婦誌.1988;40:14-20
・Schatz DL,et al.:Can Med Assoc J.1968;99:882-886
・今釜秀一ら:臨床眼科.1987;41:751-753
・Beral V,et al.:Br Med J.1999;318:96-100
・Mostad SB,et al.:Lancet.1997;350:922-927
・Royal College of General Practitioners:Oral contraceptives and health.Pitman Medical.1974;p.22-30
・Bray RS:Contraception.1976;13:417-425
・Keller AJ,et al.:Obstet Gynecol.1977;49:83-91
・Gerretsen G,et al.:Contraception.1980;22:25-29
・Baker DA,et al.:Contraception.1985;32:377-382
・Bisset LR,et al.:Contraception.1988;38:573-578
・Baker DA,et al.:Contraception.1989;39:119-124
・Scanlan JM,et al.:Psychoneuroendocrinology.1995;20:281-287
14)有効性に関する参考資料 避妊効果に関する事項
・Hatcher RA,et al.:Contraceptive Technology:Twentieth Revised Edition.New York:Ardent Media.2011;p.779-861
・Morris SE,et al.:Contraception.1979;20:61-69
・Chowdhury V,et al.:Contraception.1980;22:241-247
・Sparrow MJ:NZ Med J.1987;100:102-105
15)有効性に関する参考資料 人工妊娠中絶に関する資料
・平成9年母体保護統計報告(厚生省大臣官房統計情報部人口動態統計課)
・毎日新聞人口問題調査会(第23回全国家族計画世論調査報告書より改編)
・Determinants of contraceptive use
・United Nations:Demographic Yearbook 1996版 1998
16)有効性に関する参考資料 副効用に関する資料
・The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development:N Engl J Med.1987;316:650-655
・Narod SA,et al.:N Engl J Med.1998;339:424-428
・The Centers for Disease Control Cancer and Steroid Hormone Study:JAMA.1983;249:1596-1599
・The Cancer and Steroid Hormone Study of the Centers for Disease Control and the National Institute of Child Health and Human Development:JAMA.1987;257:796-800
・Schlesselman JJ:Human Reproduction.1997;12:1851-1863
・Royal College of General Practitioners:Oral contraceptives and health.Pitman Medical.1974;p.22,p.61
・Connel EB,et al.:J Reprod Med.1984;29:513-523
・Lanes SF,et al.:Am J Obstet Gynecol.1992;166:956-961
・Vessey M,et al.:J Biosoc Sci.1976;8:373-427
・Westrom L:Am J Obstet Gynecol.1980;138:880-892
・Rubin GL,et al.:Am J Obstet Gynecol.1982;144:630-635
・Brinton LA,et al.:Am J Epidemiol.1981;113:203-214