医薬品情報
| 総称名 | ジアグノグリーン |
|---|---|
| 一般名 | インドシアニングリーン |
| 欧文一般名 | Indocianine Green |
| 製剤名 | インドシアニングリーン注 |
| 薬効分類名 | 肝・循環機能検査用薬 蛍光血管造影剤 センチネルリンパ節同定用薬 |
| 薬効分類番号 | 7222 7224 7290 |
| ATCコード | V04CX01 |
| KEGG DRUG |
D01342
インドシアニングリーン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年9月 改訂(効能変更、用法及び用量変更)(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ジアグノグリーン注射用25mg | DIAGNOGREEN FOR INJECTION | 第一三共 | 7224400A1034 | 801円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 ヨード過敏症の既往歴のある患者[本剤はヨウ素を含有しているため、ヨード過敏症を起こすおそれがある。]
4. 効能または効果
○肝機能検査(血漿消失率、血中停滞率及び肝血流量測定)
肝疾患の診断、予後治癒の判定
○循環機能検査(心拍出量、平均循環時間又は異常血流量の測定)
心臓血管系疾患の診断
○血管及び組織の血流評価
○次の疾患におけるセンチネルリンパ節の同定
乳癌、悪性黒色腫
○肝外胆管の描出
5. 効能または効果に関連する注意
<センチネルリンパ節の同定>
本剤を用いたセンチネルリンパ節生検は、本検査法に十分な知識と経験を有する医師のもとで、実施が適切と判断される症例において実施すること。なお、症例の選択にあたっては、最新の関連ガイドライン等を参照し、適応となる腫瘍径や部位等について十分な検討を行うこと。
6. 用法及び用量
| 効能又は効果 | 用法及び用量 |
| 肝機能検査 | <血漿消失率測定及び血中停滞率測定の場合> インドシアニングリーンとして体重1kg当たり0.5mgに相当する量を注射用水で5mg/mL程度に希釈し、肘静脈より30秒以内に症状に注意しながら徐々に静脈内投与する。 <肝血流量測定の場合> インドシアニングリーンとして25mgをできるだけ少量の注射用水に溶かした後、生理食塩液で2.5〜5mg/mLの濃度に希釈し、インドシアニングリーンとして3mgに相当する上記溶液を静脈内投与する。その後引き続き0.27〜0.49mg/分の割合で約50分間採血が終るまで一定速度で点滴静脈内投与する。 |
| 循環機能検査 | 目的に応じて心腔内より末梢静脈に至る種々の血管部位にインドシアニングリーンの溶液を注入するが通常前腕静脈から行う。成人1人当たり1回量はインドシアニングリーン5〜10mg、すなわち1〜2mL程度で、小児は体重に応じて減量する。 |
| 血管及び組織の血流評価 | インドシアニングリーンとして25mgを5〜10mLの注射用水で溶解し、使用目的に応じて、通常0.04〜0.3mg/kgを静脈内投与する。なお、脳神経外科手術時における脳血管の造影の場合には、インドシアニングリーンとして25mgを5mLの注射用水で溶解し、通常0.1〜0.3mg/kgを静脈内投与する。 |
| センチネルリンパ節の同定 | 乳癌のセンチネルリンパ節の同定においては、インドシアニングリーンとして25mgを5mLの注射用水で溶解し、通常5mL以下を悪性腫瘍近傍又は乳輪部の皮下に適宜分割して投与する。悪性黒色腫のセンチネルリンパ節の同定においては、インドシアニングリーンとして25mgを5mLの注射用水で溶解し、通常1mLを悪性腫瘍近傍の皮内数箇所に適宜分割して投与する。 |
| 肝外胆管の描出 | インドシアニングリーンとして25mgを10mLの注射用水で溶解し、通常1mLを静脈内投与する。 |
7. 用法及び用量に関連する注意
<効能共通>
7.1 「18.1測定法」の項を参照すること。
7.2 網脈絡膜血管の造影には、用法及び用量が承認されている他の製剤を用いること。
<血管及び組織の血流評価、肝外胆管の描出>
7.3 インドシアニングリーンは赤外光(最大吸収波長は約805nm付近)で励起され蛍光(最大蛍光波長は約835nm付近)を発するので、適切な方法で観察すること。
<センチネルリンパ節の同定>
7.4 可能な限り本剤とラジオアイソトープ法を併用することが望ましい。その際には、併用する薬剤の電子添文を参照した上で使用すること。
8. 重要な基本的注意
<効能共通>
<センチネルリンパ節の同定>
8.2 既存の情報を踏まえ、患者又はその家族に対し本検査の必要性及び限界等を十分に説明し同意を得た上で実施すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、診断上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
診断上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)
11.2 その他の副作用
| 0.1%未満 | 頻度不明 | |
| 過敏症 | 悪心、嘔吐、蕁麻疹、発熱 | 発疹 |
12. 臨床検査結果に及ぼす影響
甲状腺放射性ヨード摂取率検査に影響を及ぼすことがあるので、必要な場合には1週間以上の間隔をおくこと。
14. 適用上の注意
14.1 薬剤調製時の注意
<効能共通>
14.1.1 注入液は、用時調製し、溶解した液は保存しないこと。
14.1.2 必ず添付の溶解液で完全に溶解し、その他の溶解液(生理食塩液等)は使用しないこと。[8.1.2参照]
14.1.3 溶解時バイアルを数回転倒し、軽く振とうしてゴム栓内側付着の薬剤も完全に溶解後、バイアルを横にして水平回転し、壁面を観察し、不溶の薬剤が残っていないことを確認すること。なお、ゴム栓、キャップ付着分の薬剤溶解にも留意すること。[8.1.2参照]
<循環機能検査>
14.1.4 本剤25mgを正確に5mLの注射用水で溶解すること。その他に生理食塩液を用意すること。
14.2 薬剤投与時の注意
<効能共通>
14.2.1 静脈内投与により血管痛があらわれることがある。
<循環機能検査>
14.2.2 注入に際しては、本剤を速やかに注入し1回の注入容積は2mL以内とすること。
(1)心腔内注入の場合は、通常あらかじめカテーテル内を本剤の溶液で満たしておき、後から5〜10mLの生理食塩液で押し出すように注入すること。
(2)末梢静脈注入の場合は、なるべく太い静脈を選び、本剤注入後、直ちに生理食塩液等の液体をやや多く注入し中心血流まで押し出すこと。肘静脈より注入するには上膊を10〜20秒間緊縛しておき、注入1〜2秒前に、それを急にゆるめてから色素を注入すると停滞することなく、中心血流に合流することができる。また、股静脈は太い注射針の挿入に困難を生じることなく、小児でも容易に投与できる。この部位では血流が多いため、本剤注入直後の生理食塩液の押し出しを必ずしも必要としない。
14.3 診断上の注意
次の場合、測定値に誤差を生じることがある。
14.3.1 患者の体の状態による影響
(1)乳び血清あるいは極度に混濁又は溶血血清の場合
(2)浮腫患者、痩躯又は肥満患者、多量失血患者等。このような場合は血漿消失率で測定すること。
14.3.2 薬剤との併用による影響
胆嚢造影剤(イオトロクス酸メグルミン等)、利胆薬、リファンピシン又は抗痛風薬との併用により、本剤の肝細胞への取り込みが阻害されることがある。
14.3.3 薬剤以外の物質による影響
食物による影響により肝血流量が増加する。また、食物中の脂肪摂取により脂質増加をもたらし、血清が白濁する。
16. 薬物動態
16.1 血中濃度
16.3 分布
16.3.1 マウスにおける組織分布
35S-インドシアニングリーンを用いたマウス凍結全身オートラジオグラフィーでは、本剤の静脈内投与1分後及び5分後には全身血管系、特に肺、心、腎、肝に一様に分布した。15分後には肝内濃度がほぼ最高に達し、胆嚢への排泄、腸管への分布が認められた。また30分後には胃、60分後には腸管内分布が多くなり、24時間後には肝、腸管内に僅かに認められた3)。
16.3.2 血清蛋白結合率
健康成人の血清中インドシアニングリーンは80%がグロブリン分画に結合していることが認められている。
グロブリン分画のうち、本剤と主に結合しているのはα1リポプロテインであると考えられ、この結合はアルブミンと色素との結合より親和性が強いといわれている4)。
グロブリン分画のうち、本剤と主に結合しているのはα1リポプロテインであると考えられ、この結合はアルブミンと色素との結合より親和性が強いといわれている4)。
16.4 代謝
16.5 排泄
17. 臨床成績
17.3 その他
17.3.1 肝機能検査
インドシアニングリーンによる肝機能検査は、肝疾患の診断をはじめ重症度判定、治癒・予後の判定等内科的診断のほかに、外科領域においても手術適応や術式の決定、切除範囲の決定、術後の経過予測等手術の患者管理面で肝機能予備力を定量的に反映する検査法である。
本検査を実施した2,105例のアンケート調査結果から、肝疾患で5年以内に死亡した群と、5年以上生存した群とでは本検査値に有意差が認められることが報告されている7)。
本検査を実施した2,105例のアンケート調査結果から、肝疾患で5年以内に死亡した群と、5年以上生存した群とでは本検査値に有意差が認められることが報告されている7)。
17.3.2 循環機能検査
本剤による循環機能検査領域の臨床試験報告症例2,901例(短絡835例、心拍出量750例、循環機能357例等)について、疾患の診断と病態の判定に有効であることが認められている。
18. 薬効薬理
18.1 測定法
<肝機能検査>
18.1.1 血漿消失率測定法
18.1.2 血中停滞率測定法
18.1.3 肝血流量測定法
インドシアニングリーンは血中から肝臓によってのみ摂取され、胆汁排泄が高率であって、他の組織での除去は無視できる。また、インドシアニングリーンは腸肝循環がないという特徴を持ち、肝血流量測定に好適である。
インドシアニングリーンを一定速度で点滴静注後、肝カテーテルから肝静脈血、同時に動脈から動脈血を採血して、各々の血漿中インドシアニングリーン濃度を求め、肝血流量を測定する。
インドシアニングリーンを一定速度で点滴静注後、肝カテーテルから肝静脈血、同時に動脈から動脈血を採血して、各々の血漿中インドシアニングリーン濃度を求め、肝血流量を測定する。
<循環機能検査>
18.1.4 インドシアニングリーンを血流中に注入し、血流の他の部位でインドシアニングリーンの濃度変化を連続的に記録すると指示薬希釈曲線が得られる。
これを解析することにより心拍出量、短絡の有無や短絡量等から疾患の有無、その種類及び程度を知ることができる11)。
これを解析することにより心拍出量、短絡の有無や短絡量等から疾患の有無、その種類及び程度を知ることができる11)。
<血管及び組織の血流評価、肝外胆管の描出>
18.2 作用機序
インドシアニングリーンは、血清蛋白(リポ蛋白、アルブミン等)と結合し、血中から選択的に肝に取り込まれ、腸肝循環や腎からの排泄もなく、肝より胆汁中に排泄されることが確かめられており、血中停滞率、血漿消失率あるいは肝血流量の測定による肝機能検査及び指示薬希釈法による循環機能検査に適している。
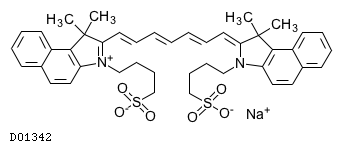
19. 有効成分に関する理化学的知見
19.1. インドシアニングリーン
| 一般的名称 | インドシアニングリーン |
|---|---|
| 一般的名称(欧名) | Indocianine Green |
| 略号 | ICG |
| 化学名 | 2-[7-[1,1-dimethyl-3-(4-sulfobutyl)benz[e]indolin-2-ylidene]-1,3,5-heptatrienyl]-1,1-dimethyl-3-(4-sulfobutyl)-1H-benz[e]indolium hydroxide,inner salt,sodium salt |
| 分子式 | C43H47N2NaO6S2 |
| 分子量 | 774.96 |
| 融点 | 約230℃(分解) |
| 物理化学的性状 | 暗緑青色の粉末で、においはない。水又はメタノールにやや溶けやすく、アセトンにほとんど溶けない。 |
| 理化学知見その他 | 血清蛋白と急速に結合し光化学的に安定化され、最大吸収波長は水溶液の785nmから直ちに805nmに移行する。この805nmは血中酸化型ヘモグロビン、還元型ヘモグロビンの吸収曲線が交叉する等吸光点(isosbestic point)にあるため、この波長で測定する限り、血中のO2飽和度の影響を受けない16)。 |
| KEGG DRUG |
|
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
10バイアル
(溶解液:日本薬局方注射用水10mL 10アンプル添付)
23. 主要文献
- 上田英雄ほか, 日本医事新報, No.2015, 7-12, (1962)
- Cherrick GR,et al., J Clin Invest., 39 (4), 592-600, (1960) »PubMed »DOI
- 大屋敬彦ほか, 肝臓, 15 (2), 135, (1974) »DOI
- Barker KJ, Proc Soc Exp Biol Med., 122 (4), 957-963, (1966) »PubMed »DOI
- 浪久利彦ほか, 肝臓, 5 (2), 114-120, (1963) »DOI
- Caesar J,et al., Clin Sci., 21, 43-57, (1961) »PubMed
- 南部勝司ほか, 日本消化器病学会雑誌, 75 (2), 198-204, (1978) »DOI
- 市田文弘ほか, 総合臨床, 17 (11), 2071-2082, (1968)
- 浪久利彦ほか, 日本臨床, 38 (春季増刊), 701-715, (1980)
- 前田耕治ほか, 臨床検査, 9 (11), 1008-1010, (1965)
- 中村 隆ほか, 内科, 14 (7), 1361-1366, (1964)
- Raabe A,et al., Neurosurgery, 52 (1), 132-139, (2003) »PubMed
- Raabe A,et al., Zentralbl Neurochir., 66 (1), 1-6, (2005) »PubMed
- 三輪光春, 外科, 71 (9), 913-917, (2009)
- Weiler M,et al., J Biomed Opt., 17 (6), 066019, (2012) »PubMed
- Fox IJ,et al., Proc Staff Meeting Mayo Clin., 35 (25), 732-744, (1960) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
製品情報問い合わせ先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
26. 製造販売業者等
26.1 製造販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1
