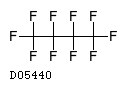医薬品情報
| 総称名 | ソナゾイド |
|---|---|
| 一般名 | ペルフルブタン |
| 欧文一般名 | Perflubutane |
| 製剤名 | 注射用ペルフルブタン |
| 薬効分類名 | 超音波診断用造影剤 |
| 薬効分類番号 | 7290 |
| KEGG DRUG |
D05440
ペルフルブタン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年9月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ソナゾイド注射用16μL | GEヘルスケアファーマ | 7290414D1038 | 8023円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
超音波検査における下記造影
肝腫瘤性病変、乳房腫瘤性病変
6. 用法及び用量
ペルフルブタンマイクロバブルとして16μL(1バイアル)を添付の注射用水2mLで懸濁し、通常、成人1回、懸濁液として0.015mL/kgを静脈内投与する。
参考
| 体重(kg) | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| 投与量 | 懸濁液として(mL) | 0.60 | 0.75 | 0.90 | 1.05 | 1.20 | 1.35 | 1.50 |
| ペルフルブタンマイクロバブルとして(μLMB注)) | 4.8 | 6.0 | 7.2 | 8.4 | 9.6 | 10.8 | 12.0 | |
7. 用法及び用量に関連する注意
7.1 通常、成人1日1回投与する。反復投与による使用経験がない。
7.2 撮影方法としてはハーモニック法を用いる。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 卵又は卵製品にアレルギーのある患者
診断上やむを得ないと判断される場合を除き、投与しないこと。本剤は鶏卵由来の安定剤(水素添加卵黄ホスファチジルセリンナトリウム)を用いているため、アレルギー症状を発現するおそれがある。
9.1.2 心臓や肺に動静脈(右左)シャントのある患者
本剤が肺を経由せず、直接体循環に入るため。
9.1.3 重篤な心疾患のある患者
症状が悪化するおそれがある。[11.1.2参照]
9.1.4 重篤な肺疾患のある患者
本剤の主たる排泄経路は肺であり、呼吸機能低下患者では症状が悪化するおそれがある。[15.2.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には診断上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
診断上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を十分に観察しながら慎重に投与すること。一般に生理機能が低下している。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
呼吸困難、血圧低下、発疹等の異常が認められた場合には、適切な処置を行うこと。
11.1.2 心筋虚血あるいは心筋梗塞を伴う徐脈、低血圧(いずれも頻度不明)
冠動脈疾患を有し、過敏症を示唆する有害事象が発現した患者において、心筋虚血あるいは心筋梗塞を伴う徐脈、低血圧が認められたとの報告がある。[9.1.3参照]
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹、発赤、そう痒 | 潮紅 |
| 精神神経系 | 頭痛 | |
| 消化器 | 下痢、口渇、嘔吐、腹痛 | |
| 臨床検査 | 蛋白尿、好中球減少、LDH上昇、尿糖陽性、血圧上昇、リンパ球減少、血小板数減少 | |
| その他 | 注射部疼痛、熱感、下肢冷感 | 味覚不全 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 調製方法
懸濁液は、調製後2時間以内に使用する。
(1)空シリンジに、添付の注射用水から2mLをとる。
(2)本剤(凍結乾燥注射剤)に添付のケモプロテクトスパイクを挿入する。
(3)注射用水2mLをとったシリンジをケモプロテクトスパイクに取り付け、注射用水2mLをバイアルに入れ、シリンジを付けたまま、直ちに1分間振とうする。
(4)ケモプロテクトスパイクの内部にあるデッドスペースには注射用水が残っているため、一度シリンジ内へ懸濁液を吸い取り、再度バイアル中に戻す。
(5)懸濁液採取用の空シリンジをケモプロテクトスパイクに取り付け、投与に必要な量の懸濁液をシリンジにとる。
14.1.2 バイアルへの注射用水の注入及び懸濁液調製後の本剤のシリンジへの吸引には、必ず添付のケモプロテクトスパイク(懸濁液調製器具)を使用すること。また、本剤のシリンジへの吸引及び本剤をバイアルへ戻す際には過度の減圧/加圧を避けるようゆっくりと行うこと。なお、添付の注射用水以外の溶解液を使用した場合、凝集体を形成することもある。詳細に関しては、「本剤の調製方法および取扱い方法」を参照すること。
14.2 薬剤投与時の注意
14.2.1 検査前
本剤による超音波検査と同日の腹腔鏡検査や発泡剤を使用したバリウム検査などの消化管検査は避けること。[15.2.2参照]
14.2.2 投与経路
本剤は静脈内投与にのみ使用し、動脈内投与は行わないこと。
14.2.3 投与時
(1)懸濁液調製後の本剤は室温で2時間以内に使用すること。
(2)22Gより太い注射針(22Gを含む)を用いること。
(3)懸濁液放置時に懸濁液に分離が認められることがあるので、投与直前に再度振とうし、均質な懸濁液とすること。
(4)通常、生理食塩液で満たした投与ルートを確保し、本剤投与後直ちに、少量の生理食塩液でフラッシュする。
14.3 薬剤開封後の注意
1回の検査にのみ使用し、使用後の残液、ケモプロテクトスパイクは廃棄すること。
14.4 診断上の注意
14.4.1 超音波撮影時
<肝腫瘤性病変>
(1)本剤の造影効果は、投与直後から得られる血管イメージングと投与後約10分から得られるクッパーイメージング(肝実質の造影)である。十分なクッパーイメージングを得るためには、血管イメージングを終えた後、撮影を中断しバブルの崩壊を防ぐ必要がある。肝腫瘤性病変の中にはクッパー細胞を有することにより、本剤投与後のクッパーイメージングにおいて病巣が不明瞭になる場合があるので、造影前超音波画像を参考に診断すること。
<乳房腫瘤性病変>
(2)本剤の造影効果は、投与直後から得られる血管イメージングである。血管イメージングは関心病変を描出した状態でプローブを固定し撮影すること。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
健康成人に本剤0.024μLMB/kg、0.12μLMB/kg(臨床用量)、0.60μLMB/kg(懸濁液として0.003mL/kg、0.015mL/kg、0.075mL/kg)を静脈内単回投与したときのペルフルブタン血中濃度は投与後急速に減衰した。臨床用量の0.12μLMB/kgでは2相性に減衰し、投与後2〜15分の半減期は2.7分、投与後15〜30分の半減期は7.3分となり、また投与後60分で検出限界以下であった。
静脈内単回投与時のペルフルブタン血中濃度の推移(本剤の血中濃度:血液重量1g当たりの濃度として算出)
| 投与量 | Cmax(ng/g)注1) | AUC0〜∞(ng・min/g)注2) | Tmax(min) | t1/2(min) | Vd(kg/kg)注3) | CLt(g/min/kg)注4) | |
| α(2〜15min) | β(15〜30min) | ||||||
| 0.024μLMB/kg (懸濁液として0.003mL/kg) | 1.41±0.51 | 9.20±2.83 | 2.50±1.22 | 2.52±0.69注5) | −注6) | 0.12±0.09 | 28±10 |
| 0.12μLMB/kg (懸濁液として0.015mL/kg) | 9.52±4.38 | 66.78±32.27 | 2.00±0.00 | 2.72±0.47 | 7.25±0.36 | 0.07±0.02 | 20±6 |
| 0.60μLMB/kg (懸濁液として0.075mL/kg) | 46.38±19.23 | 353.00±150.49 | 2.00±0.00 | 2.80±0.73 | 26.22±17.25注7) | 0.19±0.14 | 19±8 |
16.3 分布
16.4 代謝
ラットの呼気排泄試験で、投与されたペルフルブタンが未変化体のまま呼気中にほぼ全量(96.4%)回収されたことから、ペルフルブタンは生体内で代謝を受け難いことが確認された3)。
16.5 排泄
投与されたペルフルブタンの排泄経路は呼気である。健康成人に本剤0.024μLMB/kg、0.12μLMB/kg(臨床用量)、0.60μLMB/kg(懸濁液として0.003mL/kg、0.015mL/kg、0.075mL/kg)を静脈内単回投与したときのペルフルブタン呼気中濃度を測定した。各測定時点での呼気中ペルフルブタン濃度は用量依存的であった。臨床用量の0.12μLMB/kgでは、投与後6分でCmaxに達し、投与後2時間には検出限界以下となった。なお、0.024μLMB/kgにおける呼気中濃度は全被験者で検出限界以下であった。
静脈内単回投与時のペルフルブタン呼気中濃度の推移
17. 臨床成績
17.1 有効性及び安全性に関する試験
<肝腫瘤性病変>
17.1.1 国内第II相試験
第II相臨床試験の用量比較試験において血管イメージング(投与後1分まで)ならびにクッパーイメージング(投与後10分以降)の両イメージングに最適な用量として0.12μLMB/kg(懸濁液として0.015mL/kg)が選定された。血管イメージングの有効率注1)は87.3%(48/55例)、クッパーイメージングの有効率注2)は75.9%(41/54例)であった。副作用発現頻度は1.8%(1/57例)であり、発現した副作用は下痢及び注射部位疼痛の2件であった。
17.1.2 国内第III相試験
第III相臨床試験では、血管イメージングにおける造影超音波検査の正診率注3)88.9%(169/190例)は、造影前超音波検査の正診率68.4%(130/190例)よりも統計学的に有意に高く(McNemar検定、P<0.001)、鑑別診断能の向上が検証された。
一方、クッパーイメージングでは、造影前と造影後による超音波検査から検出された病変数と確定病変数との差をとった。確定病変数よりも増加していた場合を2、同数であった場合を1、減少していた場合を0と分類・スコア化した。また、造影前の超音波画像のみによる評価も同様にスコア化した。造影前と比較して、造影前と造影後を併せた場合、スコア増加の割合は30.9%、スコア減少の割合は7.3%であり(スコアの分布についてWilcoxonの符号付順位検定、P<0.001)、本剤による造影超音波検査では病変検出能が向上することが検証された。副作用発現頻度は10.4%(20/193例)であった。主な副作用は下痢及び蛋白尿が各1.6%(3/193例)、好中球減少が1.0%(2/193例)であった。
一方、クッパーイメージングでは、造影前と造影後による超音波検査から検出された病変数と確定病変数との差をとった。確定病変数よりも増加していた場合を2、同数であった場合を1、減少していた場合を0と分類・スコア化した。また、造影前の超音波画像のみによる評価も同様にスコア化した。造影前と比較して、造影前と造影後を併せた場合、スコア増加の割合は30.9%、スコア減少の割合は7.3%であり(スコアの分布についてWilcoxonの符号付順位検定、P<0.001)、本剤による造影超音波検査では病変検出能が向上することが検証された。副作用発現頻度は10.4%(20/193例)であった。主な副作用は下痢及び蛋白尿が各1.6%(3/193例)、好中球減少が1.0%(2/193例)であった。
注1)「診断の妨げとなる造影剤によるアーチファクトをほとんど示さず、関心病変ならびにその周辺の血管の造影が十分得られた」と判定された割合
注2)「診断の妨げとなる造影剤によるアーチファクトをほとんど示すことなく、均一で肝全体を診断できる持続的な造影が得られた」と判定された割合
注3)standard of truthを最終診断名(画像診断及び病理検査などにより医療機関の医師が総合的に確定)と設定し、造影超音波検査による診断名と一致した割合
<乳房腫瘤性病変>
17.1.3 国内第II相試験
第II相臨床試験の用量比較試験において造影効果の最適な用量として、0.12μLMB/kg(懸濁液として0.015mL/kg)が選定され、血管イメージングの造影効果の有効率注4)は95.7%(22/23例)であった。副作用発現頻度は3.6%(1/28例)で、発現した副作用は注射部位疼痛であった。
17.1.4 国内第III相試験
第III相臨床試験では、造影超音波検査の正診率注5)87.2%(306/351注6)例)は、造影前超音波検査の正診率65.5%(230/351注6)例)よりも統計学的に有意に高く(一般化推定方程式による検定、P<0.001)、鑑別診断能の向上が検証された。そのときの造影超音波検査の感度は91.4%(96/105注6)例)、特異度は85.4%(210/246注6)例)であった。副作用発現頻度は3.3%(4/123例)で、発現した副作用は、下痢が1.6%(2/123例)、腹痛、嘔吐、関節痛が各0.8%(1/123例)であった。
注4)「診断の妨げとなる造影剤によるアーチファクトをほとんど示さず、関心病変ならびにその周辺の血管の造影が十分得られた」と判定された割合
注5)standard of truthを病理検査(細胞診又は組織診)と設定し、造影超音波検査の鑑別診断(良悪性の診断)と一致した割合
注6)有効性解析対象症例117例(悪性35例、良性82例)に対して3名の画像判定者が判定したため、のべ351例分(悪性105例分、良性246例分)の判定を統計解析に用いた。
18. 薬効薬理
18.1 測定法
19. 有効成分に関する理化学的知見
19.1. ペルフルブタン
22. 包装
ソナゾイド注射用16μL 1バイアル
(溶解液:日本薬局方注射用水2mL 1アンプル添付)
(懸濁液調製器具:ケモプロテクトスパイク 1個添付)
23. 主要文献
- Toft KG,et al., Ultrasound Med Biol., 32 (1), 107-114, (2006) »PubMed »DOI
- Kindberg GM,et al., Cell Tissue Res., 312 (1), 49-54, (2003) »PubMed »DOI
- Uran S,et al., J Pharm Biomed Anal., 39 (3-4), 746-751, (2005) »PubMed »DOI
- Watanabe R,et al., Biol Pharm Bull., 28 (6), 972-977, (2005) »PubMed »DOI
- Watanabe R,et al., Invest Radiol., 42 (9), 643-651, (2007) »PubMed »DOI
24. 文献請求先及び問い合わせ先
文献請求先
GEヘルスケアファーマ株式会社
メディカルインフォメーションセンター
〒108-0074
東京都港区高輪4-10-18
電話:0120-241-454
製品情報問い合わせ先
GEヘルスケアファーマ株式会社
メディカルインフォメーションセンター
〒108-0074
東京都港区高輪4-10-18
電話:0120-241-454
26. 製造販売業者等
26.1 製造販売元
GEヘルスケアファーマ株式会社
東京都港区高輪4-10-18