医薬品情報
| 総称名 | テリパラチド酢酸塩 |
|---|---|
| 一般名 | テリパラチド酢酸塩 |
| 欧文一般名 | Teriparatide Acetate |
| 製剤名 | 注射用テリパラチド酢酸塩 |
| 薬効分類名 | 副甲状腺機能診断薬 |
| 薬効分類番号 | 7223 |
| ATCコード | H05AA02 |
| KEGG DRUG |
D03358
テリパラチド酢酸塩
|
| KEGG DGROUP |
DG00512
テリパラチド
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年1月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| テリパラチド酢酸塩静注用100「旭化成」 | Teriparatide Acetate Injection | 旭化成ファーマ | 7223403D1045 | 18427円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
Ellsworth-Howard試験
6. 用法及び用量
1回100テリパラチド酢酸塩単位を用時、日局生理食塩液3mLに溶解し、静脈内に注射する。
なお、体表面積が1m2未満の小児の場合には、100テリパラチド酢酸塩単位/m2投与する。
なお、体表面積が1m2未満の小児の場合には、100テリパラチド酢酸塩単位/m2投与する。
8. 重要な基本的注意
本剤はポリペプチド製剤でありショック症状を起こす可能性があるので、アレルギー既往歴、薬物過敏症等について十分な問診を行い、投与後は患者の状態を十分観察すること。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心疾患のある患者
心疾患を悪化させるおそれがある。
9.1.2 気管支喘息、発疹(紅斑、膨疹等)等の過敏症状を起こしやすい体質の患者
9.2 腎機能障害患者
9.2.1 腎疾患のある患者
腎疾患を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。ウサギを用いた静脈内投与による器官形成期投与試験において、胎児毒性(胎児死亡)が認められている。[2.3参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)[8.参照]
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | 蕁麻疹 | |
| 循環器 | 顔面潮紅、熱感、動悸、頻脈、不整脈、胸痛、血圧降下、血圧上昇 | 顔色不良 | |
| 消化器 | 悪心、嘔吐、下痢 | 口渇 | |
| 神経系 | しびれ感、腰痛、頭痛、めまい | 筋痙攣、意識喪失 | テタニー、硬直 |
| 肝臓 | AST・ALTの上昇 | ||
| その他 | 脱力感、不快感 | そう痒、全身倦怠感、あくび | 悪寒、咽頭痛 |
注)発現頻度は使用成績調査を含む
14. 適用上の注意
14.1 薬剤調製時の注意
溶解後は速やかに使用すること。
14.2 薬剤投与時の注意
3分以上かけてゆっくり注射すること。
15. その他の注意
15.2 非臨床試験に基づく情報
ラットに2年間皮下投与したがん原性試験において、骨肉腫がみられたとの報告がある。
16. 薬物動態
16.1 血中濃度
本剤20μg(67単位)を特発性及び術後性副甲状腺機能低下症の患者17例に静脈内投与した場合、投与後5分で2.63ng/mLの平均血中濃度を示し、血中半減期は3分と28分の二相性を示した2)。
16.3 分布
16.3.1 組織内分布
125I-テリパラチド酢酸塩をラットに静脈内投与した直後の放射能は、腎臓、肺、肝臓の順に高濃度に分布した3)。
16.4 代謝
ヒト血清、ラット腎臓及びラット肝臓抽出液中で経時的に生物活性を失い、ヒト血清中で、37℃,9時間反応させた際には80%の活性を消失した。また、ラット腎臓抽出液中では主にカルボキシペプチダーゼA、トリプシン及びアミノペプチダーゼで加水分解された4)(in vitro)。
16.5 排泄
125I-テリパラチド酢酸塩をラットに静脈内投与した場合、投与後48時間までに尿中に81%、糞中に4.5%の放射能が排泄された5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 測定法
腎細胞膜レセプターと結合して、アデニルサイクラーゼを活性化することにより、cyclic AMPの産生を介し、ホルモン作用を発現すると考えられている。
18.2 血清カルシウム及び血清リンに対する作用
テリパラチド酢酸塩は甲状腺・副甲状腺摘除ラットの血清カルシウム値を上昇させ、血清リン値を低下させた9)。
18.3 腎に対する作用
術後性副甲状腺機能低下症病態モデルラットに、テリパラチド酢酸塩を投与すると尿中リン酸及び尿中cyclic AMP排泄量は著しく増加した10)。
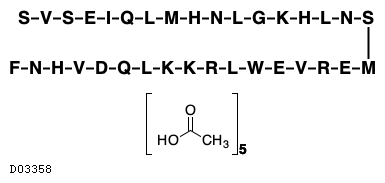
19. 有効成分に関する理化学的知見
19.1. テリパラチド酢酸塩
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
1バイアル
23. 主要文献
- 尾形悦郎他, 日本内分泌学会雑誌, 60 (8), 971-984, (1984) »DOI
- Konagaya Y.et al., Jap.J.Med., 23 (3), 199-204, (1984)
- 山口正義他, 医薬品研究, 15 (6), 1003-1010, (1984)
- Fujita T.et al., 日本骨代謝学会雑誌, 2 (2), 142-153, (1984) »DOI
- 社内資料:薬物動態(排泄)
- 山本通子他, ホルモンと臨床, 31 (8), 765-776, (1983) »PubMed
- 深見隆則他, 日本内分泌学会雑誌, 60 (3), 159-170, (1984) »DOI
- 安田敏行他, ホルモンと臨床, 32 (7), 639-648, (1984)
- 社内資料:薬効薬理(血清カルシウム及び血清リンに対する作用)
- 山本通子他, 厚生省特定疾患ホルモン受容機構異常調査研究班,昭和57年度総括研究事業報告書, 160-165
24. 文献請求先及び問い合わせ先
文献請求先
旭化成ファーマ株式会社
医薬情報部くすり相談窓口
〒100-0006
東京都千代田区有楽町一丁目1番2号
電話:フリーダイヤル0120-114-936 (9:00〜17:45/土日祝、休業日を除く)
製品情報問い合わせ先
旭化成ファーマ株式会社
医薬情報部くすり相談窓口
〒100-0006
東京都千代田区有楽町一丁目1番2号
電話:フリーダイヤル0120-114-936 (9:00〜17:45/土日祝、休業日を除く)
26. 製造販売業者等
26.1 製造販売元
旭化成ファーマ株式会社
東京都千代田区有楽町一丁目1番2号